RILPL2在乳腺癌组织中的表达水平及其与临床病理指标的关系
刘伟光,王艳伟,刘方舟,崔学静,李 勇,董晓伟,李 硕,戴璐娴,盛安康,史素芳*
(1.扬州大学医学院附属扬州市妇幼保健院,江苏 扬州225000;2.邯郸市第一医院,河北 邯郸056002;3.河北工程大学管理工程与商学院,河北 邯郸056002;4.邯郸市中心医院,河北 邯郸056002;5.邯郸市第二医院,河北 邯郸056002;6.河北工程大学附属医院,河北 邯郸056002)
据2020 年全球癌症统计,乳腺癌(breast cancer,BC)的发病人数已经高于肺癌,占癌症总人数的11.7%,同时发现在大部分国家中其发病率及死亡率位居第一[1-2]。由于乳腺癌的生物学因子多而复杂,目前最广泛使用的临床病理标志物(雌激素受体、孕激素受体、人表皮生长因子受体2和Ki-67)已经不足以完全评估其治疗反应、转移模式和临床结果[3]。Rab溶酶体相互作用蛋白样2(RILPL2)是一种含有与Rab溶酶体相互作用蛋白(RILP)相似结构域的蛋白质。已有实验表明,RILPL2可能在调节子宫内膜癌免疫细胞浸润中起关键作用,并与该类患者的预后密切相关[4]。本研究检测RILPL2在乳腺癌组织和癌旁正常组织的阳性表达率及表达水平,分析其与乳腺癌患者的临床病理指标之间的关系,报道如下。
1 材料与方法
1.1 材料
1.1.1患者一般资料 收集2021年1月至12月期间河北工程大学附属医院乳腺科90例经病理证实的单侧乳腺癌患者。患者年龄33~55岁,中位年龄44岁,均为女性。所有患者随访资料完整,术前均没有放疗、化疗等抗肿瘤相关的治疗史;术后均行蒽环类药物治疗,然后行紫杉类药物化疗。该研究依据《赫尔辛基宣言》进行,同时得到了河北工程大学附属医院伦理委员会的批准同意。
1.1.2组织标本收集 每例患者同时取乳腺癌组织和癌旁正常组织;癌旁正常组织均距癌组织 5 cm以上,经病理证实无癌细胞。
1.1.3主要试剂 组织免疫化学染色(SP 法)试剂盒、二硝基联苯胺( DAB) 染色剂、RILPL2蛋白第一抗体均购自北京中杉金桥生物公司;组织蛋白裂解液、聚偏氟乙烯膜均购自山东亚亨生物公司。
1.2 方法
1.2.1免疫组织化学法 所有手术切除标本均经10%福尔马林液固定,常规石蜡包埋后行4 μm 连续切片。染色方法与步骤按免疫组织化学(SP 法)试剂盒内的说明书进行。使用RILPL2蛋白第一抗体(稀释1:300)对乳腺癌组织和癌旁正常组织分别进行染色和观察,分析由两名独立的病理学家进行分析和判定。
1.2.2结果分析与判定 RILPL2的阳性染色位于细胞的胞膜和胞质。采用半定量计分法[5]判断染色结果,计算组织切片中阳性细胞数目所占比例(≤25%计1分,26%~50%计2分,51%~75%计3分,≥76%计4分)和染色强度(不染色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分)的乘积。阴性(-)为<3分,弱阳性(+)为4~6分,中阳性(++)为7~9分,强阳性(+++)为>9分。
1.2.3蛋白免疫印迹分析RILPL2在组织中的表达 收集两种组织,并用磨浆机将其磨为匀浆。用蛋白裂解缓冲液裂解。提取组织中的总蛋白并使用蛋白检测试剂盒测定其浓度。将60 μg蛋白质进行凝胶电泳,并转移到聚偏氟乙烯膜上进行免疫印迹。在室温下,将膜封闭1 h,然后在4℃下与RILPL2蛋白第一抗体(稀释1∶500)孵育过夜,随后在室温下与第二抗体孵育2 h。膜上的蛋白质通过增强化学发光后通过图像分析仪进行定量。
1.3 统计学方法
应用SPSS 21.0 统计软件,计量资料以均数±标准差表示,采用t检验比较其差异;计数资料以n(%)表示,采用χ2检验分析RILPL2与临床病理指标之间的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 RILPL2在乳腺癌及癌旁正常组织中的表达
在癌旁正常组织中,RILPL2蛋白阳性染色呈棕黄色,主要染色于乳腺腺泡细胞的细胞质,细胞核不被染色;在乳腺癌组织中,RILPL2蛋白阳性染色为棕黄色,主要染色于乳腺癌细胞的细胞质和细胞膜,细胞核不被染色,并且其染色明显比癌旁正常组织浅(见图1)。

图1 RILPL2在乳腺癌及癌旁正常组织中的表达(×400)
2.2 RILPL2在乳腺癌组织和癌旁正常组织中的阳性表达率比较
免疫组织化学法分析90例乳腺癌组织和癌旁正常组织中RILPL2的表达,结果显示乳腺癌组织阳性表达率为32.22%(29/90),明显低于癌旁正常乳腺组织中的66.7%(60/90)(χ2=21.358,P<0.01),见表1。

表1 RILPL2在癌组织和癌旁正常组织中的表达
2.3 RILPL2在乳腺癌组织和癌旁正常组织中的表达水平
采用蛋白免疫印迹法评估RILPL2蛋白在乳腺癌组织及其癌旁正常组织中的相对表达水平,如图2所示。乳腺癌组织中RILPL2蛋白的相对表达水平(0.990±0.038)明显低于其在癌旁的正常乳腺组织的相对表达水平(0.625±0.023)(t=34.412,P<0.01)。

注:1—癌旁正常组织,2—乳腺癌组织
2.4 RILPL2与乳腺癌患者临床病理特征的关系
单因素分析显示,RILPL2表达与患者年龄无关(χ2=0.169,P>0.05),而与患者的肿瘤大小(χ2= 62.912,P<0.01)、组织学分级(χ2=56.535,P<0.01)、腋窝淋巴结转移(χ2=4.632,P<0.05)有关,见表2。
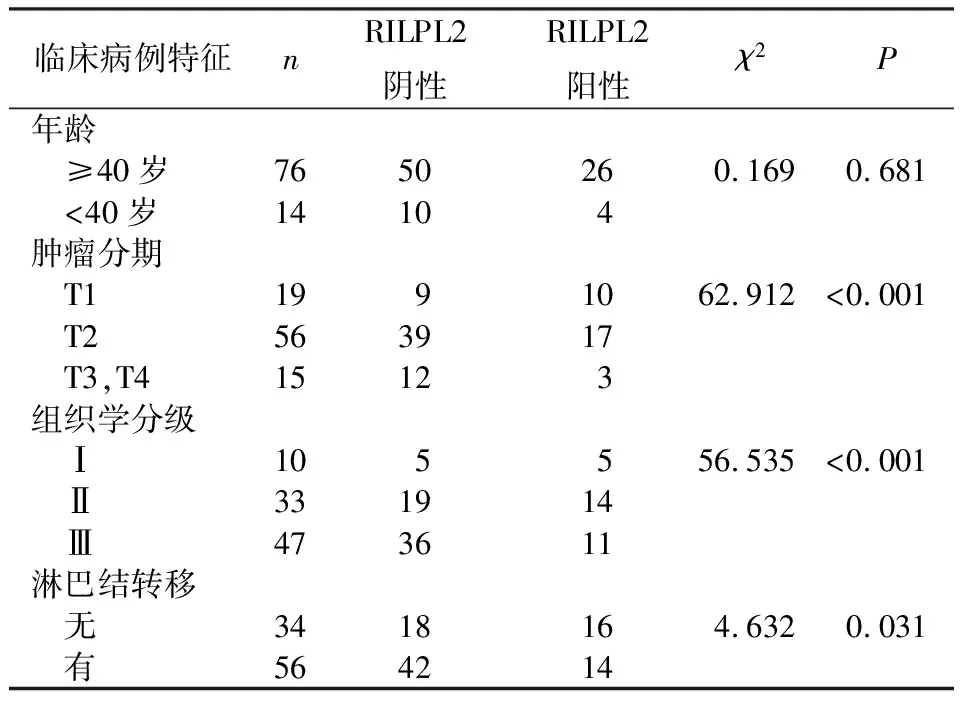
表2 RILPL2的表达与乳腺癌患者临床病例特征的关系
3 讨论
乳腺癌是发生于中老年女性的一种比较常见的肿瘤性疾病,尤其是绝经后的女性[6]。近年来,由于人们的生活方式及节奏的改变,此病的发病率表现为逐年增长的趋势,对女性的生活质量和生命健康造成严重的影响。乳腺癌具有异质性,这不仅体现在其临床表征和病理特征的不同,而且还观察到不同乳腺癌亚型之间表达的生物学分子不同[7-8]。普遍认为导管型乳腺癌的预后优于其他亚型,因为HER2和TNBC亚型经过治疗后往往容易发生复发和转移[9-10]。因此,探索并充分了解乳腺癌的分子亚型或生物分子标志物对治疗方案的选择起关键作用。
Rab溶酶体相互作用蛋白样2基因编码一种与RILP相似的含有Rab溶酶体相互作用蛋白样结构域。Rab7/Rab34复合体的形成促进RILP和动力蛋白-动态蛋白之间的相互作用,以引导晚期内体和溶酶体向微管运动[11]。与RILP不同,RILPL2不包括Rab7链接区,此链接区阻止溶酶体隔室异位表达[12]。尽管RILPL2不影响溶酶体的运输,由于其与活化的Rab34和Rab36相互作用,故它仍可能作为功能性Rab效应器[13-14]。LISE等[15]使用减少RILPL2突变或抑制MyoVa功能来表明RILPL2-MyoVa相互作用破坏抑制RILPL2的活性和随后Rac1的激活。因此,MyoVa介导的转运对RILPL2在神经元调节中的功能很重要。此外,先前的研究表明,RILPL2在病毒复制中发挥作用,可作为丙型肝炎病毒(HCV)治疗乳腺癌的潜在靶点[16]。
文献研究表明,RILPL2在机体多种组织中均有表达,其中包括大脑、心脏、肺脏、肝脏、肾脏、胰腺和胎盘等组织[12]。实验研究显示,RILPL2在子宫内膜癌组织中呈低表达,并且其表达水平与患者的预后显著相关,即表达水平升高的患者预后较好[17]。因此,RILPL2可以作为判断子宫内膜癌患者预后的生物分子标志物。本研究实验结果显示,RILPL2在乳腺癌组织中呈低表达,而在癌旁正常组织中呈高表达;其在乳腺癌组织阳性表达率、表达水平明显低于癌旁正常乳腺组织;RILPL2表达与患者年龄无关,而与患者的肿瘤分期、组织学分级、腋窝淋巴结转移有关。因此,这说明RILPL2可能作为一种新的评估乳腺癌复发风险的生物标志分子并指导乳腺癌精准治疗,然而RILPL2与其他病理标志物的相关性需待进一步的实验进行验证。

