罗氏沼虾蜕皮周期中内分泌调控和蜕皮信号通路相关基因的表达分析
丁丽 都婷婷 唐琼英 高权新 易少奎 杨国梁,2
(1.湖州师范学院 浙江省水生生物资源养护与开发技术研究重点实验室 中国水产科学研究院水生动物繁育与营养重点实验室,湖州 313000;2.江苏数丰水产种业有限公司,扬州 225654)
蜕皮是甲壳类动物整个生命周期中的一个重要生理现象,对其生长、发育、繁殖和肢体再生等过程起着重要作用[1]。蜕皮周期贯穿了甲壳动物整个生命周期,主要分为蜕皮间期(C)、蜕皮前期(D)、蜕皮期(E)和蜕皮后期(AB)[2]。蜕皮激素(ecdysteroids hormone, EH)作为蜕皮过程的主要调节因子,在蜕皮、卵巢生长和甲壳动物发育方面起着关键作用[3-4]。目前节肢动物的蜕皮激素信号通路的调控路径已经较为清晰[5-6](图1),蜕皮激素信号入核前的上游通路已经基本明确,认为蜕皮抑制激素(molt-inhibiting hormone, MIH)与G蛋白偶联受体结合,经过一系列的反应激活了蛋白激酶(protein kinase A, PKA),而具有活性的蛋白激酶入核后会调控甲壳动物蜕皮激素的产生[7]。蜕皮激素下游通路主要是蜕皮激素通过作用靶标-蜕皮激素受体(ecdysone receptor, EcR)和维甲酸类X受体(retinoid receptor, RXR)形成的EcR/RXR聚合体复合物[8-9],再利用应答基因调控靶基因的转录,其中应答基因包括ECR、RXR、E75、E74、E98、Br-C(broad-complex)、HR3、FTZ-F1(fushi tarazu transcription factor-1)等[10],最后通过几丁质合成、表皮几丁质降解、表皮蛋白质再生、激素分泌等过程完成蜕皮[11]。蜕皮是一个复杂的过程,不仅是由蜕皮激素单独作用,也有其他激素参与蜕皮过程,在烟草天蛾中发现了能够诱导昆虫蜕皮的第二个神经肽激素-蜕皮启动激素(ETH),而ETH是由气门上腺细胞(Inka细胞)所分泌的。蜕皮激素会作用于Inka分泌ETH,最终ETH会与其受体(ETHR)结合产生调节肌肉的神经肽,从而控制身体完成蜕皮[12]。
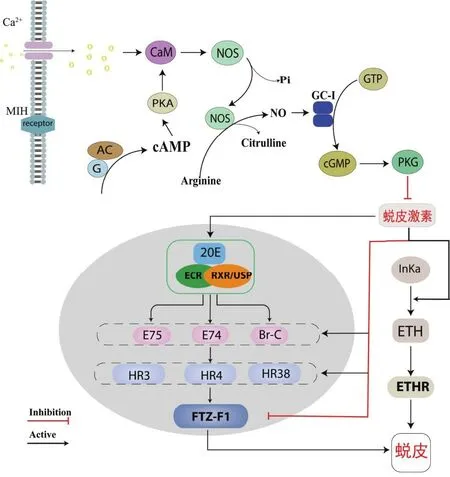
图1 节肢动物蜕皮调控过程示意图Fig.1 Schematic diagram of the regulation process of molting in arthropods
在蜕皮激素信号通路中,FTZ-F1作为晚期应答基因调控靶基因进行转录,从而调控蜕皮、变态等生理过程[13],信号通路中早期应答基因对FTZ-F1基因的调控主要通过HR3和E75介导的联合作用,FTZ-F1作为一种能力因子,也能通过促进保幼激素调节E75A基因的表达[14]。已有研究表明当FTZ-F1缺失的果蝇突变体,在向蛹转变的过程中会出现不能正常蜕皮的现象,说明FTZ-F1在果蝇蜕皮过程发挥重要的作用[15]。FTZ-F1基因在昆虫中研究较为深入,但在甲壳动物中却少有报道[16-17]。ETH信号通路是通过蜕皮启动激素受体(ecdysis triggering hormones receptor, ETHR)介导的,有研究表明蜕皮激素能刺激Inka细胞产生ETH和蜕皮前启动激素(pre-ecdysis triggering hormone, PETH),也可通过磷酸肌循聚集钙离子诱导ETHR从而调控下游基因参与蜕皮[18]。蜕皮启动激素受体有两种亚型,分别是ETHR-A和ETHR-B,这两种基因型在功能进化上承担着不同的作用,ETHR-A通过激活蜕皮激素、激肽、甲壳类心脏活性肽和鞣化激素可诱导果蝇所有发育阶段的蜕皮行为,而ETHR-B主要在蛹和成虫蜕皮时期发挥重要作用[19]。在昆虫类中,针对ETHR基因进行广泛研究并对其分型也有所研究,而在甲壳动物中仅发现了一种ETHR类型[20]。
罗氏沼虾原产于东南亚地区,自上世纪70年代引入我国,因其生长快、抗病性强、经济价值高等优点,在我国的广东、江苏和浙江地区广泛养殖,目前已成为我国重要的淡水养殖虾类之一[21]。罗氏沼虾的生长、发育、繁殖及断肢再生等生理过程都与蜕皮有关。在蜕皮过程中机体抵抗力会变弱,易感染病原导致死亡,会严重影响经济效益。目前蜕皮调控机制在昆虫中进行了广泛研究,而关于甲壳动物中蜕皮调控机制还未完全明晰[22],鉴于此,探究罗氏沼虾蜕皮调控机制对于罗氏沼虾高密度养殖具有重大意义。本研究以罗氏沼虾为对象,检测了谷氨酰胺合成酶(glutamine synthetase, GS)、β-N乙酰氨基葡萄糖苷酶(N-acetyl-β-D glucosaminidase,NAGase)、几丁质酶活力(chitinase)和蜕皮激素含量,分析了蜕皮周期内Mr-ETHR、Mr-FTZ-F1以及蜕皮相关基因Mr-RXR、Mr-ECR和Mr-MIH的表达量变化,从内分泌调控与基因调控两个层面探究罗氏沼虾蜕皮的调节机制,为甲壳动物蜕皮调控机制的研究提供理论基础。
1 材料与方法
1.1 材料
实验材料来源于江苏省高邮市数丰水产有限公司养殖的同一家系的罗氏沼虾,随机选取健康且规格一致的罗氏沼虾300尾,体重为(7-8)g并随机分成3组,每组100尾虾养殖于17 m2(6.87 m×2.55 m)的水泥池中,保持养殖水体pH 7-8.5,溶氧3-5 mg/L,水温25℃,养殖用水来源于育种中心北部的高邮湖水并做过滤处理,日投喂商品饲料2次(8:00和17:00)各一次,每隔3 d进行吸污换水,每次换1/3水,24 h增氧。根据形态特征与显微结构观察结合[23]的方法,选取蜕皮后期(AB期)、蜕皮间期(C期)、蜕皮前期(D期)和蜕皮期(E期)个体各6只,取血淋巴和肝胰腺组织,液氮速冻-80℃保存,用于酶活检测与蜕皮激素的测定以及蜕皮相关基因表达分析。
1.2 方法
1.2.1 罗氏沼虾蜕皮相关酶的活力测定 测定了蜕皮相关的几丁质酶、谷氨酰胺合成酶和β-N乙酰氨基葡萄糖苷酶的活性,取罗氏沼虾4个蜕皮时期的血淋巴和肝胰腺组织,肝胰腺组织按照组织质量(g)与PBS体积(mL)约为1∶9的比例进行冰水浴匀浆,取上清;血淋巴以6 000 r/min离心15 min,取上清。每组3个重复。由于几丁质酶主要存在于甲壳动物的外表皮中,少量存在于肝胰腺中,因此只测肝胰腺中的几丁质酶含量。使用几丁质酶检测试剂盒、谷氨酰胺合成酶检测试剂盒和β-N乙酰氨基葡萄糖苷酶检测试剂盒(南京建成生物工程研究所,南京)测定酶活性,参照试剂盒说明书在酶标仪(Multiskan FC)中进行检测。
1.2.2 罗氏沼虾蜕皮激素含量测定 取不同蜕皮周期的组织(血淋巴和肝胰腺),每个蜕皮周期采取3尾,肝胰腺组织与血淋巴组织进行冰水浴匀浆,取上清。使用对虾蜕皮激素酶联免疫分析试剂盒(上海源桔生物科技中心,上海)测定EH含量参照试剂盒说明书在酶标仪中进行检测。
1.2.3 罗氏沼虾ETHR与FTZ-F1基因CDS序列的克隆 通过NCBI数据库检索的日本沼虾ETHR基因序列(NN13868.1)和FTZ-F1基因序列(UQC00153.1)以及罗氏沼虾转录本序列为模板,利用Primer Premier 5.0设计特异性引物,引物序列信息见表1。采用Trizol法提取罗氏沼虾肝胰腺组织总RNA,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,大连)试剂盒合成cDNA,以其为模板进行PCR扩增,扩增产物送至天一辉远(武汉)股份有限公司进行测序验证。通过一代测序获得的序列进行手动拼接,最终获得罗氏沼虾ETHR、FTZ-F1基因的CDS全长。
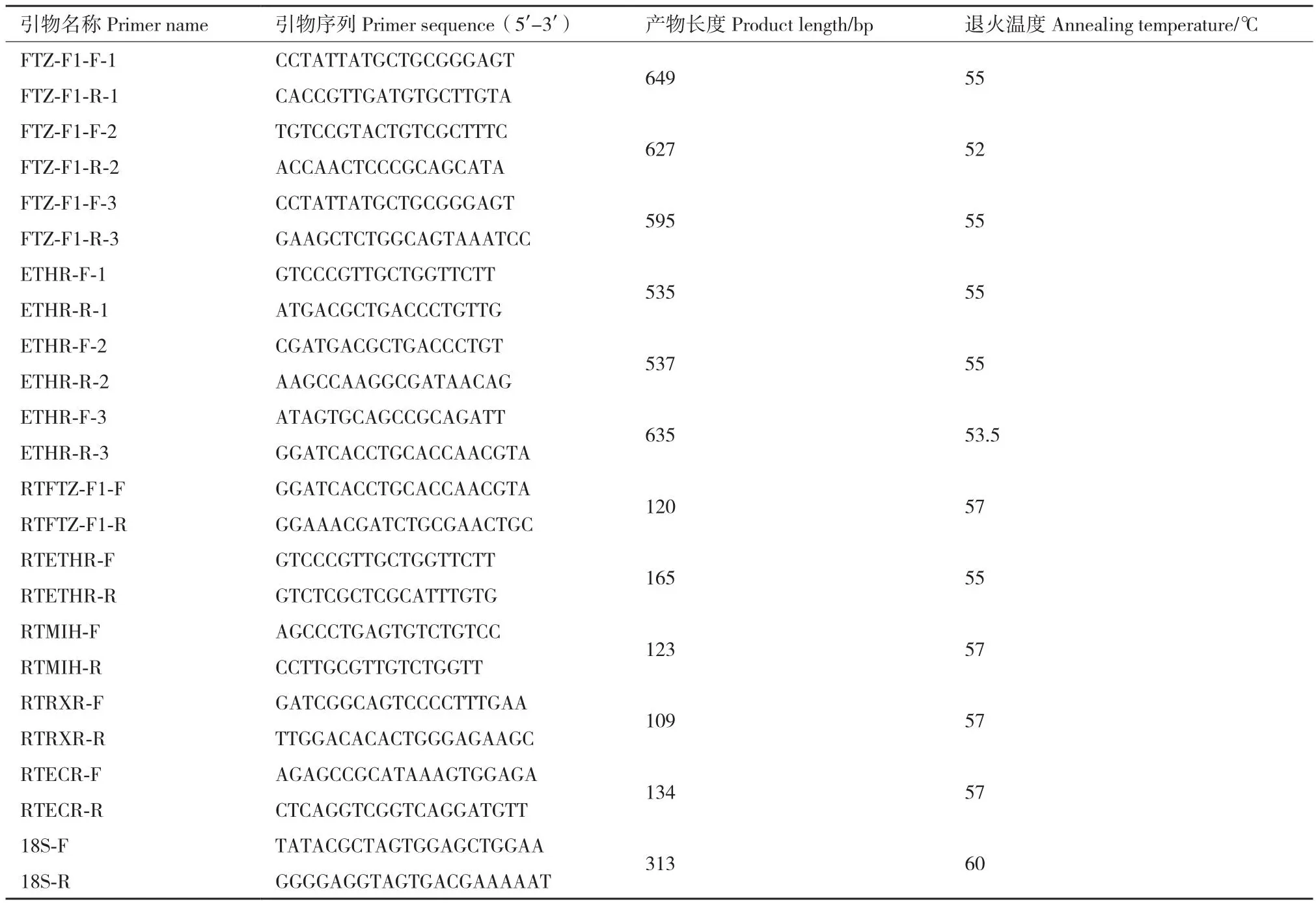
表1 实验所用引物序列Table 1 Primer sequences used in the experiment
1.2.4 罗氏沼虾蜕皮相关基因生物信息学分析 获得罗氏沼虾Mr-ETHR、Mr-FTZ-F1 CDS 全长序列后,使用下列软件与工具进行生物信息学分析:采用ORFfinder在线预测开放阅读框,SMART在线翻译蛋白氨基酸序列,BLAST对氨基酸序列进行验证和同源性分析,在线软件预测蛋白质的等电点、分子量、不稳定系数和亲水性等特征,使用Expasy Protaram以及Expasy Protscale在线软件预测蛋白的信号肽与跨膜结构与NCBI中保守结构域(CDD)数据库比对,功能结构,在线分析蛋白质二级结构组成与三级结构,通过ClustalX与GeneDoc进行多序列比对,采用MEGA 6.0以邻接法(Neighbor Joining,NJ)法构建系统进化树。
1.2.5 罗氏沼虾蜕皮相关基因表达分析 提取罗氏沼虾2个组织(肝胰腺和血淋巴)、4个蜕皮阶段(AB、C、D和E)总RNA,选取高质量的RNA 样品,进而反转录获得 cDNA,用于后续RT-qPCR。根据基因序列信息,采用Primer Premier 5.0 软件设计引物(表1),选用18S rRNA为内参基因,采用TB GreenTMPremix ExTaqTMII(TaKaRa,大连)试剂盒进行RT-qPCR,其反应体系(20 μL)如下:SYBRRPremix Ex TaqTMII 10 μL,上、下游引物各0.8 μL,cDNA 1.6 μL,ddH2O 6.8 μL;反应条件:95℃ 30 s;95℃ 5 s,60℃ 30 s,35个循环。基因相对表达量用2-△△Ct公式[24]进行计算。
1.2.6 统计方法 数据采用平均值±标准误的形式表示,采用SPSS 19.0软件进行单因素方差分析(One-Way ANOVA),采用Duncan多重比较进行组间差异分析,P<0.05为差异显著。采用TBtools[25]进行热图绘制,并对基因进行聚类分析。使用Graphpad prism(版本号9.5.0,GraphPad软件公司,美国)进行基因间相关性分析。
2 结果
2.1 罗氏沼虾蜕皮相关酶在蜕皮周期的变化
采集不同蜕皮时期罗氏沼虾的血淋巴和肝胰腺组织进行酶活测定,结果显示肝胰腺中GS酶活性在D期显著高于其他蜕皮时期(P<0.05),在E期活性降至最低,C期和D期GS酶活性无明显差异。血淋巴中GS酶活性在AB期显著高于其他蜕皮时期(P<0.05),且其他蜕皮时期GS酶活性无明显差异;在肝胰腺和血淋巴中,NAG酶活性均呈现先上升后下降的趋势,且在D期活性达到最高。肝胰腺中NAG酶活性在C期显著低于D期(P<0.05),AB期和E期间NAG酶活性无明显差异。血淋巴中NAG酶活性在D期显著高于AB期(P<0.05),且各个蜕皮时期NAG酶活性差异显著;肝胰腺中几丁质酶活性在AB期达到最高,在E期活性最低,且各个蜕皮时期差异显著,总体呈现上升趋势(图2)。
2.2 罗氏沼虾蜕皮激素在蜕皮周期的动态变化
选取罗氏沼虾不同蜕皮时期的肝胰腺和血淋巴组织进行蜕皮激素含量测定,结果显示:在肝胰腺和血淋巴中,EH含量在不同蜕皮时期的变化趋势一致。在肝胰腺和血淋巴组织中,EH含量均在AB期达到最高。在肝胰腺和血淋巴中EH含量呈现上升的趋势,AB期含量显著高于C期(P<0.05),且D期和E期间含量无明显差异(图3)。

图3 罗氏沼虾肝胰腺与血淋巴中不同蜕皮时期蜕皮激素含量变化Fig.3 Dynamics of ecdyhormone content in hepatopancreas and hemolymph in M.rosenbergii at different molting stages
2.3 罗氏沼虾ETHR和FTZ-F1基因生物信息学分析
通过克隆获取罗氏沼虾ETHR基因和FTZ-F1基因的CDS序列,并命名为Mr-ETHR(Gene Bank No:OQ383351)和Mr-FTZ-F1(Gene Bank No:OQ383352)。Mr-ETHR基因开放阅读框编码区全长1 173 bp,编码390个氨基酸,蛋白的分子量为44.39 kD,理论等电点为9.04,具有亲水性;与NCBI保守结构域(CDD)数据库对比,表明Mr-ETHR具有G蛋白偶联受体家族(G Protein-Coupled Receptors,GPCR)典型的七次跨膜结构域,3个胞外环含有两个高度保守的的半胱氨酸残基,这两个残基可以形成二硫键用来稳固受体。氨基酸序列多序列比对以及同源性分析,发现Mr-EHTR基因与日本沼虾(M.nipponense, ANN13868.1)的同源性最高,为97.69%,主要是位于21aa和30aa分别由亮氨酸突变为组氨酸和缬氨酸突变为亮氨酸,表明Mr-EHTR基因较为保守。系统进化分析结果显示,10个物种分成两大支,为甲壳纲和昆虫纲支。在家蚕、烟草天蛾、赤拟谷盗和埃及伊蚊中ETHR-A和ETHR-B被单独分支,说明ETHR-A和ETHR-B在功能上有所区别,而罗氏沼与日本沼虾聚为一支,说明其亲缘关系最近(图4-A)。
Mr-FTZ-F1基因开放阅读框编码区全长1 206 bp,编码401个氨基酸,蛋白的分子量为43.65 kD,理论等电点为6.35,具有疏水性;利用CDD数据库比对,发现Mr-FTZ-F1基因存在NR_LBD_Ftz-F1_like结构域(169-399 aa)。将罗氏沼虾FTZ-F1基因氨基酸序列与其他甲壳动物氨基酸序列进行对比发现Mr-FTZ-F1基因与日本沼虾(M.nipponense,UQC00153.1)的同源性最高,为98.71%,与南美白对虾(Penaeus vannamei, XP_027236937.1)、克氏原螯虾(Procambarus clarkia, XP_045625434.1)、日本对虾(P.japonicus, XP_042874083.1)和斑节对虾(P.monodon, XP_037803373.1)的同源性均高于80%,说明Mr-FTZ-F1基因具有一定的保守性。Mr-FTZ-F1基因系统进化树显示,13个物种被分成两大支,并细分为5小支,甲壳纲中的7个物种聚为一支,罗氏沼虾与同属的日本沼虾聚为一支,表明其亲缘关系最近(图4-B)。
2.4 罗氏沼虾蜕皮相关基因在不同蜕皮周期的表达分析
选取不同蜕皮周期罗氏沼虾的血淋巴和肝胰腺组织,分析Mr-ETHR、Mr-FTZ-F1、Mr-RXR、Mr-ECR和Mr-MIH基因表达,结果显示在肝胰腺和血淋巴中,Mr-ETHR均在AB期表达量最高。在肝胰腺中,Mr-ETHR在D期表达量远远低于AB期(P<0.05),总体呈上升趋势。在血淋巴中,Mr-ETHR表达量在E期显著低于其他蜕皮时期(P<0.05),C期、D期和AB期间无明显差异。Mr-FTZ-F1在肝胰腺和血淋巴中的表达量均在D期最高,Mr-FTZ-F1在D期的表达量显著高于AB期(P<0.05),总体呈现先上升后下降趋势(图5)。
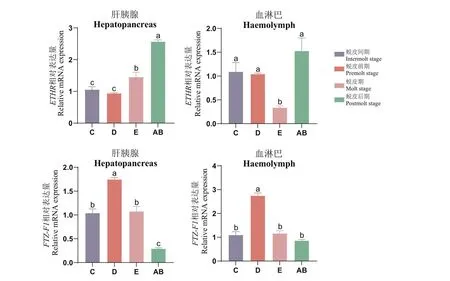
图5 在不同蜕皮时期内Mr-ETHR、Mr-FTZ-F1基因在肝胰腺和血淋巴组织中的表达情况Fig.5 Expressions of Mr-ETHR and Mr-FTZ-F1 in hepatopancreatic and hemolymphatic tissues at different molting stages
聚类分析结果表明,Mr-ECR在不同蜕皮时期的表达模式与Mr-RXR相似,在肝胰腺和血淋巴组织中,均在AB期表达量最高,且总体呈现上升趋势。Mr-ETHR在肝胰腺与血淋巴组织中均在AB期表达量最高,Mr-ETHR的表达模式与Mr-ECR和Mr-RXR相似,而Mr-FTZ-F1与Mr-MIH被单独聚为一支。在肝胰腺和血淋巴组织中Mr-FTZ-F1在D期表达量最高,在AB期表达量最低。Mr-MIH在C期表达量最高,总体呈现下降趋势。Mr-FTZ-F1与Mr-MIH表达模式与其他基因并不相似(图6)。
2.5 罗氏沼虾蜕皮基因间相关性分析
相关性分析显示:在肝胰腺组织中,Mr-FTZ-F1与Mr-ECR的表达量呈极显著负相关(r=-0.833 9,P<0.01),与Mr-ETHR的表达量呈极显著负相关(r=-0.627 5,P<0.01),而在血淋巴组织中,Mr-FTZ-F1与Mr-MIH表达量呈极显著正相关(r=0.666 5,P<0.01);在肝胰腺组织中,Mr-RXR与Mr-ETHR表达量呈极显著正相关(r=0.703 0,P<0.01)。肝胰腺和血淋巴中Mr-ETHR与Mr-ECR表达量呈极显著正相关(r=0.868 0,P<0.01)。
3 讨论
在罗氏沼虾蜕皮过程中,会涉及到机体内能量代谢以及渗透压的变化。谷氨酰胺通过参与血淋巴渗透压调控来维持机体正常的生命活动[26],而谷氨酰胺合成酶(GS)是谷氨酰胺合成途径必不可少的关键酶,在机体氨基酸代谢过程中具有重要作用[27]。已有研究发现在凡纳滨对虾[28]和克氏原螯虾[29]蜕皮过程中谷氨酰胺合成酶中参与了能量代谢过程与渗透压调节。在中国对虾(Fenneropenaeus chinensis)的研究中发现谷氨酰胺合成酶能通过间接的方式参与免疫防御过程[30]。本研究发现GS酶在罗氏沼虾血淋巴组织中的活力明显高于肝胰腺中,推测可能是因为在蜕皮过程中机体抵抗力下降时,血淋巴作为甲壳动物中主要的免疫与渗透调节器官起着免疫防御病毒感染作用[31]。已有研究表明肝胰腺是甲壳动物的主要代谢器官,包含大量的酶与蛋白质,而GS酶参与细胞内多种酶活动[32]。罗氏沼虾蜕皮后,在肝胰腺组织中,GS酶活力骤降,推测罗氏沼虾蜕皮后期短时间内因不能进食从而需要消耗机体自身大量的蛋白质,而GS酶可通过催化合成谷氨酰胺并用于蛋白质合成。
甲壳动物的蜕皮包括旧的外骨骼蜕去、新的外骨骼形成等过程,在此过程中几丁质酶可起到降解外骨骼的作用,而NAGase作为几丁质级联催化降解途径的关键酶,在蜕皮过程中也发挥了关键作用[33]。研究表明几丁质酶在斑节对虾和中国对虾甲壳动物中参与了蜕皮过程[34-35]。在日本沼虾(M.nipponense)和中华绒螯蟹(Eriocheir sinensis)甲壳动物研究中发现,NAG酶活性均在蜕皮前期达到峰值,并与蜕皮激素含量呈正相关[36-37]。本研究测定了几丁质酶和NAG酶在不同蜕皮周期的活性变化,发现在肝胰腺和血淋巴组织中NAG酶均在蜕皮前期的活性达到最高,推测蜕皮前期是头胸甲表皮结构显著变化的时期,而NAG酶在此时期高活力可保证高效降解旧的外骨骼,促进罗氏沼虾的顺利蜕皮,而几丁质酶在蜕皮后期活性达到最高。
甲壳类动物的蜕皮与生长受多种激素及蜕皮相关基因的调控,黄姝等[38]发现中华绒螯蟹蜕皮激素含量变化在蜕皮周期中是波动的,且在蜕皮间期含量最低。本研究结果表明,血淋巴与肝胰腺中的蜕皮激素含量在罗氏沼虾不同蜕皮时期内有差异,其中蜕皮间期的含量最低,在蜕皮后期含量达到峰值。ETH-ETHR信号通路在节肢动物中普遍存在,ETHR与配体蜕皮启动激素(ETH)结合后会参与蜕皮过程,而蜕皮激素会介导ETHR基因的表达[12]。本研究发现在肝胰腺组织中,Mr-ETHR在蜕皮后期的表达量最高,总体呈现上升趋势,与蜕皮激素含量在不同蜕皮时期的变化趋势一致,进一步验证了蜕皮激素能够诱导Mr-ETHR基因的表达。已有研究证实了甲壳动物的蜕皮激素与FTZ-F1具有紧密联系,通过去除三疣梭子蟹单侧眼柄后检测FTZ-F1基因的表达量,发现当蜕皮激素浓度升高到峰值会抑制FTZ-F1基因的表达[39]。本研究中蜕皮后期蜕皮激素含量最高,而Mr-FTZ-F1基因的表达量却是最低,推测罗氏沼虾蜕皮激素含量在一定峰值内会抑制Mr-FTZ-F1的表达,两者之间可能存在负调控作用。同样,已有研究表明蜕皮激素含量与MIH的表达量具有显著相关性[40]。本研究发现罗氏沼虾MIH表达具有明显规律:Mr-MIH在C期表达量最高,在AB期表达量最低,呈逐渐下降趋势;通过关联罗氏沼虾蜕皮周期蜕皮激素含量的变化,结果显示Mr-MIH表达量与蜕皮激素含量呈现负相关性,进一步验证了罗氏沼虾MIH可以抑制蜕皮激素的合成从而调控着罗氏沼虾蜕皮的发生。Mr-FTZ-F1和Mr-MIH的表达模式相近,并且呈强正相关,表明Mr-FTZ-F1和Mr-MIH在调控罗氏沼虾蜕皮通路中的调控模式相近。在中华绒螯蟹、中国明对虾的研究中,发现RXR基因与ECR基因能够调控甲壳动物的蜕皮[41-42]。本研究证实了罗氏沼虾Mr-ETHR、Mr-RXR和Mr-ECR在蜕皮周期中表达量呈强正相关性,在血淋巴与肝胰腺组织中,Mr-RXR基因与Mr-ECR基因都在蜕皮后期的表达量最高,与蜕皮激素含量趋势一致,推测RXR基因需与ECR基因结合形成二聚体从而介导罗氏沼虾的蜕皮,在罗氏沼虾的蜕皮功能上表现出协同作用。
4 结论
本研究通过测定在罗氏沼虾中不同蜕皮时期内蜕皮相关酶的活性、蜕皮激素的含量以及蜕皮信号通路中相关基因的表达量,发现谷氨酰胺合成酶、β-N乙酰氨基葡萄糖苷酶和几丁质酶在不同蜕皮周期内活性均有差异,Mr-ETHR、Mr-RXR和Mr-ECR共同参与调控罗氏沼虾蜕皮且其表达量具有显著的正相关性,并对蜕皮的发生起着正向调节作用,而Mr-FTZ-F1和Mr-MIH在蜕皮信号通路中起负调节作用且具有相似的调控模式,证实了罗氏沼虾的蜕皮受多种酶、蜕皮激素以及蜕皮通路中基因的调控,为甲壳动物蜕皮调控机制的研究提供理论基础。

