杰氏棒杆菌L-天冬氨酸α脱羧酶半理性改造及全细胞催化合成β-丙氨酸
刘浩 马世杰 周哲敏 崔文璟
(江南大学生物工程学院 工业生物技术教育部重点实验室,无锡 214122)
β-丙氨酸,又称3-氨基丙酸,是生物体内合成泛酸的重要前体物质,也是自然界中唯一存在的β型氨基酸。β-丙氨酸及其衍生物广泛应用于制药,如合成帕米磷酸钠[1]、肌肽[2]等,以及食品、饲料和化工等领域[3-4],被认为是12种最具发展潜力的三碳化合物之一[5],市场需求量日益上升。通过PanD催化L-天冬氨酸制备β-丙氨酸是主要途径之一,具有重要的工业应用价值,相较于化学合成法,生物转化法更加绿色、可持续。
L-天冬氨酸-α-脱羧酶(L-aspartate-αdecarboxylase, EC 4.1.1.11, PanD, ADC)能够专一地催化L-天冬氨酸脱去α羧基生成β-丙氨酸。ADC酶最早是由Williamson等[6]从Escherichia coli中分离得到。随后Chopra等[7]异源表达了结核分歧杆菌来源的PanD,并首次进行了结晶。PanD主要存在于细菌、古细菌、放线菌等低等生物中,目前对PanD的报道主要集中在大肠杆菌[8]、谷氨酸棒状杆菌[9](Corynebacterium glutamicum)、枯草芽孢杆菌[10](Bacillus subtilis)、结核分枝杆菌[11](Mycobacterium tuberculosis)、幽门螺旋杆菌[12](Helicobacter pylori)等。PanD可分为磷酸吡哆醛(PLP)依赖型和丙酮酰基团依赖型两类,磷酸吡哆醛依赖型PanD催化过程中依赖于辅因子PLP,主要来源于Tribolium castaneum、果蝇(Drosophila melanogaster)等真核生物,蛋白结构和催化机理尚无明确报道[13],而丙酮酰基团依赖型PanD的催化能力依赖自加工形成的丙酮酰基团,无需外源辅助因子,且催化特异性高,相较于磷酸吡哆醛依赖型更具工业应用前景。丙酮酰基团依赖型PanD 合成时,首先转录翻译成无活性的原酶(约15 kD),随后在Gly24-Ser25处发生断裂,自剪切形成1个C端含有羟基的β-亚基(约3 kD)和1个N端含有丙酮酰基的α-亚基(约12 kD)[14-16]。
目前关于PanD的克隆表达、分子改造及应用等方面的研究逐渐升温,张潇潇[17]成功在E.coli BL21(DE3)菌株中异源表达了顿齿棒杆菌(Corynebacterium crenatum)来源的PanD 基因,催化生产β-丙氨酸,最终浓度达到76.47 mg/L。范雪萍等[18]将特基拉芽孢杆菌(B.tequilensis)来源的PanD 在E.coli BL21(DE3)中重组表达,以200 g/L L-天冬氨酸作为底物,β-丙氨酸的最终产量达66.4 g/L。Li等[19]构建了过量表达谷氨酸棒杆菌ADC的大肠杆菌重组菌,全细胞催化生产β-丙氨酸,产量达到24.8 g/L。Zhang等[20]基于酶结构与功能关系,将B.subtilis来源PanD的56号位点突变为丝氨酸,最终比酶活达到7.8 U/mg。Pei等[21]通过易错 PCR对B.subtilis来源PanD进行改造,成功筛选到V68I以及I88M两个突变体,其酶活相比野生型提高了18%-22%;陈虹[22]对T.castaneum来源的PanD进行建库筛选,筛选到两个酶活明显提高的突变体,最终267 g/L的底物L-天冬氨酸可生成170.53 g/L的β-丙氨酸,转化率达到95.45%。现有对L-天冬氨酸α脱羧酶的改造普遍存在酶活力低[23-28]的问题,这是限制其工业应用的关键性因素。因此,寻找初始活性较高的L-天冬氨酸α脱羧酶,并定向进化改造PanD基因进一步提高催化效率,对酶法合成β-丙氨酸具有重要的研究意义和工业价值。
本研究以杰氏棒杆菌(Corynebacterium jeikeium)来源的PanD基因为研究对象,通过半理性设计手段对其定向进化,获得了酶学性质显著提升的突变体酶,并利用全细胞催化技术实现了β-丙氨酸的高效合成,对酶法生产β-丙氨酸以及微生物发酵法合成β-丙氨酸下游产物(泛酸、肌肽等)具有十分重要的意义。
1 材料与方法
1.1 材料
大肠杆菌表达宿主菌E.coli BL21(DE3)、克隆宿主菌E.coli JM109、重组质粒pET-28a(+)为本实验室保存。种子培养基为LB培养基。Corynebacterium jeikeium来源的PanD基因由安升达公司合成。L-天冬氨酸钠、IPTG、卡那霉素购于上海生工生物工程有限公司。β-丙氨酸(购于Sigma公司)。酵母提取物、蛋白胨购于Oxford公司。异硫氰酸苯酯(phenyl isothiocyanate, PITC)购于阿拉丁公司。
蛋白纯化仪和纯化柱,GE Healthcare UK Ltd;Bio-Rad PCR仪器;日立高效液相色谱仪。
1.2 方法
1.2.1 同源建模和分子对接 将杰氏棒杆菌来源L-天冬氨酸α脱羧酶的氨基酸序列(GenBank登录号:CR931997.1)上传至AlaphFold2在线服务器进行结构预测。L-天冬氨酸α脱羧酶分子与配体L-天冬氨酸分子对接通过Maestro半柔性对接实现。
1.2.2 计算机模拟突变及虚拟突变位点的选择 通过Rosetta软件进行虚拟突变,对各位点解折叠自由能变化(ΔΔG)结果进行统计,筛选突变后折叠自由能(ΔG)下降显著的位点。在Uniprot数据库中通过BLAST寻找筛选PanD的高同源性蛋白,ClustalX2软件对这些蛋白进行多序列同源比对分析[21],剔除高保守位点。
1.2.3 突变体文库构建方法 以野生型CJPanD基因的重组质粒pET28a(+)-PanD为模板,设计NNK简并密码子引物,通过高保真聚合酶Prime STAR Max DNA Polymerase进行全质粒PCR。采用Dpn I酶于37℃对PCR产物进行酶切以消化野生型模板,随后转化克隆宿主菌E.coli JM109,涂布于平板上,待平板上长出菌落后,悉数洗下平板上的菌落,提取混合质粒,即为突变体文库,再将混合质粒导入表达宿主菌E.coli BL21(DE3),涂布于平板上。挑取平板上的单菌落,接种于96孔板中,培养一段时间后,转接至另一96孔板中,约2-3 h后,加入终浓度为0.3 mmol/L的IPTG诱导,继续培养12 h取出,作为突变体库备用。
1.2.4 突变体的初筛和复筛
1.2.4.1 突变体的初筛 将培养12 h的96孔板取出,离心去上清后,加入500 μL,浓度为100 mmol/L的L-天冬氨酸钠溶液,放入37℃摇床反应30 min后取出,再次离心,上清即为全细胞反应液。突变体的初筛采用薄层层析,薄层层析是在薄板上进行的一种层析分离方法,其原理是溶液中各组分在固定相和流动相中的溶解度不同,在薄板上的迁移也不同,从而达到分离的目的,筛选突变体时用来定性非常方便。在距离薄板下端边缘1.5 cm处划线,样品间隔1 cm,点样1 μL,先点上底物L-天冬氨酸和产物β丙氨酸,再依次点上全细胞反应液,置于层析杠中,加入展开剂,展开剂没过薄板下端边缘1 cm左右,层析约3 h,停止层析。取出薄板,用吹风机吹干表面的展开剂后均匀地喷上茚三酮-乙醇溶液,再使用吹风机吹至出现蓝紫色斑点,即可进行观察定性。
1.2.4.2 突变体的复筛 对初筛有效果的突变体进行纯化,测定纯酶酶活。
1.2.5 酶的表达与纯化 将重组大肠杆菌pET28a-CJPanD-BL21、pET28a-CJPanD-L39A-BL21的单克隆接种于5 mL LB培养基(含有50 μg/mL卡那霉素)中,置于37℃、200 r/min的摇床中,过夜振荡培养,作为种子液。按1%(体积分数)接种量接种于含有50 μg/mL卡那霉素的100 mL LB培养基中,37℃、200 r/min,振荡培养至OD600为0.6-0.8。加入终浓度为0.3 mmol/L的IPTG,在25℃条件下诱导表达16-18 h左右。利用AKTA蛋白纯化仪和His Trap HP纯化柱对目的蛋白进行分离纯化。收集细胞培养液,12 000 r/min离心5 min,弃去上清液,收集沉淀。用Binding缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、20 mmol/L咪唑)重新悬浮细胞,置于冰上进行超声波破碎,待溶液澄清之后,于4℃、12 000 r/min离心30 min,收集细胞破碎上清液。上清液经0.45 μm滤膜过滤后作为粗酶液上样,用Binding缓冲液洗去非结合蛋白,用15个柱体积的Elution缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L咪唑)进行线性洗脱,收集洗脱峰。将收集到的蛋白放入50 mmol/L磷酸盐(pH 7.0)缓冲液中,4℃过夜透析除去咪唑。利用浓度为15%的SDS-PAGE对分离纯化后的蛋白进行电泳检测,利用Brandford法测定目的蛋白浓度。
1.2.6 L-天冬氨酸和β-丙氨酸检测 L-天冬氨酸和β-丙氨酸采用异硫氰酸苯酯(PITC)进行衍生。L-天冬氨酸和β-丙氨酸经衍后采用HPLC测定,色谱柱为DiKMA Diamonsil C18(2)(5 μm × 4.6 mm ×250 mm);流动相A溶液为80%(体积分数)乙腈水溶液,流动相B为97∶3(体积分数,pH 7.0)的0.1 mol/L醋酸钠-乙腈溶液;梯度洗脱:0-30 min,B溶液由95%下降至70%;35-40 min,B溶液由70%上升至95%;40-42 min,B溶液梯度保持不变,检测波长为254 nm,柱温为40℃。
1.2.7 酶学性质测定
1.2.7.1 最适温度测定 将0.1 mg重组酶分别置于30、37、40、45、55、60、65、70、80℃金属浴中预热5 min,然后与同样预热过5 min的pH 7.0的200 mmol/L底物L-天冬氨酸钠反应10 min,测定酶活后分析酶的最适反应温度。
1.2.7.2 温度稳定性测定 将0.1 mg重组酶液置于30、37、40、50、55、60、70、80℃孵育30 min后,置于冰上冷却5 min。加入终浓度 200 mmol /L L-天冬氨酸钠,于37℃,pH 7.0条件下反应10 min 测定残余酶活。将初始酶活定义为100%,分析温度对酶稳定性的影响。
1.2.7.3 最适pH测定 将0.1 mg重组酶置于37℃金属浴预热5 min,预热后分别加至pH 3.0、4.0、4.5、5.0、5.5、6.0、7.0、7.5、8.0、9.0的缓冲液中,缓冲液中含有200 mmol/L底物L-天冬氨酸钠,反应10 min,测定酶活性,分析酶的最适反应pH。
1.2.7.4 pH稳定性测定 将0.1 mg重组酶液置于pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0的缓冲液中,孵育60 min后,加入终浓度 200 mmol /L L-天冬氨酸钠,于37℃,pH 7.0条件下反应10 min测定残余酶活。将初始酶活定义为100%,分析pH对酶稳定性的影响。
1.2.7.5 动力学常数测定 在终浓度100 μg/mL纯酶液中,分别加入终浓度(1、2、5、10、20、50、80、100、200、400 mmol/L)L-天冬氨酸钠,于37℃,pH 7.0条件下,反应5 min,100℃、15 min终止反应,检测β-丙氨酸产量,测定初始反应速率。采用GraphPad Prism9软件拟合曲线,测定动力学常数Km,Kcat。将在37℃,pH 7.0的条件下,每分钟转化L-天冬氨酸钠生成1 μmol β-丙氨酸所需酶量定义为一个酶活力单位U。
1.2.8 突变体结构分析 通过Pymol软件分析正向突变酶的空间结构变化,推测分析PanD酶学性质的变化与蛋白分子结构改变的联系。
1.2.9 全细胞催化合成β-丙氨酸的体系优化 重组菌细胞经培养诱导后,离心收集,浓缩到OD600=40。在37℃,5 mL反应液(pH 7.0)中,加入L-天冬氨酸钠固体粉末至终浓度1.5 mol/L,持续振荡。每隔一段时间取样测定L-天冬氨酸剩余量和β-丙氨酸的生成量,并由此计算转化率和产量。
2 结果
2.1 杰氏棒杆菌L-天冬氨酸α脱羧酶在大肠杆菌中的表达与纯化
将合成的目的基因连接到pET28a(+)T7启动子下游后,获得重组质粒pET28a(+)-CJPanD,将上述重组质粒转化到E.coli BL21(DE3)感受态细胞中,获得重组菌E.coli BL21(DE3)/pET28a(+)-CJPanD。将构建好的质粒导入表达宿主E.coli BL21(DE3),重组菌在大肠杆菌中表达纯化结果见图1,CjPanD重组表达后自剪切形成1个C端含有羟基的β-亚基(约3 kD)和1个N端含有丙酮酰基的α-亚基(约12 kD)。
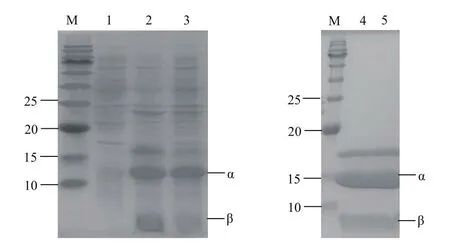
图1 重组酶CJpanD及突变体蛋白电泳Fig.1 SDS-PAGE analysis of recombinant enzyme CJpanD and mutants
2.2 计算机模拟突变
蛋白质的解折叠自由能ΔG是蛋白质稳定性的重要参数。若突变后的ΔG较野生型下降,则表明该突变有利于提高蛋白质的稳定性;若突变后ΔG增加,则说明该突变不利于蛋白质的稳定。排除高保守位点H11后,确定C26、L39、I49、N72、L55和T56共6个突变热点,相关位点的折叠自由能变化如表1。
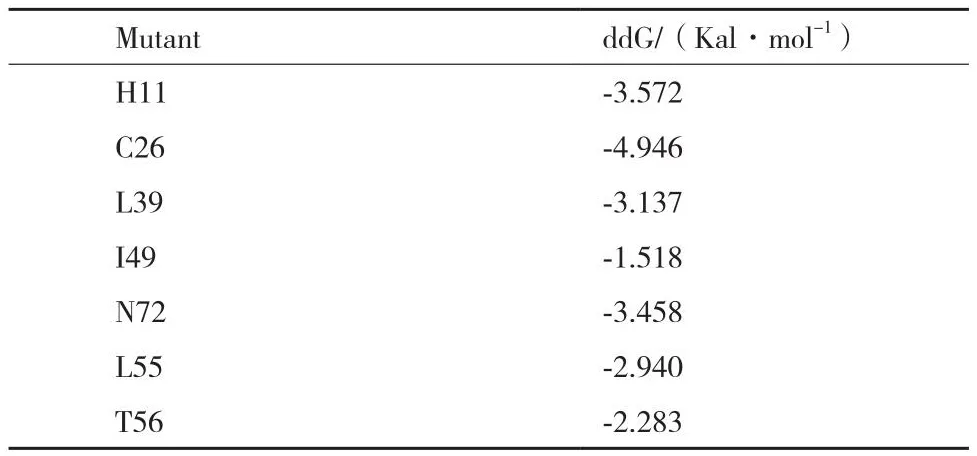
表1 拟突变氨基酸的选取Table 1 Selection of pseudo-mutant amino acids
2.3 突变体文库的初筛和复筛
根据计算机模拟突变结果,设计饱和突变引物,简并密码子为NNK,构建含有上述突变位点的质粒,在96孔板中的反应后点于薄板上,部分薄层层析初筛结果如图2所示,对初筛的正向突变体进行测序,筛选到C26L、C26F、L39A、I49L、L55F、T56W、N72。
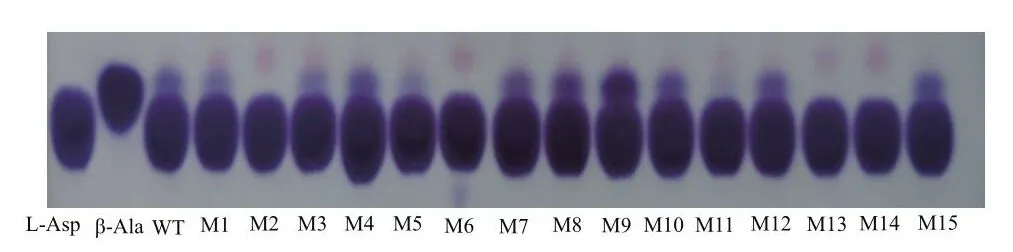
图2 薄层层析结果Fig.2 Results by thin layer chromatography
对初筛有效果的正向突变体进行复筛验证,在37℃,底物L-天冬氨酸浓度200 mmol/L的条件下测定重组酶的比酶活(图3),经过实验验证,L39A突变体的比酶活是野生型的1.4倍。
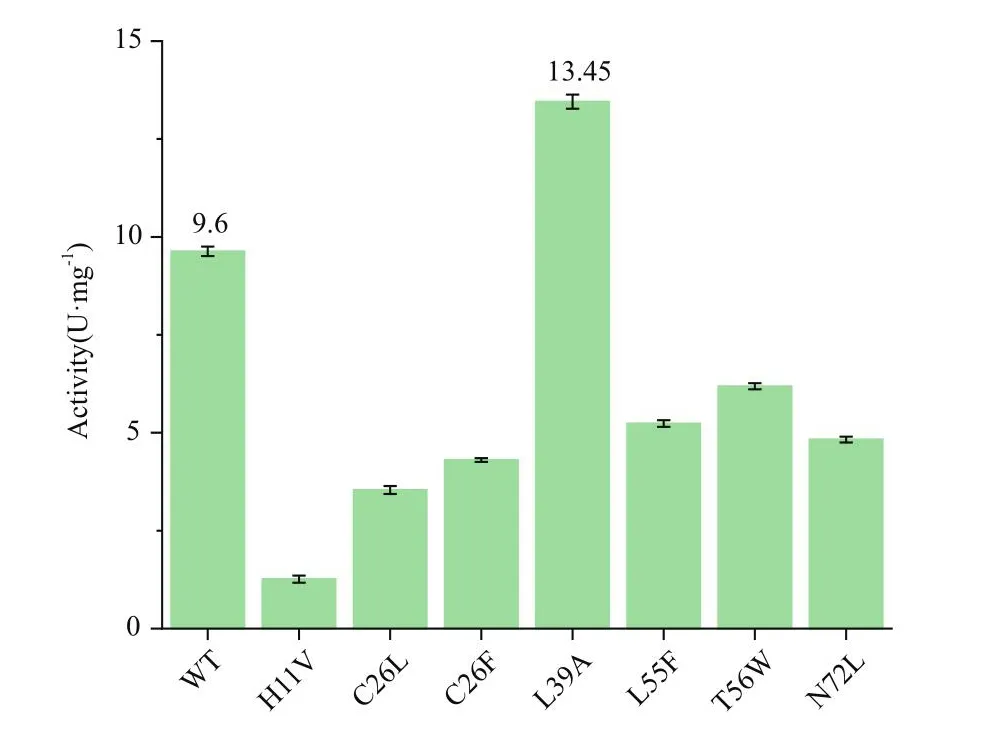
图3 不同突变体比酶活Fig.3 Specific enzyme activity in different mutants
2.4 突变体的酶学性质表征
2.4.1 最适温度及温度稳定性、最适pH及pH稳定性的表征 为了考查野生型酶和L39A突变体的最适温度和温度稳定性,将底物L-天冬氨酸钠和重组酶分别在对应温度下孵育5 min后再混合到一起反应,以未经处理的酶作为对照,测定酶活。数据经处理后,由图4-A可知,野生型和突变体的最适温度为55℃,70℃下突变体L39A的活性仍然高于最适温度下野生型活性。由图4-B可知,在50℃孵育30 min后,野生型的活性保持在90%,而在70℃孵育情况下,野生型仅剩余20%的酶活;而突变体L39A稳定性有所提高,70℃处理后仍剩余50%的酶活。
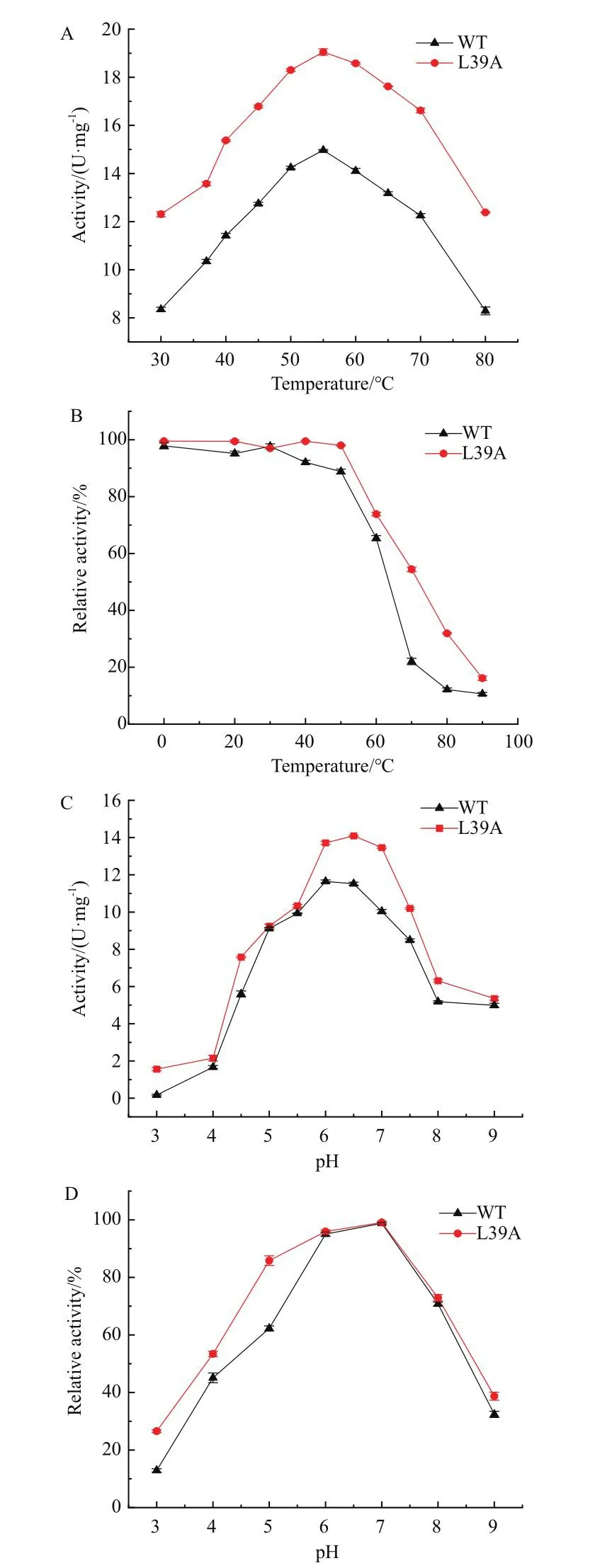
图4 最适温度及温度稳定性、最适pH及pH稳定性Fig.4 Optimal temperature and temperature stability, optimal pH and pH stability of recombinant enzymes
为了考查L39A突变体的最适pH以及pH稳定性,将不同pH的含底物L-天冬氨酸钠的缓冲液与重组酶在37℃孵育5 min后混合到一起反应,测定酶活。数据经处理后,由图4-C可知,野生型与突变体L39A的最适pH为6.0-6.5,最适pH下,突变体酶活较野生型提升1.3倍。由图4-D可知,在pH 6.0-7.0之间酶活保持稳定,当pH低于5.5或高于7.5时,残余酶活低于60%。
2.4.2 突变体动力学常数的测定 测定突变体L39A的动力学参数(图5)并与野生型进行比较,具体结果如表2所示,野生型的Km为(3.63±0.12)mmol/L,Kcat为(102.10±0.37)s-1。突变体L39A的Km值较WT低,表明其底物亲和力优于野生型;Kcat/Km较野生型更高,催化效率有显著提升,是野生型的1.4倍。

表2 动力学常数测定Table 2 Kinetic parameters of WT and L39A
2.5 突变体的结构模拟与分析
对突变位点L39A进行结构分析发现(图6),L39A与底物之间并没有直接的相互作用,但是39位的丙氨酸与42位的谷氨酸的羟基氧原子和氮原子之间形成两个氢键,其羟基氧和羰基氧与7位赖氨酸形成两个氢键,稳定了42位谷氨酸空间取向;42位谷氨酸与59位丙氨酸之间形成氢键,57位苏氨酸、58位酪氨酸位参与底物的结合,39位取代为侧链基团更小的丙氨酸,亲水性增强,增加了关键催化氨基酸58位酪氨酸与其他氨基酸的相互作用,使活性中心周围的区域稳定性提高,从而提高了催化活性。此外39位亮氨酸突变为丙氨酸后,结合自由能降低,PanD酶分子与底物结合更加容易。
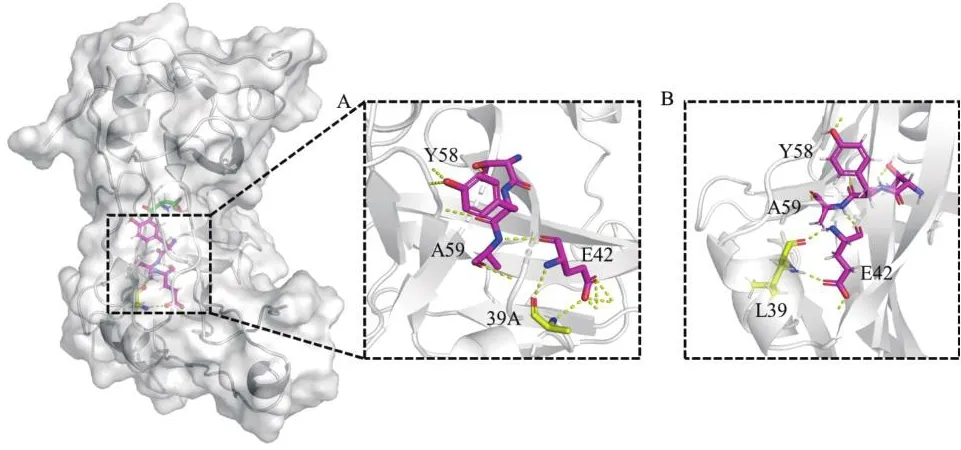
图6 突变体L39A和野生型结构信息Fig.6 Structural information of L39A and WT
2.6 全细胞催化合成β-丙氨酸
在含有重组大肠杆菌细胞OD600=40的反应液中,一次性添加L-天冬氨酸钠进行全细胞催化反应,定时取样监测底物与产物的含量。由图7可知,转化初期速度较慢,转化中期速度加快,可能是细胞发生裂解,胞内的酶释放出来,转化后期转化效率降低,可能是酶出现了不可逆的失活。当一次性添加1 mol/L的L-天冬氨酸钠进行全细胞催化反应时,如图7-A,B所示,L39A在4 h基本上能够转化70%的L-天冬氨酸,而野生型4 h仅能转化约50%,L39A在10 h能够转化90% L-天冬氨酸,在12 h能够完全转化1 mol/L的L-天冬氨酸,野生型在15 h能完全转化1 mol/L的L-天冬氨酸,两者在转化性能方面的差距较明显。
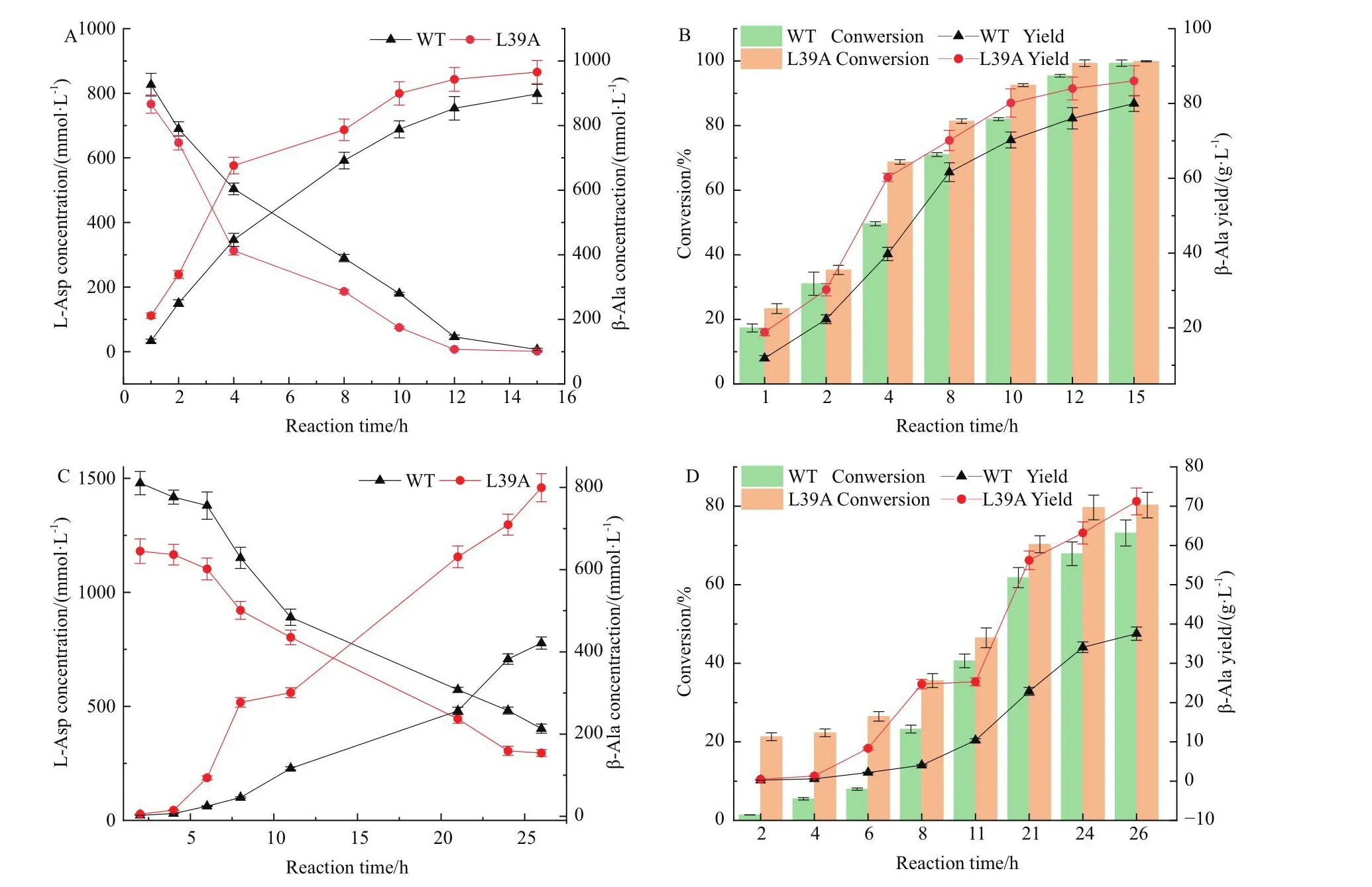
图7 全细胞催化合成β-丙氨酸Fig.7 Whole cell catalytic synthesis of β-alanine
而当一次性添加1.5 mol /L的L-天冬氨酸钠作为底物进行全细胞催化反应时,L39A在26 h摩尔转化率达52%,而野生型摩尔转化率仅为28%,L39A在26 h的最终产量为71.22 g/L,野生型为37.55 g/L(图7-C, D,表3)。此种体系中酶的转化效率变慢,可能是由于该类酶普遍存在不同程度的底物抑制。但这种体系下,突变体L39A在全细胞转化方面显现出优于野生型的催化和转化性能。

表3 一批次26 h转化率与产量Table 3 Conversion and yield at 26 h per batch
3 讨论
目前,生物发酵法生产β-丙氨酸是主要的研究热点,该方法反应条件温和、绿色安全;该法主要有两类:一类是通过微生物代谢生产β-丙氨酸,但是经过微生物代谢后,副产物较多,难以分离纯化且微生物代谢转化效率低[29];另一类是通过酶专一性催化生产β-丙氨酸,该方法仅需一步转化即可得到产物,易于产物的分离纯化,但存在酶活低、机理性失活、底物抑制等问题。针对酶生物转化存在的问题,本文通过挖掘新酶寻找初始活性高的酶;通过定向进化提高酶的催化效率及稳定性。本文利用已报道的谷氨酸棒状杆菌[8](Corynebacterium glutamicum)、枯草芽孢杆菌[9](Bacillus subtilis)来源的PanD基因为探针,在Uniprot数据库中进行BLAST,分析活性中心位点周围氨基酸序列的保守性,选择自裂解后形成丙酮酰结构的基因序列,以起始活性为标准,筛选到来源于杰氏棒杆菌(Corynebacterium jeikeium)的PanD。
酶的实验室定向进化是在实验室模拟自然环境加速酶进化的技术[30],主要有位点饱和突变[31]和易错PCR[32],这两种方法能够产生非常大的突变体文库,但是需要依赖于分辨率较高的高通量筛选手段[33],若没有合适的高通量筛选手段,定向进化过程将非常棘手。半理性设计借助蛋白质的保守性位点以及晶体结构,选取若干氨基酸作为潜在位点,构建“小而精”的突变体文库[34]。确定了定向进化模板后,由于杰氏棒杆菌来源PanD尚未有明确的结构作为参考,AlphaFold2在蛋白质预测方面表现优秀[35],具有惊人的准确度,本文通过AlphaFold2预测杰氏棒杆菌来源PanD结构,并通过Rosetta进行虚拟筛选,根据蛋白质的解折叠自由能并结合保守性分析,进一步缩小了突变位点的范围,提高了定向进化的效率。薄层层析能够比较直观地对氨基酸浓度进行定性,浓度越高,斑点越大。对突变体文库进行初筛和复筛后,筛选到突变体L39A,突变体催化效率是野生型的1.4倍。研究中还发现,突变体酶活提高的同时,稳定性也有所提高,在50℃孵育30 min后,野生型的活性保持在90%,而在70℃孵育情况下,野生型仅剩余20%的酶活;而突变体L39A 70℃处理后仍剩余50%的酶活,更加有利于工业生产。为了进一步了解突变体在全细胞催化方面的优势,本文在含有重组大肠杆菌细胞OD600=40的反应液中,一次性添加1 mol /L的L-天冬氨酸钠盐进行全细胞催化反应验证,L39A在4 h基本上能够转化70%的L-天冬氨酸,而野生型4 h仅能转化约50%,L39A在10 h能够转化90% L-天冬氨酸,在12 h能够完全转化1 mol/L的L-天冬氨酸,具有工业应用的潜力。结构分析表明,39位的丙氨酸与42位的谷氨酸的氧原子和氮原子之间形成两个氢键,其羟基氧和羰基氧与7位赖氨酸形成氢键,稳定了42位谷氨酸空间取向,42位谷氨酸与59位丙氨酸之间形成氢键,57位苏氨酸、58位酪氨酸参与底物的结合,39位取代为侧链基团更小的丙氨酸,亲水性增强,增加了关键催化氨基酸58位酪氨酸与其他氨基酸的相互作用,使活性中心周围的区域稳定性提高,从而提高了催化活性。
半理性设计结合Rosetta虚拟筛选策略对比其他酶活性改造策略[36],能够减少实验复杂程度、时间。对于没有确切晶体结构的分子,也可以通过AlphaFold2预测手段进行结构预测,以预测后的模型为参考进行筛选也有一定的意义,但是若想对酶进行更为深入的研究,精确的三维结构是必须的,还需要对野生型以及突变体进行晶体结构解析。
4 结论
本研究通过对杰氏棒杆菌来源L-天冬氨酸α脱羧酶进行定向进化,成功筛选到突变体L39A。L39A热稳定性较野生型有所提升,最适温度、pH与野生型一致。其与底物的亲和力提高,催化效率是野生型的1.4倍。经过全细胞催化验证,L39A在4 h能够转化70%的L-天冬氨酸,12 h能够完全转化1 mol/L的L-天冬氨酸,且催化效率的提高在高浓度底物(1.5 mol/L L-天冬氨酸)时表现得更为明显。后续可以以L39A为模板,进一步迭代突变,提高其在工业应用中的潜力。

