生防菌株DZY6715在不同生长期的代谢差异分析
周嫒婷 彭睿琦 王芳 伍建榕,2 马焕成
(1.西南林业大学林学院,昆明 650224;2.西南林业大学生物多样性保护学院,昆明 650224)
特基拉芽孢杆菌(Bacillus tequilensis)作为芽孢杆菌属(Bacillus)中具有较好拮抗作用的一类生防微生物,可以通过产生抗生素、细胞壁水解酶、挥发性物质、次级代谢产物等来抑制靶标病原菌或细菌的生长繁殖,促进植物生长[1-3]。多方面的研究已经得到证实,Kiran等[4]发现从海洋中分离得到的B.tequilensis MSI45对耐药性极强的金黄色葡萄球菌具有较强的抗菌及抗氧化活性。Li等[5]从白芷中分离到了一株对稻瘟病菌具有较高抑制活性的内生菌B.tequilensis GYLH001,是能够在农业上用于防治稻瘟病的潜力生防治剂,这对于提升绿色粮食质量具有重要作用。Zhou等[6]从健康水稻植株中获得了一株能够抑制多种植物病原菌发生发展的菌株B.tequilensis JN-369,除了具有较好的拮抗作用外,还能促进水稻种子萌发和幼苗植株生长,提高植物防御酶活性,显著减少水稻叶瘟病和穗瘟病,并且能够提高田间水稻的产量,是一种潜在的稻瘟病生物防治剂和水稻栽培生物肥料。Shultana等[7]在沿海受盐影响的水稻种植区收集并筛选到了潜在耐盐植物生长促进菌B.tequilensis UPMRB9,它能够增强渗透保护特性,提高抗氧化酶活性,是一种潜在的生物增强剂。综上,可见特基拉芽孢杆菌(B.tequilensis)在一定程度上可以减轻农林业生产中化学农药的使用剂量,提高作物对胁迫因素的抵抗力,增加生物量等。
代谢组学是生物学科中的新兴组学,研究的是生命体内的代谢产物种类、数量及其变化规律的科学,能够更直接、更准确地反映生物体的生理状态,揭示其参与的生命活动机制[8-9]。其中,非靶向分析模式能够将生物体内代谢水平的扰动情况最大程度地反应出来,侧重于系统性和整体性的分析。作者发现B.tequilensis DZY6715能够有效防控油茶炭疽菌,且该菌株在生长前期和生长后期对油茶炭疽菌的抑菌活性存在差异,尤以后期阶段的抑制活性高,并且随着培养时间的递增,防效越明显。所以,本文拟通过非靶代谢组的方法研究菌株DZY6715在生长前期和生长后期发挥主要抑菌活性的物质,探究这两个时期差异代谢物的种类、调控机制及功能作用等,为生防菌株DZY6715的抑菌活性分子机制提供一定的参考价值。
1 材料与方法
1.1 材料
特基拉芽孢杆菌(B.tequilensis)DZY6715和油茶炭疽菌(Colletotrichum fructicola)是笔者分别从油茶健康叶片和油茶炭疽病叶片中分离获得的,保存在西南林业大学生物多样性保护学院病理学实验室。
LB培养基(g/L):蛋白胨10,酵母提取物5,NaCl 10,琼脂20,pH自然,121℃灭菌20 min,冷却至室温,备用;PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然,121℃灭菌20 min,冷却至室温,备用。
1.2 方法
1.2.1 菌株DZY6715生长曲线测定 首先将菌株DZY6715在LB固体培养基上培养24 h,然后用无菌接种针把单菌落移至200 mL的LB液体培养基中培养,分别取(t=6、12、24、48、72、96 h)的菌液稀释后涂布,28℃培养箱培养24 h后计数,根据稀释倍数计算每毫升菌液中的活菌数量[10]。
1.2.2 不同时期培养液对油茶炭疽菌的抑制活性 采用平板对峙法[11]测定菌株DZY6715在生长前期(t=24 h)和生长后期(t=72 h)两个阶段对油茶炭疽菌的抑菌活性,抑菌率的计算公式为:抑菌率(%)=[(对照组菌落直径-处理组菌落直径)/对照组菌落直径]×100%。此外,在光学显微镜下观察经处理后的炭疽菌菌丝结构的变化情况。
1.2.3 样本准备 菌株DZY6715在LB固体培养基上培养24 h后,取适量转移到LB液体培养基,以28℃,180 r/min在摇床上培养。根据菌株生长曲线的结果,收集生长前期(t=24 h)和生长后期(t=72 h)菌液,置于-80℃冰箱保存。菌株DZY6715在24 h和72 h的编号分别为DZYB24h和DZYB72h。
1.2.4 样本提取 -80℃冰箱冻存的样本送至上海中科新生命生物科技有限公司完成菌悬液的样品制备、QC制备、样品LC-MS/MS质谱分析和生物信息学分析。
1.2.5 差异代谢物分析 本文通过有监督的偏最小二乘法分析(PLS-DA)方法建立判别模型来区分组间的总体差异,以OPLS-DA VIP>1和P value<0.05为标准筛选差异代谢物,并在KEGG数据库(https:www.kegg.jpkeggpathway.html)进行代谢通路注释。
1.2.6 数据处理 试验每个处理3个重复,数据和图表处理采用Excel 2010和Origin 2023软件,显著性分析采用SPSS Statistics 20.0,差异水平为P<0.05。
2 结果
2.1 菌株DZY6715的生长曲线
菌株DZY6715在6-24 h是对数生长期,24-48 h是生长稳定期,48 h以后开始表现出下降的趋势,72 h进入衰亡平稳期(图1)。生长稳定期(生长前期)和衰亡期(生长后期)分别是代谢产物生产比较稳定的时期和代谢产物累积较多的时期,因此,本文将对这两个点的代谢产物进行后续分析。
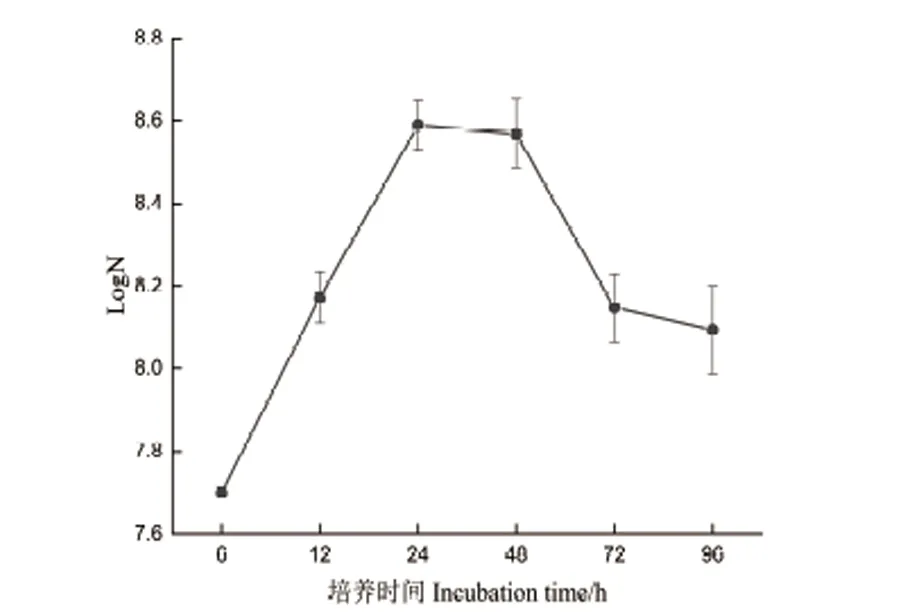
图1 菌株DZY6715的生长曲线Fig.1 Growth curve of strain DZY6715
2.2 菌株DZY6715在不同生长期对炭疽菌的抑菌活性
图2和图3可以看出,t=24 h和t=72 h的菌液对油茶炭疽菌都有抑制作用,但二者的抑菌活性存在差异,表现为生长后期的抑菌活性较高。另外,随着培养时间的递增,抑菌率也随之增加,并且72 h处理组的抑菌率始终高于24 h处理组,在培养过程中,二者的抑菌率范围分别为18.05%-55.25%和11.82%-48.88%(培养第3-7天)。另外,对处理后的菌丝形态观察发现,对照组的菌丝通直,粗细均匀,伸展性好,未出现膨大加粗或细胞空泡化现象,而24 h和72 h处理组的菌丝均出现不同程度的畸形,具体表现为,24 h处理组的菌丝细胞长度变短,中央细胞膨大成椭圆形,相比24 h处理组,72 h处理组的菌丝细胞长度更短,表现为整体均匀膨大,菌丝细胞侧边分支产生球状或念珠状的数量较多,整体来说,72 h处理组的畸形现象更突出(图4)。
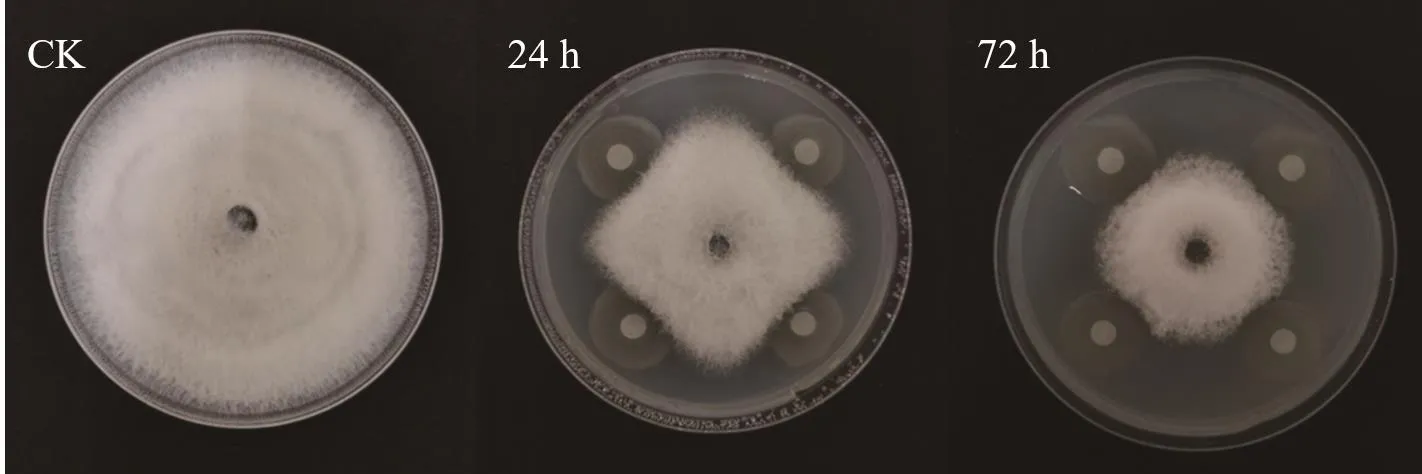
图2 菌株DZY6715在不同生长期对油茶炭疽菌的抑菌效果Fig.2 Antifungal effects of strain DZY6715 against C.fructicola at different growth stages
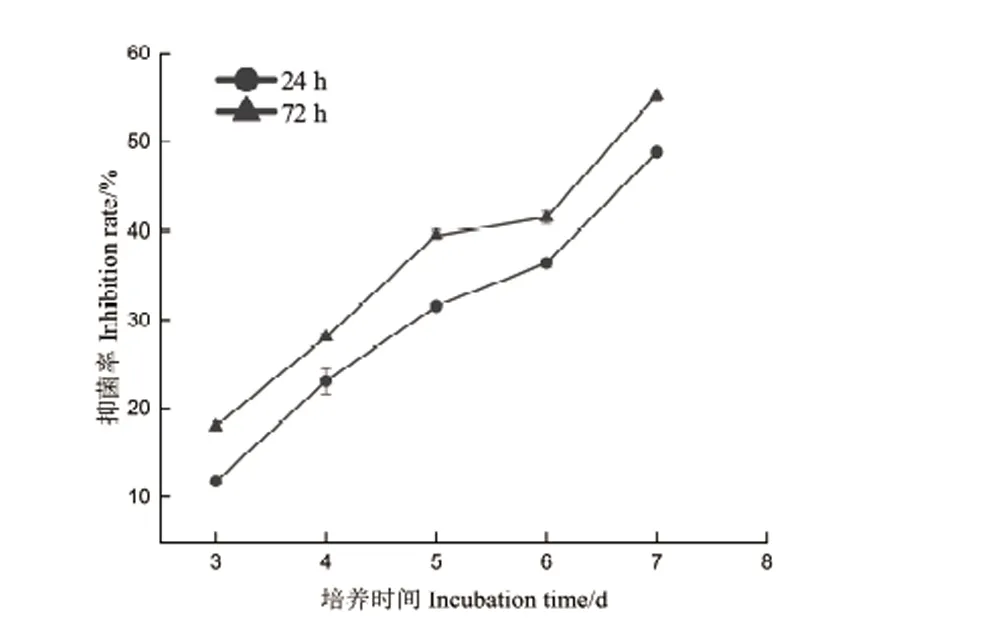
图3 菌株DZY6715在不同生长期对油茶炭疽菌的抑菌率Fig.3 Inhibition rate of strain DZY6715 against C.fructicola at different growth stages
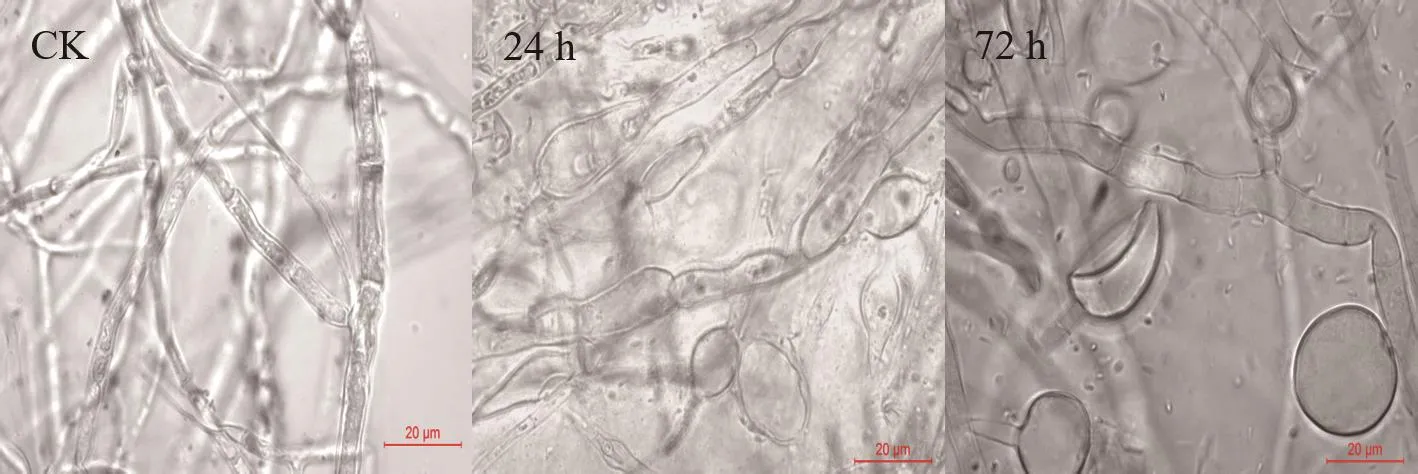
图4 不同生长期的菌株DZY6715处理后对油茶炭疽菌菌丝形态的影响(10×100倍)Fig.4 Effects of strain DZY6715 on mycelial morphology of C.fructicola at different growth stages(10×100 times)
2.3 数据质控
QC工作是进行基于质谱技术的代谢组学研究时获得可靠且高质量的代谢组学数据的基础,采用主成分分析方法(PCA)对数据进行质控分析。如图5所示,紫色QC样本检测结果密集的聚在一起,说明QC重复性良好,分析系统稳定,所采集的样品数据可以进一步差异分析。
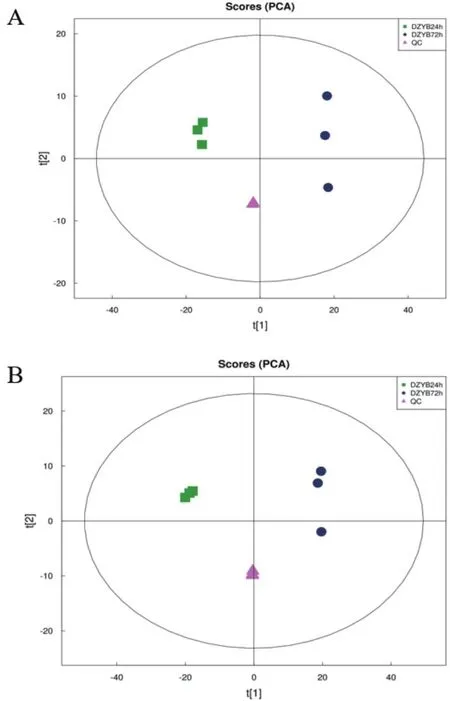
图5 QC样本的PCA得分图Fig.5 PCA score chart of the QC samples
2.4 主成分(PCA)分析
不同颜色表示不同生长时期的样品,同一颜色表示同一生长时期下的样品重复(图6)。DZYB 24h和DZYB 72h两组的样本点均分布集中,说明组内样本重复性较好,不同处理间样本点分布明显分离,说明DZYB 24h和DZYB 72h的代谢物存在差异,本次数据质量高,检测性好。
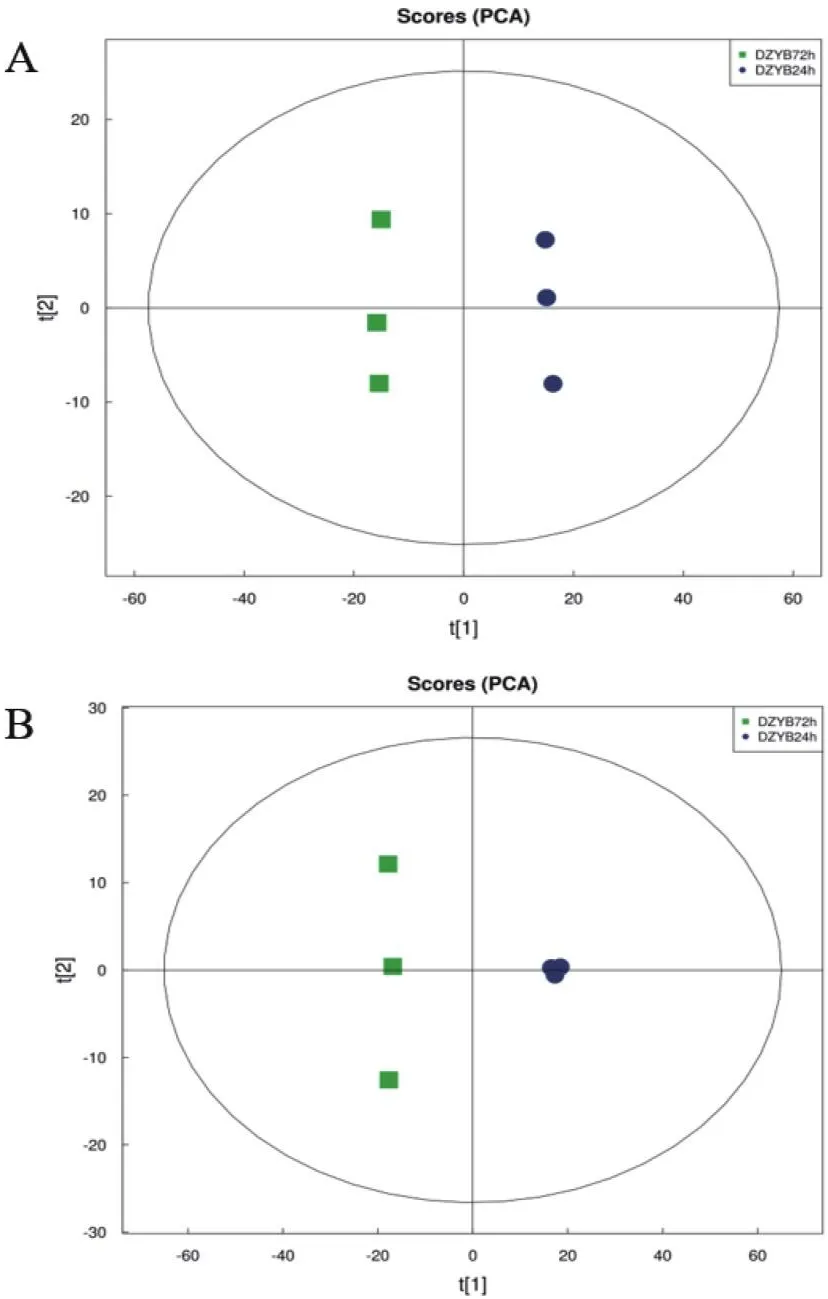
图6 DZYB72h-vs-DZYB24h的PCA得分图Fig.6 PCA score chart of DZYB72h-vs-DZYB24h
2.5 偏最小二乘判别(PLS-DA)分析
经7-fold cross-validation(7次循环交互验证)得到的模型评价参数(R2和Q2),一般Q2和R2大于0.5,表明模型稳定可靠。如图7所示,正、负离子模式下,样本在空间位置上聚类明显,分成两组,表明PLS-DA模型稳定可靠,组间有明显的差异。为避免有监督模型在建模过程中发生过拟合,采用置换检验(Permutation test)对模型进行检验,可以看出随着置换保留度逐渐降低,随机模型的R2和Q2均逐渐下降,说明原模型不存在过拟合现象,模型稳健性良好。
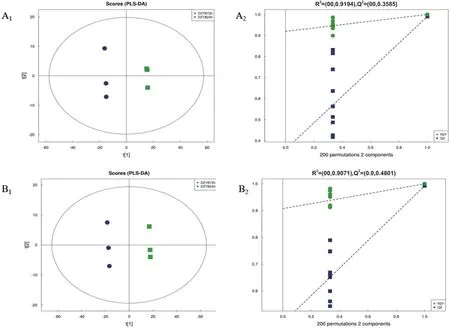
图7 DZYB72h-vs-DZYB24h的得分图(A1, B1)和置换检验图(A2, B2)Fig.7 PLS-DA score(A1, B1)and permutation test chart(A2, B2)of DZYB72h-vs-DZYB24h
2.6 差异代谢物筛选
把OPLS-DA VIP>1和P value < 0.05作为差异代谢物的筛选标准。将样本中正负离子模式合并后筛选到差异代谢物共239个,100个上调,139个下调(图8)。
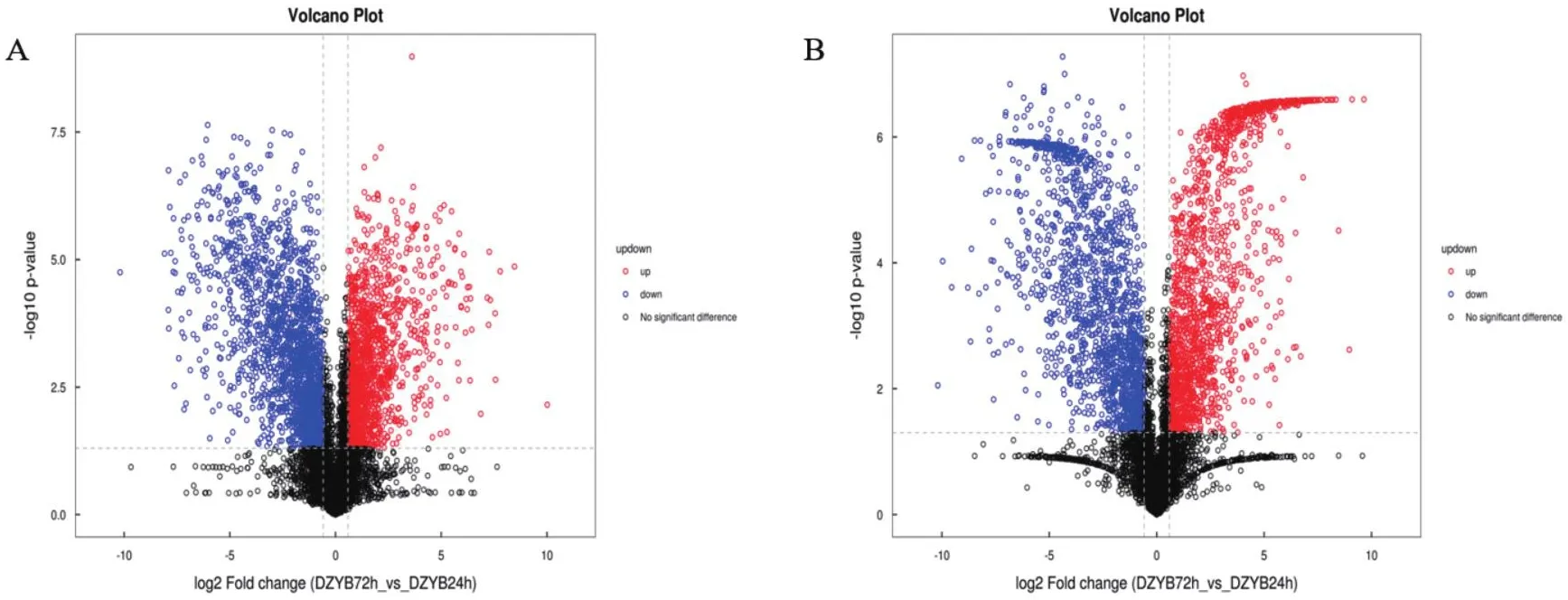
图8 DZYB72h-vs-DZYB24h的差异代谢物火山图Fig.8 Differential metabolite volcano plot of DZYB72h-vs-DZYB24h
2.7 KEGG Pathway分析
DZYB72h_vs_DZYB24h样本中,显著性差异代谢物注释到了32条代谢通路中,Top20的代谢通路被显示在图9中,共富集到差异代谢物183个。显著性通路分别为:蛋白质消化和吸收,氨酰tRNA生物合成,氨基酸的生物合成,矿物吸收,ABC转运蛋白,赖氨酸降解,2-氧代羰酸代谢,各种次生代谢物的生物合成/第3部分,氰氨基酸代谢,缬氨酸、亮氨酸和异亮氨酸生物合成,精氨酸生物合成,精氨酸和脯氨酸代谢,Tropanc、哌啶和吡啶生物碱的生物合成,泛酸和CoA生物合成,苯丙氨酸代谢,mTOR信号通路,苯乙烯降解,谷胱甘肽代谢,丙氨酸、天冬氨酸和谷氨酸代谢,芥子油苷生物合成,酪氨酸代谢,轴突再生,硫胺素代谢,半胱氨酸和蛋氨酸代谢,组氨酸代谢,β-丙氨酸代谢,嘧啶代谢,甘氨酸、丝氨酸和苏氨酸代谢,赖氨酸生物合成,神经活性配体-受体相互作用,GABA能突触,cGMP-PKG信号通路。
Pathway通路分析发现,蛋白质消化和吸收、氨酰tRNA生物合成、氨基酸的生物合成、ABC转运蛋白、2-氧羰基酸代谢这5条通路在拓扑分析中的影响较大,重要性在0.2174-0.3830之间,差异代谢物的数量分别为19、14、19、17、15(表1),后续主要重点分析这些通路。

表1 5条重要代谢通路中的差异代谢物Table 1 Differential metabolites in 5 metabolic pathways
分析这5条代谢通路发现,共涉及27种差异代谢物,主要是氨基酸、有机酸、高柠檬酸盐、苯酚、腺苷、N-乙酰-D-氨基葡萄糖、诺氟沙星、硫胺素(表2)。其中,氨基酸占比最高,为61%,其次是有机酸,占比为18%,说明氨基酸和有机酸对细胞生长前期和后期的影响较大,可能调控着细胞的生命过程。

表2 5条代谢通路的差异代谢物分析Table 2 Differential metabolite analysis of five metabolic pathways
2.8 差异代谢物表达量分析
菌株DZY6715生长前期氨基酸总的表达量显著高于生长后期,并且各氨基酸在不同生长阶段的表达量也存在差异,总体上生长前期的表达量高于生长后期。在两个生长阶段中,DL-缬氨酸、甘氨酸、L-天冬氨酸的表达量较低。在生长前期,精氨酸、谷氨酸、异亮氨酸、亮氨酸大量表达,分别是生长后期的22.02、2.10、2.02、2.49倍;在后期,赖氨酸、苯丙氨酸、DL-色氨酸、DL-络氨酸的表达量显著升高,分别是前期的1.48、1.53、1.19、1.88倍(图10-A)。因此,认为精氨酸、谷氨酸、异亮氨酸、亮氨酸在菌株DZY6715生长前期起着主导作用,更侧重于参与细胞生长、能量代谢等过程,而赖氨酸、苯丙氨酸、DL-色氨酸、DL-络氨酸可能主要对后期阶段中的胁迫因素起缓解作用。
有机酸在生长后期的总表达量明显高于生长前期。前期,邻苯二甲酸和丙酸的表达量明显高,分别是后期的3.64、8.46倍,而异戊酸、2-氨基己二酸、丁酸在后期的表达量显著高于前期,分别是前期的3.00、3.18、13.66倍(图10-B)。这说明有机酸都参与了细胞的不同生长阶段,并且后期阶段累积的有机酸更多,这对缓解后期营养、空间不足等的压力有重要作用。
诺氟沙星、N-乙酰-D-氨基葡萄糖、腺苷、苯酚、高柠檬酸盐的后期表达量远高于前期,分别是前期的1.67、45.39、5.97、49.35、5.61倍,而硫胺素前期的表达量比后期高117.23倍(图10-C),说明不同生长阶段中,各代谢物的表达量存在差异,抑或是代谢物表达量的高低因不同生长阶段而异。
3 讨论
本文生物学试验发现,与生长前期(t=24 h)相比,生长后期(t=72 h)的菌株DZY6715处理油茶炭疽菌后的菌丝细胞畸形现象更明显,说明经生长后期(t=72 h)处理的病原菌丝生长受限更严重[12],同时也表明了菌株DZY6715生长后期(t=72 h)的抑菌活性更强。
氨基酸是许多细胞生物合成和代谢过程中的主要代谢产物,不仅作为前体物质参与细胞构建,还通过形成催化酶调节细胞代谢[13]。本文发现菌株DZY6715在生长后期和前期的差异代谢物中氨基酸占比最高,并且前期氨基酸的表达量显著高于后期,这可能是在细胞开始生长繁殖的阶段,需要大量氨基酸提供能量以维持正常的生命活动,而随着生长期的后移,积累和表达的氨基酸更侧重于缓解生活环境中营养、空间等不足的压力。这与本研究中生物学试验部分的结果相吻合,进一步说明氨基酸既有构建细胞结构的功能,又能发挥抑菌作用,但是前者可能占主导地位。氨基酸及其衍生物具有较好的抗菌效果,氨基酸的积累有利于细胞对氧化胁迫、不利因素的抵抗[14]。例如,甘氨酸是抗菌活性较强的自由氨基酸,不仅能抑制病菌的生长繁殖,还可以参与谷胱甘肽抗氧化过程[15]。赖氨酸的生物合成为蛋白质的合成和细菌肽聚糖细胞壁的构建提供了必要的成分,这对于细胞的生长繁殖来说是必不可少的[16]。也有研究表明,色氨酸在细胞体内具有多种代谢功能,通常整合到酶和蛋白质的多肽链中,待完全分解后参与代谢过程,B.megaterium 和Rhodococcus erythropolis可以用色氨酸作为生长过程中所需的碳源和氮源[17]。芳香族氨基酸(苯丙氨酸、络氨酸、色氨酸)和支链氨基酸(异亮氨酸、亮氨酸)等可以通过形成疏水区域来保护蛋白质免受胆汁压力[18],苯丙氨酸和色氨酸可以增强水稻根系的耐受性,有效减少逆境下活性氧的大量产生[19]。学者研究表明,一氧化氮对植物炭疽菌分生孢子的萌发和附着胞的形成具有调控作用,而精氨酸作为一氧化氮的前体在此过程中起着关键作用[20]。Takagi等[21]发现脯氨酸以及谷氨酸、精氨酸、赖氨酸等有助于提高细胞对低温的耐受性。精氨酸在胁迫下可以通过维持细胞的完整性、稳固细胞壁和细胞质膜来防止细胞受损伤,参与调控活性氧的动态平衡,保护细胞在胁迫下的正常生长[22]。氨基酸的匮乏会降低细胞应对胁迫的能力,还会使蛋白质合成缺少原料,即便与蛋白质合成相关的氨酰-tRNA生物合成途径被激活,也不足以完全解除蛋白质的合成阻碍,导致细胞生长受限,而酵母细胞通过减少氨基酸代谢途径降低了能量的需求,维持碳、氮代谢平衡,使其在逆境中得以存活[23]。因此,认为氨基酸既是维持细胞生长和代谢平衡的重要物质,也是细胞抵抗胁迫的重要调节剂。
多方研究已证实有机酸可以抑制病原菌生长,增强有机体抗性,其主要是通过能量竞争、改变细胞膜通透性、改变渗透压、抑制大分子合成和诱导抗菌肽产生等发挥抑菌作用。有机酸通过刺激宿主植物产生抗菌肽物质作用于磷脂双分子层,增大病原菌细胞膜的通透性,导致细胞内容物外泄,杀死病原菌,但是相比之下,有机酸在细胞内解离出质子和酸根离子而发挥抑菌作用的效果更为显著,并且抑菌效果与质子和酸根离子呈正相关[24]。另外,有机酸通过影响细胞内的酸碱性而抑制病原菌菌丝的生长[25]。研究表明,乌梅有机酸提取液对枯草杆菌、金黄色葡萄球菌、大肠杆菌和四联球菌都具有较好的抑制作用[26]。乳酸菌发酵产生的丁酸对霉菌起抑菌作用[27]。Wang等[28]通过半制备分离获得了对有害菌具有显著抑菌作用的物质苯乳酸。本文研究也发现在细胞生长的不同阶段,都涉及有机酸的参与,尤其是生长后期有机酸大量积累和表达,推测有机酸在细胞抵抗逆境中发挥着重要作用,这可能也是菌液在生长后期(t=72 h)的抑菌效果高于生长前期(t=24 h)的又一重要因素。
硫胺素(又名维生素B1)在生长前期的表达量远远高于后期,推断硫胺素可能有助于细胞的生长繁殖。同时,B族维生素对于菌体的生长过程来说是极其重要的一个生长因子,还是生物体内多种酶的辅酶[29-30],硫胺素的大量表达能够增强酶的活性,进而加速菌体的生长繁殖速度。腺苷能够间接参与细胞内的能量转移、信号转导等过程[31],而本文发现菌株DZY6715生长的后期腺苷的表达量明显高于前期,认为腺苷在前期阶段主要是参与能量代谢的过程,而后期阶段大量表达的腺苷可能是在响应压力过程中传递重要信号的。此外,菌株DZY6715在生长后期苯酚、N-乙酰-d-氨基葡萄糖、诺氟沙星、高柠檬酸盐等差异代谢物高表达,推测这些代谢物质更主要的是参与调控细胞的抗逆生长过程,这些物质在响应胁迫中的重要地位已被学者所证实,N-乙酰-d-氨基葡萄糖是一种特殊的单糖,是生物体内绝大部分多糖的组成单位,不仅甜度较高,还有消炎、抗氧化等的功能[32-33]。苯酚是一种芳香族化合物,属于酚类,有毒性,会对生物体的生长造成不良影响[34-35]。诺氟沙星是第3代氟喹诺酮类的一种抗生素,会阻碍消化道内致病细菌的DNA旋转酶的作用,阻碍细菌DNA复制[36-37]。所以,本研究认为后期阶段这些代谢物质高表达的原因,不仅是为有限空间内营养的不足提供能量,更偏向于利用这些代谢物来抵抗胁迫,这也印证了本文生物学试验部分的结果,即菌株DZY6715在生长后期(t=72 h)抑菌活性较生长前期(t=24 h)高。
综上,本文通过非靶向代谢组学技术对菌株DZY6715在不同生长时期的差异代谢物及差异代谢物的表达量进行了研究,剖析了该菌株在两个不同的生长时期抑菌活性存在差异的原因,这为后续这些重要差异代谢物的靶向分析奠定了基础,同时有利于该菌株有效抑菌物质的提取,使该菌株能更有效的应用到农林业生产的生物防治中。
4 结论
本文基于菌株生长曲线和生物学试验得出,菌株DZY6715生长后期的抑菌活性高于生长前期,并且随着培养时间的递增,效果越明显,结合非靶向代谢组学技术探讨了该菌株生长前期和生长后期的差异代谢物及其调控机制,综合分析认为,氨基酸主要是参与细胞的生长繁殖、能量代谢等,同时具有抑菌的作用;有机酸、硫胺素、腺苷、高柠檬酸盐等差异代谢物是抵抗压力的重要调节剂,是该菌株表现高抑菌活性的关键因子。

