代森锰锌对烟草靶斑病的防效及其叶际微生态的影响
张艺 张兴红 王丰 郭沫言 孙美丽 汪汉成


摘要:为探究代森锰锌在防控烟草靶斑病过程中对叶际微生态的影响,通过田间药效试验评价了代森锰锌对烟草靶斑病的防效,并采用Illumina高通量测序技术分析了代森锰锌对烟叶叶际真菌和细菌群落结构与多样性的影响。代森锰锌200 g/667 m2处理1、3、9 d时,防效分别为65.50%、55.31%和45.03%。代森锰锌处理1、3 d时,降低了感病部位叶际亡隔菌属等3种真菌及假单胞属、鞘脂单胞菌属等6种细菌的相对丰度;增加了Symmetrospora、Sampaiozyma、茎点霉属等7种真菌及甲基杆菌属、Aureimonas 2种细菌的相对丰度。代森锰锌处理1、3 d时,降低了健康烟叶叶际亡隔菌属、尾孢属等5种真菌及甲基杆菌属、Aureimonas等4种细菌的相对丰度;但增加了Symmetrospora、铆钉菇属等4种真菌及假单胞属等4种细菌的相对丰度。处理18 d时,降低了亡隔菌属、尾孢属等3种真菌及鞘脂单胞菌属等5种细菌的相对丰度;但增加了Symmetrospora、铆钉菇属等6种真菌及基杆菌属、Aureimonas等5种细菌的相对丰度。烟草靶斑病发生初期,代森锰锌200 g/667 m2对烟草靶斑病具有一定的防效,代森锰锌施用对烟叶感病与健康部位烟叶真菌和细菌群落结构与多样性均有影响,且随着时间的延长影响逐渐减弱。
关键词:烟草靶斑病;代森锰锌;叶际微生态;立枯丝核菌;防效
中图分类号:S481+.9;S435.72文献标志码:A文章编号:1002-1302(2023)17-0122-09
烟草靶斑病(tobacco target spot)是由立枯丝核菌(Rhizoctonia solani Kühn)引起的一种真菌性病害,有性世代为瓜亡氏革菌[Thanatephorus cucumeris (Frank) Donk],属于担子菌亚门(Basidiomycotina),亡革菌属(Thanatephorus)[1]。苗期至大田成熟期均可发生。该病害主要危害烟草叶片,葉片被侵染后常出现圆形水渍状斑点,病斑周围有褪绿晕圈,病斑坏死部位易碎,形成穿孔,条件适宜时极易大面积流行成灾,严重影响烟叶产质量[2-3]。目前,生产上常用包括代森锰锌在内的多种药剂防控烟草靶斑病[4]。代森锰锌是一种广谱的硫代氨基甲酸酯类保护性杀菌剂,主要作用于菌体内丙酮酸的氧化,施用后在作物表面形成1层保护膜,通过抑制病原菌孢子萌发来防止病害侵染[5-6]。
烟草叶斑类病害的发生与叶际微生物密切相关[7],烟叶是叶际微生物的栖息地,叶际微生物是植物生态系统的重要组成部分,发挥着重要的生态功能,对植物的生长发育、防御病害、固氮作用等均存在影响[8-14]。叶际微生物易受基因型、海拔、季节等生物和非生物因素的影响[15-17]。已有研究发现,烟草感白粉病和赤星病烟叶叶际优势真菌在门水平均分布于子囊菌门和担子菌门,优势菌属主要有链格孢属、茎点霉属和高氏白粉菌属、曲霉属;感赤星病烟叶叶际优势细菌主要为变形菌门,优势菌属主要为泛菌属、假单胞菌属[18-20]。相较而言,作为烟草旺长期的主要叶斑类病害烟草靶斑病,人们对其危害期烟叶叶际微生物菌群结构与多样性却缺乏认识。
目前,化学防治是对包括烟草靶斑病在内的植物病害防控的主要方式之一。病害的防控通常注重调查药剂使用后病斑的增加情况,通过病情指数的增长来评价药剂的防控效果,是基于肉眼观察的宏观评价。然而,药剂在应用后对烟叶叶际微生物的微观影响却鲜有关注。本研究通过田间药效试验评价了代森锰锌对烟草靶斑病的防效,并采用高通量测序技术分析了代森锰锌不同施药时间后,健康烟叶与感靶斑病烟叶叶际真菌和细菌的群落结构与多样性,旨在揭示代森锰锌的持效期及其防控烟草靶斑病的微生态机制。
1 材料与方法
1.1 试验材料
供试品种为云烟87,为贵州省烟区的主栽烤烟品种。80%代森锰锌可湿性粉剂(WP),由美国陶氏益农有限公司生产。DNA抽提试剂盒(Fast DNA Spin Kit for Soil),由MP Biomedicals生物医学公司生产;GeneJET胶回收试剂盒和Ion Plus Fragment Library Kit 48 rxns建库试剂盒,均由Thermo Scientific公司生产。
1.2 代森锰锌对烟草靶斑病的防效研究
田间药剂试验于2020年8月中旬在贵州省毕节市金沙县烟区进行。选取烟株长势一致的烟田划分小区,随机排列,每小区20株烟株,小区设3次重复。于烟叶底部叶片零星出现病斑时开始用药,代森锰锌的田间用量为200 g/667 m2,用水量为 60 L/667 m2,采用多功能喷雾施肥器均匀喷施于叶片表面,直至液滴流失。以喷施等量清水处理为对照,小区间设保护行。在施药前各处理随机选择相同部位、相同成熟度的叶片,分别标记8个病斑,测量病斑直径。施药后1、3、9 d,分别测量各标记病斑直径,计算药剂处理对病害扩展的抑制率[21]。同时,各小区随机选择8株烟株,参照烟草靶斑病病害分级标准调查各处理1、3、9 d的病情指数[22],并计算代森锰锌对烟草靶斑病的防效。
1.3 代森锰锌对烟叶叶际微生态的影响
1.3.1 样品采集
于施药前0 d及施药后1、3、9、18 d分别对试验小区烟叶取样,用于后续试验。采用消毒剪刀剪取同一张叶片的感靶斑病部位和健康部位烟叶样品,转移至50 mL无菌离心管中,重复取样5次。将所取样品放入低温保存箱,带回实验室后-80 ℃保存备用。样品编号信息见表1,因后期部分标记烟叶被采烤,可供采集样品的叶片数量有限,药后9 d的感病和健康烟叶样品及药后18 d的健康烟叶样品均为混合样品。
1.3.2 代森锰锌对烟叶叶际微生物群落结构与多样性的影响
采用十六烷基三甲基溴化铵(CTAB)法提取各样本烟叶叶际微生物基因组DNA,使用NanoDrop 2 000测定提取的DNA浓度和纯度,纯度D260 nm/D280 nm值需在1.8~2.0之间,经1%琼脂糖凝胶电泳対DNA样品进行检测,检测合格后用于构建文库。
以上述样品的总DNA为模板,以真菌引物ITS1-5F-F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS1-1F-R(5′-GCTGCGTTCTTCATCGATGC-3′)对叶际微生物基因组DNA ITS1区域进行PCR扩增[23]。以细菌引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对样品烟叶叶际微生物基因组DNA 16S-V4区域进行PCR扩增[24]。PCR扩增体系与反应程序参照文献[23-24]的方法进行。扩增产物回收后,使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,采用Illumina测序平台(Illumina Novaseq 6 000,Illumina公司,San Diego,CA,美国)对PCR扩增产物进行双端测序分析,以上分析均在北京诺禾致源科技股份有限公司完成。
1.3.3 测序数据处理及统计分析
采用Excel 2019对数据进行处理,计算代森锰锌对烟草靶斑病的防效。测序数据通过Flash和Trimmomatie软件进行过滤优化和双端序列连接。高质量序列使用UPARSE软件(version 7.1)对相似度≥97%序列进行OTU(operational taxonomic units)聚类,并在聚类过程去除单序列和嵌合体。真菌和细菌分别通过Unit(7.2)和SILVA132的SSUrRNA数据库进行注释。采用Qime(version19.1)软件计算α多样性指数,运用DPS数据处理系统对真菌和细菌的α多样性指数进行差异显著性分析。计算Shannon指数、Chao1指数、ACE指数和Goods_coverage指数,分析烟叶叶际微生物群落的多样性、丰富度以及覆盖度。利用R语言工具统计并绘制相关性网络分析图、门属水平相对丰度图、功能预测图,分析样品微生物群落结构与多样性、互作关系等。
2 结果与分析
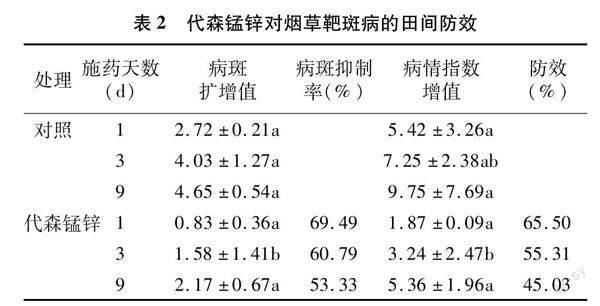
2.1 代森锰锌对烟草靶斑病的防效
由表2可知,代森锰锌200 g/667 m2处理降低了烟草靶斑病的严重程度,对烟草靶斑病具有一定的防控效果。基于病斑面积和病情指数调查的防控效果较为一致,随着用药时间的延长,防效均逐渐减弱。基于病斑面积的评价发现,施药1、3、9 d后的防效分别为69.49%、60.79%、53.33%;基于病情指数的评价发现,施药1、3、9 d后的防效分别为65.50%、55.31%、45.03%。
2.2 代森锰锌对烟草靶斑病叶际微生态的影响
2.2.1 代森锰锌对烟叶微生物α多样性的影响
由表3可知,真菌群落中,代森锰锌处理前后的感病烟叶与健康烟叶的覆盖度指数在0.96及以上;细菌群落中,代森锰锌处理前后感靶斑病烟叶样品组与健康烟叶样品组的覆盖度指数在0.99以上,二者均表明样本中序列被检测出的概率高,测序结果能够表示样本中实际的真菌和细菌群落结构。对烟叶微生物多样性进行评估可知,真菌群落中,施药前的感病烟叶与健康烟叶的豐富度和多样性指数相同,无差异显著。感病烟叶,代森锰锌处理1、3 d时,Shannon、Chao1和ACE指数均比施药前高;Shannon指数、Chao1指数、ACE指数与施药前无显著性差异。健康烟叶,代森锰锌处理1、3、18 d时,Shannon、Chao1和ACE指数均比施药前高;Shannon指数与施药前存在显著性差异,Chao1指数与施药前无显著差异。
细菌群落中,代森锰锌处理前的感病烟叶的多样性和丰富度均高于施药前的健康烟叶,二者在多样性上无差异显著。代森锰锌处理感病烟叶1、3 d时,Shannon、Chao1和ACE指数均比施药前高,代森锰锌处理健康烟叶1、18 d时,Shannon指数比施药前高,而施药3 d Shannon指数低于施药前,均无显著性差异;代森锰锌处理1和 3 d 的Chao1指数和ACE指数比施药前低,18 d时高于施药前,均无显著性差异。
2.2.2 代森锰锌对烟叶微生物群落结构的影响
由图1和表4可知,真菌群落在门水平上,代森锰锌处理前后,感靶斑病烟叶与健康烟叶的优势菌群均为担子菌门(Basidiomycota)和子囊菌门(Ascomycota),健康烟叶还有被孢霉门(Mortierellomycota)。施药前感靶斑病烟叶中担子菌门相对丰度(88.50%)高于健康烟叶(56.71%)。代森锰锌处理感靶斑病烟叶1、3 d时,担子菌门相对丰度降低,分别降低47.0、79.1百分点。代森锰锌处理健康烟叶1、3、18 d时,担子菌门相对丰度均降低,分别降低29.56、44.09、10.39百分点。
真菌群落在属水平上,代森锰锌处理前后,感靶斑病烟叶与健康烟叶的主要菌属有亡隔菌属(Thanatephorus)、Symmetrospora、铆钉菇属(Gomphidius)、尾孢属(Cercospora)、链格孢属(Alternaria)、Sampaiozyma、镰刀菌属(Fusarium)、茎点霉属(Phoma)、Plectosphaerella、枝孢霉属(Cladosporiun)。代森锰锌处理前,感靶斑病烟叶与健康烟叶的优势菌属均为亡隔菌属,施药前感靶斑病烟叶中亡隔菌属相对丰度(88.13%)高于健康烟叶(54.67%)。代森锰锌处理感靶斑病烟叶1、3 d时,亡隔菌属相对丰度均降低,分别降低了50.1、85.84百分点。代森锰锌处理健康烟叶1、3 d时,亡隔菌属相对丰度也降低了47.13、51.33百分点,感病烟叶施药1 d时亡隔菌属与表4中其他9个菌属的相对丰度存在显著性差异,健康烟叶施药1、3 d时亡隔菌属与其他菌属不存在显著性差异。此外,Symmetrospora、Sampaiozyma、铆钉菇属、尾孢属、茎点霉属也是叶际微生物群落的重要组成部分。代森锰锌处理感靶斑病烟叶1、3 d时,Plectosphaerella相对丰度降低,而Sampaiozyma、Symmetrospora、茎点霉属、铆钉菇属相对丰度升高。代森锰锌处理健康烟叶1、3、18 d时,Symmetrospora、铆钉菇属相对丰度升高,亡隔菌属和尾孢属相对丰度降低。Sampaiozyma、茎点霉属相对丰度在施药 3 d 时先降低,18 d时再升高(图1、表4)。
细菌群落在门水平上,代森锰锌处理前后感靶斑病烟叶与健康烟叶的主要菌群有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)、酸杆菌门(Acidobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus)、广域古菌门(Euryarchaeota),健康烟叶中独有的菌群有绿弯菌门(Chloroflexi)。施药前感靶斑病烟叶与健康烟叶的优势菌门均为变形菌门,施药前感靶斑病烟叶中变形菌门相对丰度(26.99%)高于健康烟叶(8.07%),其余菌群相对丰度较小。代森锰锌处理感病烟叶1、3 d时,变形菌门相对丰度升高,分别升高了10.81%、9.44%。代森锰锌处理健康烟叶1、18 d时,变形菌门相对丰度也升高,分别升高了1.62%、25.66%。施药3 d时,相对丰度降低,比施药前降低了3.18%(图1、表4)。
细菌群落在属水平上,代森锰锌处理前后感靶斑病烟叶与健康烟叶的主要菌群有甲基杆菌属(Methylobacterium)、假单胞属(Pesudomonas)、Aureimonas、不明根瘤菌属(Unidentified_Rhizobiaceae)、鞘脂单胞菌属(Sphingomonas)、马赛菌属(Massilia)、Unidentified_Christensenellaceae、微杆菌属(Microbacterium)、冷杆菌属(Frigoribacterium)、泛菌属(Pantoea)。施药前感靶斑病烟叶与健康烟叶的优势菌属均为甲基杆菌属,施药前感病烟叶中甲基杆菌属的相对丰度(5.01%)高于健康烟叶(4.63%)。代森锰锌处理感靶斑病烟叶1、3 d时,甲基杆菌属相对丰度升高,分别升高了16.51%、22.39%。施药1 d时,除假单胞属以外,甲基杆菌属与其他8个菌属的相对丰度存在显著性差异,施药3 d时,甲基杆菌属与其他9个菌属之间均存在显著性差异。代森锰锌处理健康烟叶1、3 d时,甲基杆菌属相对丰度降低,分别降低了0.10百分点、1.44百分点;施药18 d时,相对丰度升高,比施药前升高了24.26百分点。此外,代森锰锌处理感靶斑病烟叶1、3 d时,假单胞属、不明根瘤菌属、鞘脂单胞菌属、马赛菌属、微杆菌属、冷杆菌属相对丰度下降,而Aureimonas相对丰度升高。施药后健康烟叶主要菌属的相对丰度变化为:假单胞属在施药1、3、18 d时升高,Aureimonas在施药1、18 d 时升高,3 d时降低;马赛菌属在施药1、3、18 d时的相对丰度均减少。健康烟叶施药前和施药后 3 d,甲基杆菌属与表4中其他9个菌属的相对丰度存在显著性差异,而施药1、18 d时,甲基杆菌属与其他菌属之间不存在显著性差异(图1、表4)。
2.2.3 代森锰锌对烟叶微生态相关性的影响
本研究对真菌和细菌属水平top100的物种数据进行分析。由图2可知,施药前后在真菌群落中,担子菌门和子囊菌门中的菌属较多,占据主要位置,担子菌门中的Symmetrospora与亡隔菌属之间呈正相关(P<0.05,R>0.1),亡隔菌属与子囊菌门中的镰刀菌属之间呈正相关,镰刀菌属与铆钉菇属之间呈正相关,其余菌属之间均呈负相关。在细菌群落中,变形菌门中的菌属高于其他菌门,占据主要位置,所有菌属之間均呈负相关,其中厚壁菌门中的肠球菌属仅与酸杆菌门中的Candidatus_Solibacter, 变形菌门中的Alealigenes仅与萨特氏菌属之间呈负相关。
2.2.4 代森锰锌对烟叶微生物群落FUNGuild与PICRUSt功能预测
真菌群落FUNGuild功能预测结果(图3-A)表明,施药前感靶斑病烟叶的OTU中,优势功能群是植物病原类群。施药前健康烟叶的OTU中,优势功能群是未定义类群。感靶斑病烟叶施药1、3、9、18 d后植物病原类群占比均小于施药前,而未定义类群占比高于施药前。健康烟叶施药1、3 d后,未定义类群占比小于施药前,而植物病原类群占比大于施药前; 9、18 d后未定义的类群占比大于施药前,而植物病原类型占比小于施药前。此外,感靶斑病烟叶的OTU中,动物病原内生菌、植物病原木材腐生菌类群、植物病原木材腐生菌类型、内生植物病原、寄生真菌-未定义的腐生菌、未定义的腐生生物类型、外生菌根寄生真菌类群、植物病原类群占比次之,其他菌群占比较少,但也有不可忽视的作用。健康烟叶OTU中,外生菌根寄生真菌类型、植物病原木材腐生菌类型、内生植物病原类型占比次之,其他菌群占比较小。
利用KEGG Orthology(KO)数据库和COG数据库比对感靶斑病烟叶与健康烟叶细菌OTU对应的基因,进行PICRUSt基因预测。由图3-B可知,感靶斑病烟叶与健康烟叶施药前后共获得6类生物代谢通路功能类群,其中包括代谢类群、遗传信息处理类群、环境信息处理类群、细胞过程类群、人类疾病类群、有机系统类群。其中,代谢、遗传信息处理和环境信息处理类群为主要类群。
3 结论与讨论
本研究基于病斑面积与病情指数的评价发现,代森锰锌施药后9 d的防效分别为55.33%和45.03%,且防效随间隔时间的增加而逐渐降低,均低于70%,表明烟草靶斑病发生初期,代森锰锌在200 g/667 m2使用剂量下1次使用时的防控效果并不理想。为此,其在防控烟草靶斑病时应考虑增加药剂剂量或增加药剂使用次数,间隔期宜<9 d。
叶际微生物是一个庞大且多样性丰富的群体[25],烟草叶部病害与叶际微生物群落结构密切相关,不同叶部病害发生时其叶际优势菌群间存在差异。已有研究发现,烟草亚隔孢叶斑病危害期其叶际优势真菌有Boeremia、Meyerozyma、茎点霉属和链格孢属,优势细菌有假单胞菌属和泛菌属[26];烟草赤星病危害期其叶际优势真菌有链格孢属和茎点霉属,优势细菌有泛菌属和假单胞菌属[19-20]。烟叶霉烂病危害期其叶际优势真菌有曲霉属、链格孢属、尾孢属和茎点霉属,优势细菌有假单胞菌属和泛菌属[27]。本研究发现,靶斑病感病烟叶与健康烟叶的优势真菌属均为亡隔菌属,占比较多的真菌还有Symmetrospora、Sampaiozyma、铆钉菇属、尾孢属、茎点霉属;镰刀菌属、Plectosphaerella和链格孢属占比较少。结果与前人研究的优势菌属均为其致病菌的结果[28]一致,同时赤星病、亚格孢壳属、白粉病烟叶上均未检测到亡隔菌属真菌,推测亡隔菌属并不是烟叶叶际习居菌,烟草靶斑病的初始侵染源可能来自于其他寄主或者环境。
代森锰锌在当地未作为防治烟草叶斑病类病害的主要药剂,因此病原菌对于该药剂的抗药性较低。该药剂的使用对所有叶际真菌和细菌菌属均产生了影响。感病烟叶施药后叶际真菌亡隔菌属、Plectosphaerella的相对丰度降低; Symmetrospora、 茎点霉属、铆钉菇属的相对丰度均增加。健康烟叶施药后,叶际真菌亡隔菌属、尾孢属相对丰度均降低;Symmetrospora、铆钉菇属、Sampaiozyma相对丰度均升高。在细菌群落属水平上, 感病烟叶与健康烟叶的优势细菌菌属均为甲基杆菌属和假单胞属,占比较少的细菌菌属有Aureimonas、不明根瘤菌属、鞘脂单胞菌属、马赛菌属、Unidentified_Christensenellaceae、微杆菌属、冷杆菌属、泛菌属。推测甲基杆菌属为烟叶叶际优势习居菌。施用代森锰锌后各细菌菌群相对丰度均发生变化。感病烟叶施药后假单胞属、不明根瘤菌属、鞘脂单胞菌属、马赛菌屬、微杆菌属、冷杆菌属的相对丰度均降低;甲基杆菌属、Aureimonas的相对丰度均升高。健康烟叶施药后甲基杆菌属、马赛菌属、Aureimonas的相对丰度均降低;假单胞属、冷杆菌属相对丰度均升高。为此,本研究发现代森锰锌会影响烟叶包括亡隔菌属在内的多种病原菌及包括假单胞属在内的多种非致病菌菌群结构的变化,进一步验证了代森锰锌的广谱性。已有研究发现,药剂的使用会改变烟叶叶际微生物群落结构,Chen等研究发现,施用菌核净会使烟叶叶际细菌中鞘脂单胞菌属、黄色杆菌属和沙雷氏菌属的相对丰度降低[29]。以上研究结果均与本研究结果类似。除靶标病原菌外,本研究发现烟叶叶际部分真菌与细菌的菌属相对丰度也有所降低,说明代森锰锌对靶斑病外的其他病害也具有一定的抑制作用;同时,发现部分菌属的相对丰度升高,推测这些菌属也参与了烟草靶斑病的发生或危害,代森锰锌对这些菌属的抑制活性较弱。烟草感靶斑病烟叶与健康烟叶叶际微生物群落结构与自然环境条件关系密切,目前环境因子对叶际微生物的影响也缺乏一定的认识,试验下一步将从环境因子(温度、湿度、降水量等)和病情指数等方面对烟草感靶斑病烟叶和健康烟叶叶际生态的影响进行分析验证。
菌群相关性结果表明,在真菌门水平下,担子菌门和子囊菌门的菌属占比较大;在细菌门水平下,变形菌门的菌属占比较大,进一步验证了高通量测序结果。真菌群落中的菌属之间主要呈负相关,仅有少部分菌属之间呈正相关,其中,担子菌门中的Symmetrospora菌属与亡隔菌属之间呈正相关,亡隔菌属与子囊菌门中的镰刀菌属之间呈正相关,镰刀菌属与铆钉菇属之间呈正相关,推测它们之间存在互利共生关系,或它们有相同的营养所需,其余菌属以及细菌各菌属之间呈负相关。前人研究表明,真菌和细菌各属之间对资源存在着潜在的竞争[30],本研究结果发现施药前后大量菌属之间呈现负相关,推测由于药剂的使用增加了各菌属之间的潜在竞争。
定植于烟叶叶际的微生物通常都具有一定的生物功能[31-33],前人研究发现,烟叶霉烂病发生期叶际真菌主要为植物病原类[27];亚隔孢壳属叶斑病发生期叶际真菌主要为植物病原菌和植物病原菌-未定义的腐生菌类群,叶际细菌代谢通路功能主要为代谢、遗传信息处理和环境信息处理类群[26],本研究发现烟草靶斑病烟叶真菌群落在施药前后优势菌群均分布于植物病原类,代森锰锌施用后可显著降低该功能类群的丰度,随着施药时间的增加,其丰度降低;相较而言,健康烟叶施药前的叶际优势真菌主要分布于未定义类群,代森锰锌施药降低了其相对丰度,同时也降低了叶际植物病原类的丰度,随着施药时间的增加,其相对丰度在施药1、3 d时增加,随后降低,可能是由于一开始其他功能类群对该药剂较敏感,抑制了其他功能类群生长,从而病原菌获得了更多资源。也有可能是感病烟叶叶际病原菌已经降落到健康烟叶上,药剂无法短时间将其消除。叶际细菌群落在施药前后优势菌群均分布于代谢类,代森锰锌施用后可降低该功能群的丰度,随着施药时间的增加,其丰度降低,但遗传信息处理类及环境信息处理类的相对丰度增加。综上,推测代森锰锌能有效影响烟叶叶际真菌与细菌功能的持效期均在9 d左右。因此,建议使用代森锰锌防控烟草靶斑病时,其间隔期宜<9 d。
参考文献:
[1]吴元华,王左斌,刘志恒,等. 我国烟草新病害——靶斑病[J]. 中国烟草学报,2006,12(6):22.
[2]吴元华,赵艳琴,赵秀香,等. 烟草靶斑病原鉴定及生物学特性研究[J]. 沈阳农业大学学报,2012,43(5):521-527.
[3]伏 颖,吴元华,穆凌霄,等. 烟草靶斑病室内药剂筛选[J]. 江苏农业科学,2011,39(3):153-155.
[4]王左斌,吴元华,赵秀香,等. “嘧肽菌净” 对烟草靶斑病的抑茵作用及田间药效试验[J]. 烟草科技,2007,40(9):61-64.
[5]Graham S L,Hansen W H,Davis K J,et al. Effects of one-year administration of ethylenethiourea upon the thyroid of the rat[J]. Journal of Agricultural and Food Chemistry,1973,21(3):324-329.
[6]Lindow S E,Brandl M T. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology,2003,69(4):1875-1883.
[7]Huang Z D,Wang P,Pu Z X,et al. Effects of mancozeb on citrus rhizosphere bacterial community[J]. Microbial Pathogenesis,2021,154:104845.
[8]Vorholt J A.Microbial life in the phyllosphere[J]. Nature Reviews Microbiology,2012,10(12):828-840.
[9]Leveau J,Lindow S E. Appetite of an epiphyte:quantitative monitoring of bacterial sugar consumption in the phyllosphere[J]. PNAS,2001,98(6):3446-3453.
[10]Pati B R,Sengupta S,Chandra A K.Role of nitrogen fixing bacteria on the phyllosphere of wheat seedlings[J]. Acta Microbiologica et Immunologica Hungarica,1995,42(4):427-433.
[11]Nair J R,Singh G,Sekar V.Isolation and characterization of a novel Bacillus strain from coffee phyllosphere showing antifungal activity[J]. Journal of Applied Microbiology,2002,93(5):772-780.
[12]Krechel A,Faupel A,Hallmann J,et al. Potato-associated bacteria and their antagonistic potential towards plant-pathogenic fungi and the plant-parasitic nematode Meloidogyne incognita (Kofoid & White) Chitwood[J]. Canadian Journal of Microbiology,2002,48(9):772-786.
[13]Azevedo J,Maccheroni W,Pereira J,et al. Endophytic microorganisms:a review on insect control and recent advances on tropical plants[J]. Electronic Journal of Biotechnology,2000,3(1):15-16.[HJ2mm]
[14]Sandhu A,Halverson L J,Beattie G A. Bacterial degradation of airborne phenol in the phyllosphere[J]. Environmental Microbiology,2007,9(2):383-392.
[15]Sapkota R,Knorr K,Jrgensen L N,et al. Host genotype is an important determinant of the cereal phyllosphere mycobiome[J]. New Phytologist,2015,207(4):1134-1144.
[16]Zhang Y G,Cong J,Lu H,et al. Soil bacterial diversity patterns and drivers along an elevational gradient on Shennongjia Mountain,China[J]. Microbial Biotechnology,2015,8(4):739-746.
[17]Copeland J K,Yuan L J,Layeghifard M,et al. Seasonal community succession of the phyllosphere microbiome[J]. Molecular Plant-Microbe Interactions,2015,28(3):274-285.
[18]黄 宇,汪汉成,陈乾丽,等. 感染白粉病烟株典型病级叶际真菌群落结构与多样性分析[J]. 烟草科技,2021,54(4):8-14.
[19]刘 畅,汪汉成,谢红炼,等. 感染赤星病烟草叶际细菌的多样性分析[J]. 烟草科技,2020,53(2):8-14.
[20]刘 畅,汪汉成,谢红炼,等. 感赤星病烟叶的真菌群落结构分析[J]. 贵州农業科学,2019,47(7):54-59.
[21]谭舒心. 蜘蛛兰褐斑病及其病原菌鉴定与病害的药剂控制试验[D]. 重庆:西南大学,2009.
[22]周建全,张忠光,董 雪,等. 不同药剂对烟草靶斑病的抑菌作用及田间药效研究[J]. 安徽农业科学,2015,43(25):96-97,99.
[23]Mboowa G,Sserwadda I,Amujal M,et al. Human genomic loci important in common infectious diseases:role of high-throughput sequencing and genome-wide association studies[J]. Canadian Journal of Infectious Diseases and Medical Microbiology,2018,2018(6010):1-9.
[24]谢红炼,汪汉成,蔡刘体,等. 烟草种子内生细菌群落结构与多样性[J]. 微生物学报,2020,60(3):601-616.
[25]Stone B W G,Weingarten E A,Jackson C R.The role of the phyllosphere microbiome in plant health and function[J]. Annual Plant Reviews Online,2018,1(2):533-556.
[26]Huang Y,Wang H C,Cai L T,et al. Phyllospheric microbial composition and diversity of the tobacco leaves infected by Didymella segeticola[J]. Frontiers in Microbiology,2021,12:699699.
[27]陈乾丽,李 忠,汪汉成,等. 烤后不同霉变程度烟叶际真菌群落组成与多样性分析[J]. 微生物学报,2019,59(12):2401-2409.
[28]Sun M L,Shi C H,Wang H C,et al. Effect of disease severity on the structure and diversity of the phyllosphere microbial community in tobacco[J]. Frontiers in Microbiology,2023,13:1081576.
[29]Chen Q L,Cai L,Wang H C,et al. Fungal composition and diversity of the tobacco leaf phyllosphere during curing of leaves[J]. Frontiers in Microbiology,2020,11:554051.
[30]Leopold D R,Busby P E. Host genotype and colonist arrival order jointly govern plant microbiome composition and function[J]. Current Biology,2020,30(16):3260-3266.
[31]梁宗琦,韩燕峰,梁建东,等. 从细胞内共生到多尺度共生:回顾与展望[J]. 菌物学报,2020,39(12):2202-2217.
[32]Liang Z Q,Han Y F,Liang J D,et al. From intracellular symbiosis to multiscale symbiosis:review and prospect[J]. Mycosystema,2020,39(12):2202-2217.
[33]Scharnagl K. The scale of symbiosis[J]. Symbiosis,2019,78(1):7-17.
收稿日期:2022-11-11
项目基金:国家自然科学基金(编号:31960550、32160522);贵州省科技基金项目(编号:黔科合基础-ZK[2021]重点036);中国烟草总公司科技项目[编号:110202001035(LS-04)、110202101048(LS-08)];贵州省“百层次”创新型人才项目(编号:黔科合平台人才-GCC[2022]028-1)。
作者简介:张 艺(1996—),女,贵州遵义人,硕士研究生,主要从事作物栽培学与耕作学研究。E-mail:1158852415@qq.com。
通信作者:王 丰,博士,研究员,主要从事微生物研究,E-mail:yancaowangfeng@163.com;汪漢成,研究员,主要从事烟草植保及微生态研究,E-mail:xiaobaiyang126@hotmail.com。

