维生素C工业废弃液对新疆盐碱土中棉花种子萌发的影响
韩晓 高明夫 徐慧

摘要:古龙酸母液(RAE)和巨大芽孢杆菌废液(CBS)是维生素C工业生产过程中产生的液体废弃物。采用盐碱性土壤棉花盆栽试验,通过CBS包被棉花种子并施浇RAE稀释液,以评估维生素C发酵工业废弃物对棉花种子萌发的影响以及在农业上的资源化利用潜力。结果表明,CBS包被种子、施加稀释50倍RAE或两者联合使用均可以明显提高种子萌发率,促进根的伸长和鲜质量的增加,且两者联合使用效果更好。一方面,两者联合使用可增加土壤有机碳含量并在发芽期使土壤pH值从8.2降低至6.5,为种子萌发提供更有利的外部环境条件,使种子发芽率、发芽指数、活力指数分别提高了37.49%、54.55%和44.09%。另一方面,通过提高L-古洛糖酸-1,4-内酯氧化酶基因表达水平,根部维生素C含量提高87.73%,增强了种子在发芽期的非生物胁迫抗性,促进根的生长(10 d时的根长和鲜质量分别增加19.33%和49.64%);与棉花根细胞壁形成相关的内切几丁质酶基因(ECA)和木葡聚糖内转糖苷酶/水解酶基因(XTH)的表达在多数试验时期明显上调,也表明了根部发育更活跃。通过CBS包被棉花种子和施加RAE影响盐碱土中棉花种子萌发的试验研究,为资源化利用维生素C工业废弃液并开发出一种盐碱土棉花种植新技术提供了理论依据。
关键词:维生素C工业废弃液;盐碱土;有机质;棉花;萌发;盐胁迫
中图分类号:Q564;S562.01文献标志码:A文章编号:1002-1302(2023)17-0105-06
棉花是我国主要经济作物之一。据国家统计局统计,2021年新疆棉花产量达512.9万t,占全国棉花总产量的89.5%。得益于新疆独特的光热条件,新疆棉花拥有较高的品质优势,是新疆农业支柱性经济产业[1]。作为一种耐盐作物,棉花可以较好地适应盐碱土环境,也是盐渍土地区经济发展的主要先锋作物。但棉花种子在萌发出苗阶段对土壤盐碱度敏感,在此期间遭受盐碱胁迫会抑制种子活力[2]。碱性盐胁迫的危害远大于中性盐胁迫,盐碱胁迫导致植物细胞质膜被破坏,代谢紊乱,阻碍植物的生长发育[3]。随着盐碱浓度的增加,种子发芽率、胚芽长度等均有降低的趋势[4],影响植物种子萌发过程中内部物质转化,降低酶活性,抑制种子萌发[5],最终导致棉花发芽率低、幼苗瘦弱、减产等后果[6-7]。作物出苗是保证作物产量的首要前提,由于棉花播种萌发过程中会受到土壤酸碱度、盐分含量、种子质量等因素的影响,导致棉花萌发状况和出苗率参差不齐,进而影响棉花种植密度和产量,所以提高棉花萌发率与出苗率对提高棉花产量具有重要的现实意义[8]。有研究表明,适宜浓度的苹果酸可缓解铜胁迫对珊瑚樱种子萌发的抑制作用,提高种子发芽指数和活力指数,增强幼苗胁迫抵抗能力[9]。柠檬酸或低浓度阿魏酸和香豆酸可促进甜瓜种子发芽[10]。杨洪兵的研究表明,适宜浓度的外源苹果酸和柠檬酸对盐胁迫具有较好的缓解作用,对盐胁迫下荞麦种子发芽率、活力指数及幼苗生长有明显的促进效应[11]。此外,具有解磷功能的芽孢杆菌也可促进种子萌发和胚轴伸长[12]。
古龙酸母液(RAE)是工业上通过二步微生物发酵法生产维生素C前体化合物(2-酮基-L-古龙酸,简称2KGA)过程中产生的酸性废液,其主要成分是2KGA、甲酸、草酸混合物。我国是世界上最大的维生素C(VC)生产和供应国,每年排放约5万t废弃RAE和12万t巨大芽孢杆菌废液(CBS)[13]。笔者推测含有低分子量有机酸的RAE和含有巨大芽孢杆菌的CBS具有促进盐碱条件下作物种子萌发的潜力。本研究采用CBS对棉花种子进行包被,同时联合冲施RAE稀释液,探究二者对新疆盐碱土中棉花种子萌发过程以及关键基因表达和代谢物等因素的影响,以期为RAE和CBS的资源化利用提供理论基础,同时提供一种具有应用潜力的促盐碱土中棉花种子萌发的新技术。
1 材料与方法
1.1 试验材料
试验于2021年7月1—30日在中国科学院沈阳应用生态研究所环境微生物组实验室进行。试验土壤取自新疆阿克苏地区库车市棉花种植区,土壤pH值为8.26,含水量为7.3%,土壤有机碳、全氮含量分别为12.44、0.67 g/kg,土壤铵态氮、硝态氮、有效磷的含量分别为15.78、8.74、22.07 mg/kg。试验所用棉花种子为陆地棉种子。
1.2 盆栽试验
共设计4个试验组,每组设3次重复。对照组(CK):水包被+水施浇;处理组1(RAE):水包被+稀释50倍RAE施浇;处理组2(CBS):CBS包被+水施浇;处理组3(RC):CBS包被+稀释50倍RAE施浇。包被处理:种子在CBS液中浸湿后取出,分散在培养皿中,置于通风处24 h至干燥。重复上述步骤1次,即共包被2次。
RAE和RC处理施澆稀释50倍RAE后铺种覆土,CK和CBS处理施加等量清水后铺种覆土,每盆150颗种子。每天对已发芽的种子(芽长超过种子长度1/2)进行计数和测量根长度,直到连续3 d没有新的种子萌发为止,并测定土壤的pH值变化。
1.3 种子发芽参数
总发芽率(GP)指测试种子发芽数占测试种子总数的比例。
GP=(n/N)×100%。
式中:n为最终发芽的种子数;N为试验种子数。
发芽速率(GR)计算公式如下:
式中:GPt为第t天(t=1,2,3,…)的发芽率;Dt为相应的发芽时间,d。
发芽指数(GI)指种子发芽数与发芽需要天数之比。
式中:Gt为当天的发芽数(t=1,2,3,…);Dt为相应的发芽时间,d。
活力指数(VI)是种子发芽速率和生长量的综合反映,是种子活力的更好指标。
式中:Lr为发芽种子的平均根长度,mm。
1.4 土壤有机碳含量、pH值及植物维生素C含量的测定
土壤pH值采用电位法[14]测定。称取过2 mm孔径筛的风干土样5 g至烧杯中,加入12.5 mL去除CO2的蒸馏水,搅拌1~2 min,25 ℃下,摇床振荡 30 min 后进行测定。检测电极插入待测液中,静置片刻,待读数稳定后记下pH值。
有机碳含量的测定采用元素分析仪测定法[15]。土壤风干后,用1 mol/L盐酸去除HCO-3/CO2-3,再次风干后用研钵研磨并过孔径为0.05 mm的土壤筛,称取50 mg土壤样品,并用锡箔纸包裹好,利用元素分析仪(multi N/C 3100,德国耶拿分析仪器股份公司)测定有机碳含量。
植物维生素C含量的测定参考Gao等的方法[16],采用高效液相色谱法。测定样品取自栽培10 d时收集的棉花根系。在液氮速冻下研磨样品,在冰浴条件下,将其溶于2 mL的10 mg/mL偏磷酸中。在 4 ℃ 条件下,匀浆离心(转速7 200 g) 10 min,上清液用注射过滤器(0.22 μm)过滤后,将20 μL滤液注入AQ-C18色谱柱中进行分析。检测条件:流动相,20 mmol/L磷酸二氢钠溶液(pH值2.8) ∶乙腈=95 ∶5;流速为1.0 mL/min;温度为 40 ℃;检测波长为 243 nm。根据维生素C标准曲线确定样品中维生素C的含量。
1.5 细胞壁和维生素C代谢酶基因表达量测定
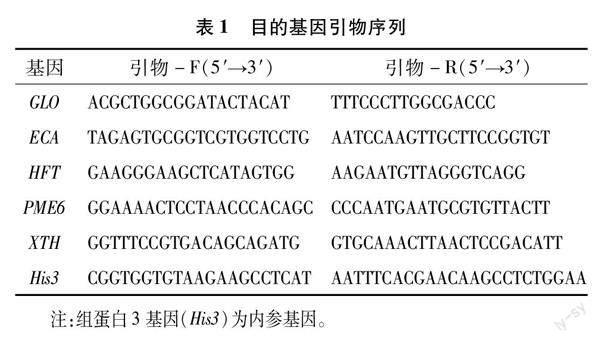
选取5个与植物细胞壁合成以及维生素C代谢相关的基因,分别是内切几丁质酶基因(ECA)、ω-羟基棕榈酸O-阿魏酰转移酶基因(HFT)、果胶甲酯酶6基因(PME6)、木葡聚糖内转糖苷酶/水解酶基因(XTH)和L-古洛糖酸-1,4-内酯氧化酶基因(GLO)进行相对基因表达量测定。
相对基因表达量测定方法:实时荧光定量PCR(RT-qPCR)法。称取80~100 mg棉花根系样品,液氮速冻后研磨至无明显组织碎片,总RNA的提取按照SteadyPure Universal RNA Extraction Kit [Accurate Biotechnology (Human) co.,Ltd]说明执行。cDNA的制备按照EvoM-MLV RT Premix [Accurate Biotechnology (Human) co.,Ltd]说明执行,10 μL反应体系中,总RNA量不超过500 ng。RT-qPCR反应体系按照SYBR Green Premix Pro Taq HS qPCR Kit [Accurate Biotechnology (Human) co.,Ltd]说明执行,检测平台为Rotor-Gene 3000,在 20 μL 的反应体系里,cDNA模板量不超过 100 ng,引物见表1。程序设定:热启动95 ℃,5 min,1个循环;变性 95 ℃,15 s;退火60 ℃,35 s;延伸72 ℃,45 s,45个循环,基因相对表达量采用2-ΔΔCT算法计算。
1.6 数据分析
采用Microsoft Excel 2020软件进行数据处理,用SPSS 21.0软件在0.05水平上对数据进行方差分析,检验处理组与对照组差异的显著性,采用Graphpad Prism 8.0软件绘图。
2 结果与分析
2.1 棉花种子发芽率的日变化
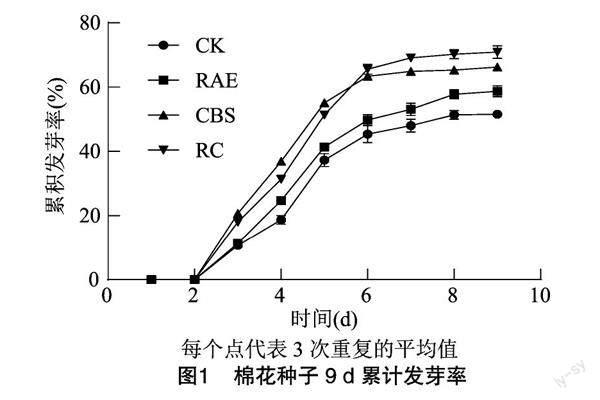
由图1可知,各组棉花种子的累积发芽率在孵育9 d时趋于平稳,其中CK在孵育9 d时累积发芽率为51.56%。各处理棉花种子萌发9 d内的累计发芽率均明显高于CK。RAE处理的发芽率较CK提高7.11百分点,CBS处理的发芽率较CK提高14.66百分点,RC处理的发芽率较CK提高19.33百分点。上述结果表明,RAE和CBS联合使用(RC处理)对棉花种子发芽率的提升效果最好。
2.2 种子萌发各参数的变化
由表2可知,各处理组的种子萌发相关参数,即总发芽率(GP)、发芽速率(GR)、发芽指数(GI)与CK相比均有极显著增加(P<0.01),尤其是RAE与CBS联合使用的RC处理分别使上述参数提高了37.49%、54.55%、44.09%。活力指数(VI)是体现种子萌发活力的主要参数,施加稀释50倍RAE、CBS包被种子单独使用或稀释50倍RAE与CBS包被种子联合使用对VI都有极显著影响,稀释50倍RAE与CBS包被种子联合使用使VI提高了87.05%,表明两者联合使用可以极显著促进棉花种子萌发。
2.3 RAE与CBS对种子萌发后根生长的影响
由图2可知,3种不同处理均可促进棉种发芽后根的生长。4 d时,相较于CK,RAE、CBS、RC处理的根部长度分别增加32.08%、34.54%、54.43%;6 d时,根长分别显著或极显著增加32.08%、52.40%、48.03%;10 d时,RAE處理与CK无显著差异,而CBS处理和RC处理分别极显著增加13.76%和19.33%。
不同处理对根部鲜质量的影响与对根长度的影响趋势大体相同,RAE、CBS、RC处理均能增加根鲜质量,且RC处理效果最好。在整个试验周期内,各处理组种子发芽后,根鲜质量均有增加。4 d时,3种处理的根鲜质量分别增加4.39%、28.69%和31.61%;6 d时,根鲜质量分别增加38.44%、36.45%和85.75%;10 d时,根鲜质量分别显著或极显著增加18.55%、25.95%和49.64%,依然是RC处理效果最好。
2.4 细胞壁合成相关基因表达变化
由图3可知,4个细胞壁合成相关基因的表达水平在不同时期变化有所不同。相比于CK,RAE处理能显著或极显著提高HFT和XTH基因的表达,并维持在较高的表达水平。在试验中期(6 d时),观察到CBS处理的4个基因的表达水平均提高。RC处理的ECA和XTH表达量则处于较高水平(6 d 时的XTH表达量除外)。
2.5 GLO表达水平对维生素C代谢的影响
L-古洛糖酸-1,4-内酯氧化酶(GLO)是植物维生素C合成途径中的关键酶之一,维生素C的积累与GLO的表达水平密切相关。由图4可知,在试验前期(4 d时),RAE处理的GLO表达水平较CK极显著提升,但之后出现下调。在不同时间点,CBS处理的GLO表达水平一直高于CK。而RC处理同样能够促使GLO维持在较高的表达水平, 并且在中期(6 d时)高于CBS处理。同时,各处理组根部10 d时的维生素C含量均显著或极显著高于CK,其中,RC处理对维生素C积累的促进效果最好,根部维生素C含量较CK提高87.73%。
2.6 土壤有机碳含量与pH值变化
新疆库车市棉花种植区土壤pH值为8.26,接近重度碱性(pH值为8.5),碱性环境是种子萌发的关键限制因素之一。从图5可以看出,施浇RAE(RAE和RC处理)促进了土壤有机碳的积累,并且土壤pH值最低降至6.5。可见,RAE在一段时间内可以为种子萌发提供较适宜的酸碱环境,并为提高土壤水溶性有机碳含量做出重要贡献,提供了相对有利的种子萌发环境。
3 讨论与结论
维生素C发酵工业所产生的废弃RAE和CBS排放量大、化学需氧量(COD)高,一直以来被作为废水进行处理,造成严重的资源浪费和环保压力。因而,探索其可能被资源化再利用的新途径是一项迫切需求。笔者所在团队的近期研究表明,二者的施用可以增加土壤有机质含量,并提高作物维生素C含量,进而提高作物在盐碱土壤上的产量[17],并且2KGA作为RAE的主要成分能解除盐胁迫对作物生长的抑制作用已被证实[16],但二者对作物种子萌发,尤其是在盐碱性土壤中对棉种萌发的影响尚不清楚。
本研究中,施浇RAE或CBS包被棉花种子均能提高种子的发芽率、发芽指数、活力指数等发芽参数,促进了棉花种子的萌发,并且二者联合使用的效果更好。已有研究表明,种子从萌发到幼苗期对盐碱胁迫十分敏感[18-19]。有报道认为,利用秸秆等生物炭或有机酸可以提高土壤有机碳含量,改良盐碱化土壤,有机酸还可以降低土壤pH值,并缓解盐胁迫对植物的危害[20-21]。本试验中,RAE和CBS联合施用情况下,一方面,RAE中的2KGA作为一种低分子量有机酸可以提高土壤有机质含量、丰富土壤微生物种群[22],降低碱性土壤的pH值;另一方面,CBS中的主要微生物为巨大芽孢杆菌,该菌具有解磷功能,并在土壤中存在明显的根际效应[23],促进固态磷转化为可供植物利用的有效磷,增加土壤养分和有益菌丰度,抑制病原菌属[24],同时可促进种子萌发[25]。因此,二者的联合使用为棉花种子在盐碱土中的萌发提供了更有利的土壤環境,进而提高了种子发芽率。
本研究发现,RAE和CBS处理后均能促进棉种发芽后根部长度和鲜质量的增加,且两者联合使用的作用效果更好。Gao等研究发现,2KGA能促进GLO表达量增加,并提高维生素 C 含量,有效缓解盐胁迫的抑制作用,并促进植物幼苗和侧根的生长[16]。在植物中,GLO(EC 1.1.3.8)催化L-古洛糖酸-1,4-内酯向维生素C的转化。本研究中,浇施富含2KGA的RAE时,棉花根系GLO基因表达在短时间内快速上调,并且根部的维生素C含量升高,笔者推测这是强化非生物胁迫抗性的主要原因。Aghaei等也指出,增强内源维生素C含量可以促进根的发育,同时能够改善植物的能量代谢[26],进而促进植物的生长[27]。此外,有研究指出,芽孢杆菌通过对根分泌物的趋化作用调控根际细菌群落,提高植物维生素C含量[28],为促进根系发育创造了条件。因此,RAE和CBS处理提高根部维生素C积累是促进胚根顺利向根发育的重要机制之一。ECA、XTH是与植物根部细胞生长分裂时与细胞壁发育有关的基因,这2个基因表达水平的升高也证实了根系发育更加活跃,表明了二者参与了种子萌发、植株发育过程,在根系建成与缓解胁迫中发挥重要的作用[29-30]。此外,最新研究表明,RAE与CBS联合使用可以促进作物的生长,提高生物量,并且相对于单独使用RAE或CBS的效果更好[31],再次证实二者在联合使用时将发挥更好的作用。
工业生产维生素C所产生的液体废弃物RAE和CBS均能促进盐碱性土壤中棉花种子的萌发和根系发育,且两者联合使用效果更佳。一方面,通过改善土壤理化性质,增加土壤有机碳含量,降低土壤pH值,促进棉花种子萌发。另一方面,增强GLO基因的表达,提高根部维生素C的合成,提高种子萌发阶段的盐碱胁迫抗性,促进根的发育。本研究为RAE和CBS的资源化利用提供了重要理论依据,同时为我国盐碱土棉花种植提供了一项简便易行的提高种子萌发率的新技术。
参考文献:
[1]梁亚军,李雪源,郑巨云,等. 新疆2019年棉花产业情况概述及存在问题与策略[J]. 棉花科学,2020,42(1):14-20.
[2]李双男,郭慧娟,王 晶,等. 不同盐碱胁迫对棉花种子萌发的影响[J]. 种子,2018,37(1):38-45.
[3]Fang S M,Hou X,Liang X L.Response mechanisms of plants under saline-alkali stress[J]. Frontiers in Plant Science,2021,12:667458.
[4]Zhang H,Liu X L,Zhang R X,et al. Root damage under alkaline stress is associated with reactive oxygen species accumulation in rice (Oryza sativa L.)[J]. Frontiers in Plant Science,2017,8:1580.
[5]王妮妮. 混合盐碱胁迫对皂荚种子萌发的影响[J]. 东北林业大学学报,2017,45(4):14-18,27.
[6]An M J,Wang X L,Chang D D,et al. Application of compound material alleviates saline and alkaline stress in cotton leaves through regulation of the transcriptome[J]. BMC Plant Biology,2020,20(1):462.
[7]白灯莎·买买提艾力,李寒暝,张少民,等. 不同棉花品种种子萌发阶段耐盐性综合评价[J]. 新疆农业科学,2011,48(1):18-24.
[8]薛金利. 基于無人机可见光影像的棉花苗情监测[D]. 石河子:石河子大学,2020.
[9]张志忠,孙志浩,陈文辉,等. 有机酸类化感物质对甜瓜的化感效应[J]. 生态学报,2013,33(15):4591-4598.
[10]李芹梅,潘曲波,闻永慧,等. 外源低分子有机酸对铜胁迫下珊瑚樱种子萌发的影响[J]. 西北农林科技大学学报(自然科学版),2022,50(6):20-27,34.
[11]杨洪兵. 外源有机酸对盐胁迫下荞麦种子萌发及幼苗生长的效应[J]. 吉林农业科学,2013,38(4):5-7.
[12]林志伟,肖翠红,白鑫雨,等. 解磷菌DQ-N对大豆种子萌发及苗期生长的影响[J]. 大豆科学,2021,40(5):676-681.
[13]徐 慧,杨伟超,李嘉文. 维生素C第二步混菌发酵技术研究新进展[J]. 微生物学杂志,2021,41(2):1-9.
[14]吴淑娟,任运涛,吴彩霞,等. 草地土壤pH值测定方法比较研究[J]. 土壤通报,2018,49(2):343-348.
[15]高翠萍,李 岩,刘美英,等. Vario MACRO cube元素分析仪测定土壤碳氮方法研究[J]. 北方农业学报,2017,45(1):76-79.
[16]Gao M F,Sun H,Shi M J,et al. 2-Keto-L-gulonic acid improved the salt stress resistance of non-heading Chinese cabbage by increasing L-ascorbic acid accumulation[J]. Frontiers in Plant Science,2021,12:697184. [HJ2mm]
[17]Kong T,Xu H,Wang Z Y,et al. Effect of a residue after evaporation from industrial vitamin C fermentation on chemical and microbial properties of alkali-saline soil[J]. Pakistan Journal of Pharmaceutical Sciences,2014,27(4):1069-1074.
[18]赵 颖,魏小红,赫亚龙,等. 混合盐碱胁迫对藜麦种子萌发和幼苗抗氧化特性的影响[J]. 草业学报,2019,28(2):156-167.
[19]张安琪,郑春莲,李宗毅,等. 棉花成苗和幼苗生长对咸水滴灌的响应特征[J]. 灌溉排水学报,2018,37(10):16-22.
[20]彭 浩,宋文路,王晓强. 水杨酸、脱落酸对盐胁迫下玉米种子萌发和幼苗生长的影响[J]. 玉米科学,2016,24(6):75-78,87.
[21]刘 强,袁延飞,刘一帆,等. 生物炭对盐渍化土壤改良的研究进展[J]. 地球科学进展,2022,37(10):1005-1024.
[22]孔 涛,孟凡浩,关 飞,等. 古龙酸母液对盐碱土壤微生物数量和酶活性的影响[J]. 环境化学,2015,34(11):2053-2058.
[23]赵小蓉,林启美,孙焱鑫,等. 小麦根际与非根际解磷细菌的分布[J]. 华北农学报,2001,16(1):111-115.
[24]王 萍,李一曼,王雪佳,等. 巨大芽孢杆菌对土壤理化性质及植物富集镉锌的影响[J]. 环境科学,2022,43(12):5798-5807.
[25]韩丽珍,林佳静,郑 欢,等. 一株溶磷菌的抗逆促生特性及对种子萌发的研究[J]. 种子,2019,38(10):34-40.
[26]Aghaei K,Ehsanpour A A,Komatsu S. Proteome analysis of potato under salt stress[J]. Journal of Proteome Research,2008,7(11):4858-4868.
[27]Niu J P,Chen Z,Yu S,et al. Ascorbic acid regulates nitrogen,energy,and gas exchange metabolisms of alfalfa in response to high-nitrate stress[J]. Environmental Science and Pollution Research,2022,29(16):24085-24097.
[28]Liang Y R,Liao F C,Huang T P. Deciphering the influence of Bacillus subtilis strain Ydj3 colonization on the vitamin C contents and rhizosphere microbiomes of sweet peppers[J]. PLoS One,2022,17(2):e0264276.
[29]欧阳石文,赵开军,冯兰香. 植物中几丁质酶的作用[J]. 生物学通报,2002,37(6):13-14.
[30]吕照清,任丹丹,周 贺,等. ‘黄花梨及其芽变‘绿黄花梨HHT基因克隆与表达分析[J]. 西北植物学报,2016,36(6):1105-1109.
[31]Wang B,Sun H,Yang W C,et al. Potential utilization of vitamin C industrial effluents in agriculture:soil fertility and bacterial community composition[J]. Science of the Total Environment,2022,851:158253.
收稿日期:2022-12-07
基金项目:国家重点研发计划(编号:2020YFA0907800);沈阳市科技计划项目(编号:22-322-3-05)。
作者简介:韩 晓(1998—),女,山东泰安人,硕士研究生,研究方向为营养代谢与非生物胁迫。E-mail:hanxiao52002591@163.com。
通信作者:徐 慧,博士,研究员,博士生导师,研究方向为植物营养调节与环境微生物。E-mail:xuhui@iae.ac.cn。

