内化素G在单增李斯特菌入侵巨噬细胞中的作用研究
史文静,刘圆园,王子坚,王学俭,齐玉梅,田常青,苟惠天*,薛慧文*
(1.甘肃农业大学,甘肃兰州 730070;2.甘肃省动物疫病预防控制中心,甘肃兰州 730199;3.兰州市西固区动物疫病预防控制中心,甘肃兰州 730060)
单增李斯特菌(Listeriamonocytogenes,LM)是一种食源性病原菌,可导致李斯特菌病。它是一种兼性细胞内寄生菌,能够入侵吞噬细胞和非吞噬细胞并繁殖。在摄入受污染的食物后,细菌会穿过肠道屏障,通过血液进入肝脏和脾,大多数细菌会被免疫系统清除[1]。在免疫功能受损和低下的群体中,细菌可穿过血脑屏障和胎盘屏障,到达中枢神经系统和胎盘[2]。
目前已知有25种内化素(internalin,Inl),Inl A和Inl B是李斯特菌特有且重要的毒力因子。其中Inl A由于其C末端Leu-Pro-X-Thr-Gly(LPXTG)基序而与细菌表面共价连接,通过与宿主的E-钙粘蛋白相互作用促进人类肠上皮样细胞系的感染,是体内侵袭肠道和胎盘绒毛所必需的[3]。Inl B通过其GW结构域与脂磷壁酸结合到细菌表面,具有更宽的宿主谱,可与宿主的细胞膜肝细胞生长因子受体结合并通过激活磷脂酰肌醇-3-激酶来促进吞噬,也可结合补体分子C1q发挥作用[4]。本研究的Inl G是由Lmo0262基因编码的细胞表面蛋白,与Inl A同属含LPXTG结构[5],紧紧锚定在革兰氏阳性菌细胞壁上。与Inl A相比,Inl E、Inl F、Inl G和Inl H不参与入侵,但对宿主组织的定植具有重要意义。有研究表明LM入侵非吞噬细胞时Inl G、Inl H、Inl E可帮助Inl A入侵细胞[6]。Bergmann B等[7]发现LM缺失InlGHE基因簇或单个基因会导致对哺乳动物的人脑微血管内皮细胞(HBMEC)和其他非吞噬细胞的入侵作用增加2~4倍。Balandyté L[8]等研究发现Inl G主要存在于环境分离菌株中,很少存在于临床分离的人和动物源菌株中,表明Inl G对LM适应宿主外环境和生存息息相关。刘圆园[9]等证明Inl G具有较好的免疫原性。目前Inl G被证实与LM毒力有关,致病力方面研究较少。本研究利用同源重组构建了内化素G缺失株(LM-ΔInl G)[10],对其生长特性、对温度和酸碱的耐受性、对巨噬细胞的内化作用,并对LM和LM-ΔInl G进行转录组测序,为研究Inl G功能提供试验依据。
1 材料与方法
1.1 材料
1.1.1 试验材料 单增李斯特菌(ATCC19111),小鼠腹腔巨噬细胞(RAW 264.7),甘肃农业大学兽医公共卫生实验室存;大肠埃希氏菌DH5α,北京全式金生物技术有限公司产品;穿梭载体pKSV7,大连宝生物工程有限公司产品。
1.1.2 主要试剂 限制性核酸内切酶BamHⅠ、XbaⅠ、T4 DNA Ligase、PCR Mix,大连宝生物工程有限公司产品;脑心浸出液肉汤培养基(BHI)、溶菌酶、氯霉素、青霉素G和琼脂粉,北京索莱宝科技有限公司产品; DNA Marker,细菌基因组DNA提取试剂盒、RNA提取试剂盒、反转录试剂盒、Fast Fire qPCR PreMix(SYBR Green)(FP207),北京天根生化科技有限公司产品;胰蛋白酶消化液,苏州新赛美生物科技有限公司产品;RPMI 1640培养基,赛默飞世尔科技(中国)有限公司产品;其他试剂均使用分析纯。
1.1.3 主要仪器 BCM-1300洁净工作台(生物洁净型),苏州安泰空气技术有限公司产品;HH.B11-BS-Ⅱ电热恒温培养箱,上海跃进医疗器械有限公司产品;Mastercycler nexus GSX1梯度PCR仪,MiniSpin plus台式离心机,德国Eppendorf公司产品;MCO-17AI型CO2培养箱,日本三洋公司产品;BIO-RAD-2000凝胶成像仪,Gene Pulser Xcell电穿孔系统,美国Bio-Rad公司产品;Gene Quant 1300分光光度计,美国GE公司产品;Light Cycler 96实时荧光定量PCR仪,瑞士Roche公司产品。
1.2 试验方法
1.2.1 引物设计与合成 参照GenBank中已公布的InlG序列,设计同源臂引物,酶切位点(下划线)及保护性碱基(斜体)。旁外侧引物D-F和D-R用于PCR鉴定缺失株,Hly-F和Hly-R为LM的特异性鉴定引物。引物序列见表1。
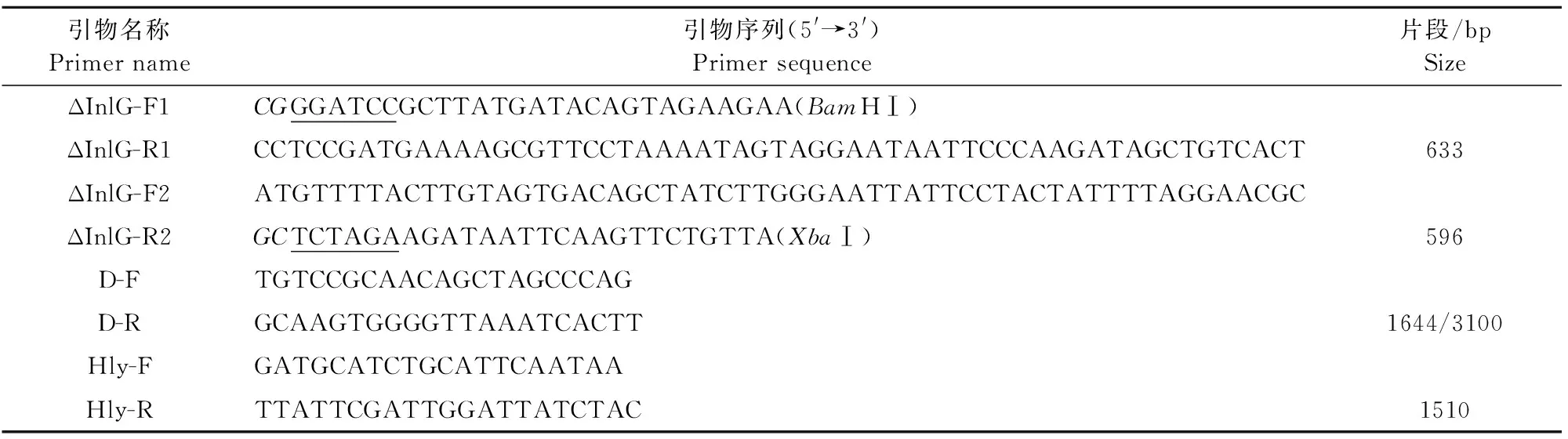
表1 引物序列Table 1 Primer sequences
1.2.2 LM基因组的提取 将实验室保存的LM接种于BHI固体培养基,37 ℃培养16~18 h,挑取单菌落于BHI液体培养基中37 ℃、180 r/min培养16~18 h,用1.5 mL离心管收集菌体,用细菌基因组DNA提取试剂盒提取LM全基因组,于-20 ℃保存备用。
1.2.3 LM感受态细胞的制备 挑取LM单菌落过夜培养,转接1 mL菌液到100 mL的0.5 mol/L蔗糖BHI液体培养基中培养4 h,加入25 μL 0.05 g/L青霉素G,继续培养使光吸收值(OD600)达0.5~0.6,冰上预冷30 min后4 ℃离心收集菌体;用含有0.5 mol/L蔗糖的HEPES液洗涤2次,第2次洗涤液体积减半;用5 mL HEPES溶液重悬,加入20 μL溶菌酶充分混匀,37 ℃水浴20 min;4 ℃离心用HEPES溶液洗涤1次收集菌体,用1 mL HEPES溶液重悬分装到1.5 mL离心管中保存于-80 ℃备用。
1.2.4 内化素G缺失株LM-ΔInl G的构建 以LM全基因组DNA为模板,分别以ΔInl G-F1、ΔInl G-R1为上游同源臂的引物,ΔInl G-F2、ΔInl G-R2为下游同源臂的引物扩增,利用重叠延伸PCR对ΔInl G的同源臂进行融合。测序正确后,将ΔInl G的同源臂与穿梭质粒pKSV7连接,形成重组质粒pKSV7-ΔInl G。将pKSV7-ΔInl G电击转化LM感受态细胞,并筛选阳性菌。在41 ℃和氯霉素存在下进行同源重组。重组完全后,pKSV7质粒在30 ℃和无氯霉素条件下丢失。通过PCR检测基因缺失株的遗传稳定性。
当带电粒子在没有初始速度在均匀电场中时,如果带正电荷,它将沿电场线以零初速度匀加速直线运动,如果粒子带负电荷,它将在与电场线相反的方向移动。当带电粒子的初始速度方向平行与电场线时,根据带电粒子的带电情况决定其做初速度不为零的匀加速还是匀减速直线运动,这取决于。当带电粒子的初速度方向与电场线成一定夹角θ时,将物体的初速度分解在电场线方向上或垂直于电场线方向上,并分步求解。
1.2.5 LM和LM-ΔInl G的生长情况
1.2.5.1 LM和LM-ΔInl G不同温度下生长曲线测定 把野生株LM和缺失株LM-ΔInl G分别划线于BHI固体培养基,37 ℃培养18~20 h,挑单菌落接种于3 mL BHI液体培养基培养16 h。调整菌液为同一浓度,将菌液1∶100转接至50 mL BHI液体培养基中,分别在30 ℃、37 ℃和41 ℃进行振荡培养,转速150 r/min,每隔2 h直至12 h取样200 μL于96孔平板,用分光光度计测定菌液OD600,各设置3个平行。
1.2.5.2 LM和LM-ΔInl G不同pH值条件下生长曲线测定 将培养菌液按照1∶100转接至50 mL BHI液体培养基中,分别在pH5、pH7和pH9进行振荡培养,每隔2 h于96孔板中取200 μL菌液,测定OD600,各设置3个平行。
1.2.6 Inl G对单增李斯特菌毒力的影响
1.2.6.1 细菌悬液的制备 挑取LM和LM-ΔInl G单个菌落,转接到5 mL BHI培养至对数生长期离心收集菌体,用无菌PBS洗涤3遍,用RPMI 1640细胞培养液调整OD600至0.12左右(约1×108CFU/mL),准备感染细胞。
1.2.6.2 细胞黏附和侵袭试验 将传代培养的RAW 264.7细胞经胰蛋白酶消化后移至12孔细胞培养板中,于37 ℃、5% CO2条件下培养至细胞铺满瓶壁,细胞密度为5×105/mL(感染复数比MOI=1∶100),弃去培养液,用无菌PBS漂洗3遍,加入细菌悬液在37 ℃、5% CO2条件下感染细胞2 h。用无菌PBS漂洗3遍,用0.5% Triton X-100裂解细胞,收集裂解液倍比稀释涂板计数。侵袭试验用以上相同方法感染细胞2 h,无菌PBS漂洗3遍后,每孔加500 μL 100 μg/mL庆大霉素细胞基础培养液作用1 h以杀灭细胞外细菌。无菌PBS漂洗3遍,用0.5% Triton X-100裂解细胞,收集裂解液做倍比稀释涂板计数。
1.2.7 LM和LM-ΔInl G的转录组测序
1.2.7.1 检测样品制备及测序 取1 mL LM和LM-ΔInl G过夜培养菌液扩大培养至OD600约为0.6,收集菌体用PBS洗涤3次,在-80 ℃保存,干冰运输。本试验转录组测序(RNA-Seq)及原始数据质控均委托北京诺禾致源科技公司完成,包括样品检测、RNA文库构建、富集,采用Illumina NovaSeq 6000进行高通量测序。
1.2.7.3 实时荧光定量PCR验证 随机选取10个差异表达基因进行qRT-PCR验证。用Primer 5.0软件设计引物(表2),由北京擎科生物科技有限公司合成。使用RNA提取试剂盒提取样品RNA,反转录成cDNA作为模板。使用Light Cycler 96实时荧光定量PCR仪上机扩增,每个样本设置3个重复,以16S rRNA为内参基因。根据2-ΔΔCt法计算每个基因的相对转录水平,用GraphPad Prism8统计软件作图。
2 结果
2.1 内化素G基因缺失株LM-ΔInlG的构建
扩增的InlG上下游同源臂分别为633 bp和596 bp,通过重叠延伸PCR将InlG的同源臂融合,得到1 229 bp的片段,命名为ΔInl G。pKSV7质粒经BamHⅠ和XbaⅠ双酶切后与ΔInl G连接,转化DH 5α感受态细胞。重组质粒pKSV7-ΔInl G电击转化LM感受态细胞,在41 ℃和氯霉素存在下进行同源重组。筛选阳性转化子并扩增出大小为1 229 bp的片段。在30 ℃、无抗生素的条件下,传至30代时穿梭质粒成功丢失,在传代第70代由2条带变成1条短带,大小1 644 bp,表明同源重组完全。重组菌株在37 ℃连续培养20代,获得1株稳定遗传的缺失株(图1)。

M.DNA标准DL 5 000;1~8.完全重组菌M.DNA Marker DL 5 000; 1-8.completely recombinant strain图1 内化素G缺失株的鉴定结果Fig.1 Identification results of Inl G gene deletion strains
2.2 LM和LM-ΔInl G的生长情况
2.2.1 LM和LM-ΔInl G不同温度条件下生长曲线测定结果 不同温度下生长曲线测定结果发现:30 ℃时两株菌生长缓慢,LM-ΔInl G的生长速度较高于LM,但生长趋势接近;在37 ℃和41 ℃生长较好;其中37 ℃时2株菌均生长情况最好,0~2 h为生长适应期,2~6 h生长对数期;6~8 h两株菌生长趋势较2~6 h相对缓和,8~12 h生长稳定期,LM和LM-ΔInl G生长趋势一致,表明InlG不参与温度调节,不影响LM生长。
2.2.2 LM和LM-ΔInl G不同pH值生长曲线测定结果 不同pH条件下生长曲线测定结果显示,相同pH时,LM和LM-ΔInl G的增长趋势相同;pH5时LM与LM-ΔInl G生长速度缓慢,pH9时生长速度较高于pH5;pH7时2株菌生长较好。表明InlG缺失后并不会影响细菌耐碱不耐酸的特性,2株菌均在pH7的条件下生长最好。
2.3 Inl G对单增李斯特菌毒力的影响
LM-ΔInl G比LM对RAW 264.7细胞黏附、侵袭均增强。LM-ΔInl G对细胞的黏附能力是LM的1.23倍(P<0.01),侵袭力是约1.98倍(P<0.01),且两者差异极显著。数据表明LM-ΔInl G缺失株增强了单增李斯特菌对细胞的内化作用。
2.4 转录组测序结果分析
2.4.1 差异表达基因的筛选 转录组测序结果表明在LM和LM-ΔInl G都表达的基因有2 742个,在LM中表达的基因有31个,而在LM-ΔInl G中表达的基因有21个。以|log2Fold Change|>1,P<0.05作为差异表达基因的筛选标准,得到LM-ΔInl G比LM有42个显著差异表达基因,其中18个基因表达上调,24个基因下调。Lmo1179、Lmo0447(Gad D1)、溶血素O、肌动蛋白聚集因子(ActA)、磷脂酰肌醇特异性卵磷脂酶(PlcB)、内化素C(InlC)、乙醇胺氨裂解酶大亚基和乙醇胺氨裂解酶小亚基等表达上调,其中以Lmo1179表达变化差异最大,该基因与氧化还原酶活性(oxidoreductase activity)和氧化还原过程(oxidation-reduction process)有关。下调基因中以Lmo1369表达变化差异最大,该基因调控磷酸转丁酰酶的活性,主要与转移酶活性,转移酰基基团(transferase activity,transferring acyl groups)相关。
2.4.2 差异表达基因的GO分类 将LM-ΔInl G的差异表达基因注释到GO数据库进行比对,共获得93个GO功能注释,分为生物过程、细胞组分和分子功能3个大类,包含45类生物学过程,19类细胞组分,29类分子功能。MF中氧化还原酶活性(oxidoreductase activity)和小分子结合(small molecule binding),裂解酶活性(lyase activity)是含有差异表达基因最多的3类,分别为6、6、5个。BP中氮化合物代谢过程(nitrogen compound metabolic process)含有最多的差异表达基因5个,羧酸的代谢过程(carboxylic acid metabolic process),酮酸的代谢过程(oxoacid metabolic process),有机酸的代谢过程(organic acid metabolic process)、氧化-还原过程(oxidation-reduction process)和小分子代谢过程(small molecule metabolic process)分别含有4个差异表达基因。在CC中,细胞(cell)和细胞部分(cell part)差异基因数目最多,各有3个。在所有GO功能分类中,前20个富集最明显的分类中CC占了11个,细胞组分是细胞解剖结构,不指代谢过程,说明差异表达基因产物在执行功能时所处的细胞结构位置多在核糖体。
2.4.3 差异表达基因的KEGG注释分析 将LM-ΔInl G的差异表达基因注释到KEGG pathway代谢通路,通过Pathway富集的显著程度进行排序,显著差异表达基因分别富集到群体感应(quorum sensing,QS)、丙酸代谢(propanoate metabolism),缬氨酸、亮氨酸和异亮氨酸降解(valine,leucine and isoleucine degradation)、甘油磷脂代谢(glycerophospholipid metabolism)和丁酸代谢(butanoate metabolism)等22个pathway代谢通路中,其中富集程度最为显著的是群体感应和丙酸代谢信号通路。
2.4.4 差异表达基因的实时荧光定量PCR验证 本研究随机选取5个上调基因和5个下调基因进行RT-qPCR验证(图2)。结果显示,10个差异表达基因的验证结果与DE Seq的结果趋势一致,只是差异倍数与转录组数据有所区别,说明该转录组测序结果的可信度较高。
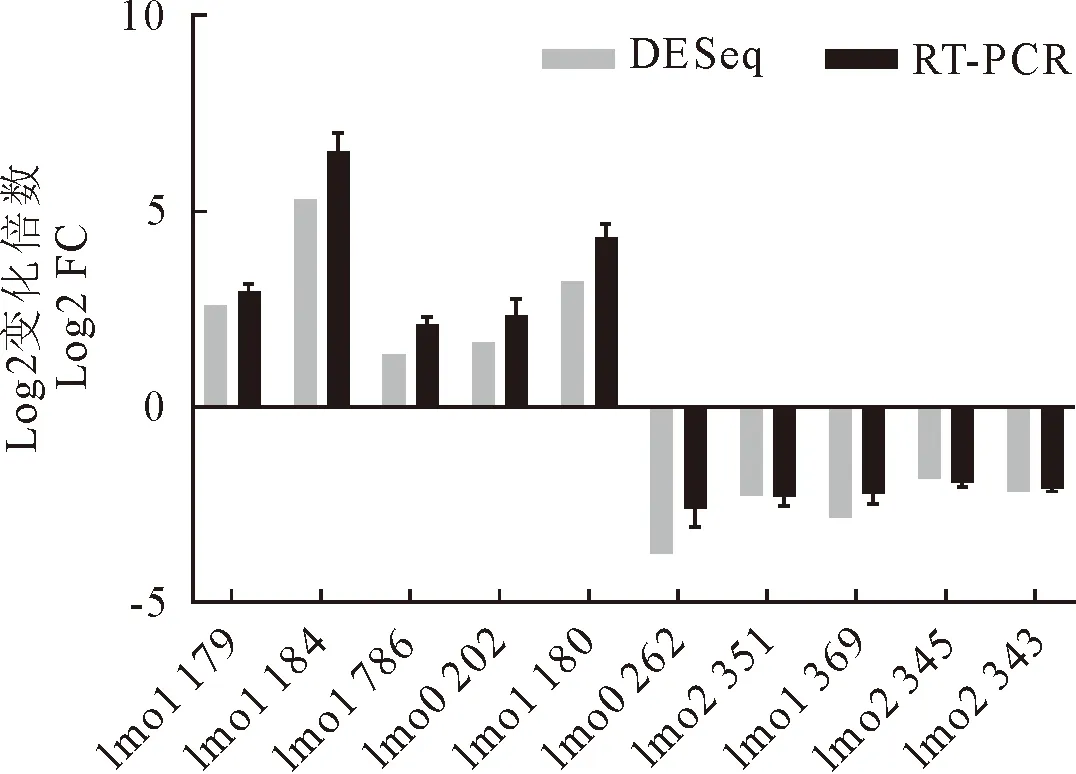
图2 差异表达基因的qRT-PCR验证分析Fig.2 Validation analysis of the differentially expressed genes by qRT-PCR
3 讨论
李斯特菌鉴定出4个毒力基因簇,被称为李斯特菌致病岛(Listeriapathogenicity island,LIPI),包括LIPI-1、LIPI-2、LIPI-3和LIPI-4。LIPI-1是LM在细胞内生存和传播所必需的[11],存在于所有LM菌株中,包括PrfA、ActA、Hly、Mpl、PlcA和PlcB共6个基因。LIPI-2称为内化素小岛,其家族是LM对宿主细胞黏附和侵袭所特有的蛋白[12]。一般情况下,内化素通常都是以基因簇的形式存在,是由内化素基因编码的N端具有富含亮氨酸重复序列(leucine-rich repeats,LRRs)一系列蛋白产物,LRRs存在于各种参与信号转导和细胞黏附过程的蛋白质[13]。本研究表明InlG基因缺失后并不会影响细菌耐碱不耐酸的特性。InlG基因不参与温度调节,对LM的生长特性影响很小。
本研究对LM与LM-ΔInl G进行转录组测序,获得大量的差异表达基因。GO功能注释分类显示,差异表达基因主要涉及分子功能(催化活性、分子结合等)、细胞组分(包括细胞部分、细胞、细胞器等)、生物过程(包括稳态调节、代谢调节等)3大类。对差异基因进行Pathway分析,进一步对差异表达基因参与的主要代谢途径进行研究,有利于明确差异表达基因在生物代谢周期中发挥的功能以及与其他基因的相互作用。KEGG富集分析表明,与LM相比,LM-ΔInlG中群体感应(QS)、丙酸代谢,缬氨酸、亮氨酸和异亮氨酸降解等3个通路显著富集。QS是微生物产生并识别与自身种群密度相关的信号分子,当信号分子浓度达到一定阈值,通过包括受体蛋白在内的信号分子传递系统调控某些特定基因表达,改变种群生理状态的一种现象[14]。QS可以调控生物发光、生物膜形成和毒力因子的表达。研究发现LM以AgrD信号分子为基础的QS系统主要参与生物膜形成、调节毒力因子表达,而以autoinducer-2(AI-2)信号分子为基础的QS系统研究尚处于初步阶段,发现其参与生物膜形成[15]。亮氨酸、缬氨酸和异亮氨酸是蛋白质中的3种常见氨基酸,统称支链氨基酸,研究表明缬氨酸、亮氨酸和异亮氨酸的降解以及细胞外基质与过表达的蛋白质受体的相互作用有关[16],可能影响蛋白质的合成,进而影响能量代谢。这些KEGG通路也存在于其他细菌和人体细胞中,提示丙酮酸可能控制通路中酶的活性或稳定性,影响能量代谢调节[17]。
LM在细胞内的感染与多种因素有关,包括其在细胞间的存活、增殖和扩散。转录组结果表明内化素G缺失后一部分基因表达上调,其中Hly、ActA、PlcB和InlC是LM的主要毒力因子,协同参与了细菌的黏附与侵袭。证明了内化素G缺失后LM对RAW 264.7细胞的内化作用增强。在LM细胞内感染周期中,细菌被胞吞进宿主细胞后被初级吞噬泡包裹,由Hly编码的LM 的溶血素O通过溶解吞噬泡和膜穿孔介导LM从吞噬小体中逃逸[18]。磷脂酰肌醇特异性磷脂酶(Plc A)和磷脂酰肌醇特异性卵磷脂酶(Plc B)可以通过抑制自噬前体的成熟或阻止自噬机制的目标识别使LM能够逃避宿主自噬,推动LM在细胞质内和细胞之间的移动,成功逃逸至细胞胞浆[19]。细菌逃逸至该环境后,可在其中存活和分裂,也可通过大量诱导表达Act A,Act A在细胞质中招募肌动蛋白有核复合体,介导肌动蛋白聚合形成彗星状尾巴提供动力,利于LM在宿主细胞间穿梭[20],形成次级吞噬泡进行新一轮感染。有研究报道,缺失PlcA和PlcB的缺失株在感染巨噬细胞的过程中容易触发细胞自噬,使菌体增殖减少[21],本试验缺失InlG后,PlcB表达量增加,可以怀疑在感染巨噬细胞的过程中抑制了细胞自噬,使菌体增殖增加。作为内化素家族的一员,Inl C是一种小型分泌蛋白,无LPXTG基序,含5个连续的富含亮氨酸的重复序列[22]。InI C可以通过与紧密连接复合体的调节因子的相互作用,来缓解宿主细胞的皮质张力,使脂膜更易变形而有利于细菌的转移,随后进入相邻的健康细胞[23]。Lmo0447(GadD1)构成谷氨酸脱羧酶耐酸系统的一部分[24],该系统有3种脱羧酶Gad D1、Gad D2和Gad D3和两种逆向转运因子Gad T1和Gad T2。有报道称GadD1与内化素InlGHE基因簇密切相关[25],LM-ΔInl G中GadD1表达上调,3个谷氨酸脱羧酶对LM抗酸应激能力的贡献为Gad D2>Gad D3>Gad D1[26],这也证明了缺失内化素G后单增李斯特菌的耐酸性并没有显著变化[27]。
本研究成功构建了内化素G缺失株LM-ΔInl G,进行了体外生长,对不同温度、不同pH值的应激,对小鼠腹腔巨噬细胞的黏附、侵袭及转录组测序试验。验证了Inl G与LM的毒力有关,内化素G不参与温度与酸碱的调节,内化素G缺失上调表达了LM的主要毒力因子,增强了对细胞的内化作用,下一步将通过分析Inl G的受体以及它是否与其他蛋白协同作用来探索Inl G的详细功能机制。

