冻融循环对海湾扇贝内收肌肌原纤维蛋白理化特性及凝胶特性的影响
洪思琦,任超,杜明,吴超,祁立波
(大连工业大学 食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116000)
海湾扇贝(Argopecten irradias)于1982 年被引进我国。从1984 年开始,海湾扇贝养殖业快速发展,规模巨大[1]。海湾扇贝,属瓣鳃纲,异内收肌目,扇贝科,扇贝属[2]。海湾扇贝内收肌是一种高蛋白、低脂肪的健康食品,因其味道和营养价值备受推崇。海湾扇贝内收肌的品质变化与其蛋白质的变性程度具有很强的相关性,其中肌原纤维蛋白的变性存在最显著的影响。肌原纤维蛋白主要包括肌球蛋白和肌动蛋白,是肌肉收缩最关键的蛋白质[3]。肌肉蛋白质的功能特性与蛋白质的结构完整性密切相关。影响肌肉蛋白质特定结构和功能的因素包括动物种类、肌肉新鲜度以及肌肉是否被冷冻或冻藏[4]。为了应对长途运输和延长水产品的保质期,冷冻是目前较好的方法之一,即使有不可避免的质量损失。然而在运输过程中不可避免的会发生冻融现象,特别是水产品在经过冻融后会导致汁液损失增加、质构劣变及风味降低。
冻藏过程中由于冰结晶的形成会使蛋白质发生变性,造成蛋白质溶解性降低,从而影响肌原纤维蛋白的功能特性。 以肌动球蛋白三磷酸腺苷酶为指标进行的研究表明,冻融会破坏斑节对虾肌原纤维蛋白的稳定性[5]。通过研究牛肌肉肌原纤维蛋白的变性效应,发现解冻导致肌肉组织的失水率升高,热稳定性降低[6]。反复冻融会导致虾的蛋白质变性、组织破坏和肌肉纤维损伤;随着冻融循环次数的增加,虾的硫代巴比妥酸增加,盐溶蛋白质含量减少,肌肉纤维间距增加,肌肉纤维被撕裂[7]。综上所述,反复冻融会引起肌原纤维蛋白变性从而引起肌肉产品的质量下降。
本试验以海湾扇贝内收肌为原料,模拟冻融循环、通过测定解冻后的理化指标(保水性、质构特性、肌原纤维蛋白含量、总巯基和活性巯基含量、表面疏水性),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)、内源荧光光谱、圆二色谱探索冻融循环次数对海湾扇贝内收肌品质及蛋白质特性的影响。同时以冻融扇贝内收肌为原料,通过斩拌、加热定型成扇贝凝胶,通过测定持水性、质构特性、凝胶强度、流变特性、低场核磁共振、冷场扫描电镜等探讨冻融循环次数对贝糜凝胶的持水性、水分分布、品质特性和微观结构的影响,以期为贝糜制品凝胶特性的研究提供参考。
1 材料与方法
1.1 材料与试剂
生鲜海湾扇贝内收肌:市售。
氯化钠:天津市石英钟厂霸州市化工分厂;β-巯基乙醇、8-奈基磺酸盐-1-苯胺基:上海阿拉丁生化科技股份有限公司;乙二醇双(2-氨基乙基醚)四乙酸、丙烯酰胺、溴酚蓝、尿素:上海生工生物工程股份有限公司;腺嘌呤核苷三磷酸、甘氨酸:北京索莱宝科技有限公司;蛋白电泳marker:美国伯乐公司;三羟甲基氨基甲烷、5,5'-二硫代双(2-硝基苯甲酸):上海麦克林生化科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
CF16R XⅡ高速冷冻离心机、S8020 场发射扫描电子显微镜、F-2700 荧光分光光度计:日本日立公司;Discovery HR-1 流变仪:美国TA 公司;SD-JR6800 绞肉机:佛山市顺德区三的电器制造有限公司;TA.XT.plus 质构仪:北京微讯超技仪器技术有限公司;MesoQ MR23-060H 核磁共振成像分析仪:上海纽迈电子科技有限公司;UV-2100B 紫外可见分光光度计:上海元析仪器有限公司;BIO-RAD-ChemiDoc Touch 化学发光成像分析系统、J-1500 圆二色光谱仪:日本分光株式会社。
1.3 方法
1.3.1 海湾扇贝内收肌样品处理及冻融循环设计
将新鲜海湾扇贝内收肌分别放于10 cm×7 cm 的封口袋中,密封。将封装好的扇贝内收肌肉置于超低温冰箱中,采用平板接触冻结,冻结至中心温度-40 ℃。然后将样品置于(-18±2)℃下冷冻保存。每隔48 h 取出冷冻的扇贝内收肌,在25 ℃恒温培养箱解冻40 min,待扇贝内收肌中心温度达到0~1 ℃,即为1 个冻融循环。随后依次完成2、4 次冷冻-解冻后备用。
1.3.2 海湾扇贝凝胶的制备
将新鲜和经过1、2、4 次冻融后的扇贝内收肌肉切碎后加入质量比1.5%的食盐斩拌10 min 成贝糜,使盐溶性蛋白充分溶出,将斩拌后的贝糜填装入25 mm×30 mm 的聚碳酸酯管中,保鲜膜包裹,采用水浴一段式直接加热的方式(90 ℃,10 min),加热后立即冷却,充分冷却后放入4 ℃冰箱冷藏过夜,用于进一步检测。
1.3.3 海湾扇贝肌原纤维蛋白制备
参照Nishio 等[8]的方法并稍作修改,挑选大小和形状接近一致的扇贝内收肌。将3 个扇贝内收肌用绞肉机绞碎后取贝肉5 g,然后加入30 倍体积冷却的5 mmol/L 的磷酸盐缓冲液[含40 mmol/L NaCl,1 mmol/L巯基乙醇和0.1 mmol/L 乙二醇双(2-氨基乙基醚)四乙酸],在匀浆机中10 000 r/min 匀浆1 min,匀浆液在10 000 r/min 条件下离心5 min,沉淀用相同的溶液再溶解,冲洗离心2 次,冲洗后的沉淀与20 倍体积的冷却的5 mmol/L 的磷酸缓冲液[含0.6 mol/L 氯化钠和5 mmol/L 腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)]混合形成蛋白悬浊液,通过加入0.5 mol/L 磷酸氢二钠使其维持在pH7.0,在4 ℃条件下搅拌75 min 后,将悬浊液在10 000 r/min 条件下离心20 min,取上清液为肌原纤维蛋白,通过双缩脲法测定肌原纤维蛋白含量。1.3.4 贝糜凝胶品质测定
1.3.4.1 贝糜凝胶持水性测定
将待测样品切成约2 mm 厚的薄片。称取质量为W1(2.0~3.0 g)的样品平摊在3 张滤纸上包裹好放入离心管中,在8 000 r/min、4 ℃温度下离心10 min,离心结束后取出称量为W2(g),每组样品重复测量4 次取平均值,按下列公式计算持水率(C,%)。
1.3.4.2 贝糜凝胶质构特性测定
采用质构仪测定海湾扇贝肉质构特性,注意下压方向应与肌肉纤维的走向垂直。参数设定为测试探头P/50、压缩形变50%、测试前速度1.0 mm/s、测试速度和测试后速度均为2.0 mm/s。硬度指标一般用下压过程中的最大感应力表征。每个样品做8 次平行。
1.3.4.3 贝糜凝胶水分分布测定
用核磁共振分析成像分析仪测定横向弛豫时间(T2),其磁场强度为0.5 T,对应的质子共振频率为21 MHz。将扇贝凝胶放入直径60 mm 的核磁管中,插入核磁共振探针。脉冲序列(carr-purcell-meiom-gill,CPMG),90°和180°脉冲分别为21.00、42.00 μs,π 值为100 μs,回声数为4 500,重复扫描3 次。
1.3.4.4 流变特性测定
使用流变仪测定未经冻融以及冻融后的扇贝凝胶,每个样品做3 次平行。参数设定为固定温度25 ℃、间隙1 mm、应变0.5%、频率0.1~10 Hz,测试样品得到样品的储存模量G′随着温度的变化曲线。
1.3.4.5 凝胶强度测定
将热凝胶扇贝切为高度25 mm 左右的圆内收肌体,采用质构仪测定海湾扇贝肉凝胶特性,每个样品至少8 个平行。参数设定为测试探头P/5S、测试速度1.0 mm/s、测前速度和测后速度10.0 mm/s、压缩形变50%。记录破裂力(Y,g)和破裂距离(Z,mm),凝胶强度(X,g·mm)计算公式如下。
1.3.4.6 微观结构
用低温扫描电子显微镜观察贝糜凝胶样品的微观结构。将待测样品切成3 mm 厚,使用扫描电子显微镜放大1 000 倍扫描微观结构。
1.3.5 肌原纤维蛋白理化特性的测定
1.3.5.1 肌原纤维蛋白含量的测定
将肌原纤维蛋白上清液用0.6 mol/L NaCl 稀释25 倍。移取1 mL 上清液,双缩脲法测定肌原纤维蛋白含量,每个样品重复3 次。
1.3.5.2 肌原纤维蛋白电泳分析
SDS-PAGE 方法参考Kim 等[9]的方法并稍作修改。将肌原纤维蛋白上清液用0.6 mol/L NaCl 稀释到2 mg/mL,并向其中添加质量分数1%溴酚蓝(bromophenol blue,BPB)指示剂,然后进行非还原电泳;加β-巯基乙醇沸水浴5 min,进行还原电泳。分离凝胶和堆积凝胶分别包含12.5%和3%的丙烯酰胺,8 μL 样品加入到凝胶中,以恒定12 mA 的电流进行电泳。使用的蛋白电泳marker 的分子量为10~250 kDa。电泳结束后,凝胶用考马斯亮蓝G-250 染色,并用蒸馏水脱色。使用Bio-Rad 图像分析系统检测蛋白质条带。
1.3.5.3 总巯基和活性巯基的测定
肌原纤维蛋白溶液用0.6 mol/L NaCl 溶液稀释到2 mg/mL,取1 mL 加入8 mL 三羟甲基氨基甲烷(trimethylolaminomethane,Tris)-甘氨酸(含8 mol/L 尿素,4 mol/L 乙二胺四乙酸,pH8.0)。取4.5 mL 混合溶液,加入0.5 mL、10 mmol/L 5,5'-二硫代双(2-硝基苯甲酸)[5,5'-dithiobis-(2-nitrobenzoic acid),DTNB)] 溶液,室温反应30 min。以0.6 mol/L NaCl 溶液作为空白样品,测定412 nm 处吸光度。测量活性巯基含量时去掉反应混合液中尿素,其余步骤均同前。每个样品均做3 次平行。按下列公式计算总巯基和活性巯基的含量。
式中:Q 为巯基含量,10-5mol/mg;A 为待测样品吸光度减去空白样品吸光度;N 为稀释因子;C 为蛋白浓度,mg/mL。
1.3.5.4 表面疏水性的测定
采用1-苯胺基-8-奈基磺酸盐(1-anilino-8-napthalene sulfonic acid,ANS)作为荧光探针。将肌原纤维蛋白溶液用0.6 mol/L NaCl 稀释成0.2、0.4、0.6、0.8、1.0 mg/mL 系列蛋白浓度的溶液。温度平衡后,取4 mL稀释的蛋白溶液加入50 μL 8 mmol/L 的ANS 溶液,振荡混匀后在暗处放置15 min 后进行测试;每个样品做3 次平行。参数设置:激发波长和发射波长分别为300、500 nm,采用5 nm 作为荧光激发和发射的狭缝宽度。以荧光强度为纵坐标、蛋白质浓度为横坐标,该曲线初始阶段的斜率作为肌原纤维蛋白的表面疏水性指数。
1.3.5.5 内源荧光测定
将肌原纤维蛋白溶液用0.6 mol/L NaCl 稀释到1 mg/mL,用荧光分光光度计检测荧光光谱。参数设置:激发波长290 nm,激发和发射狭缝宽度均为5 nm,波长扫描范围300~500 nm。每个样品做3 次平行。
1.3.5.6 圆二色谱的测定
肌原纤维蛋白溶液用0.6 mol/L NaCl 溶液稀释到0.2 mg/mL,以0.6 mol/L NaCl 溶液作为空白进行扫描。参数设定:扫描波长范围190~250 nm,扫描速率为50 nm/min,谱带宽度为1.0 nm,试验值为3 次扫描的平均值。
1.4 数据处理
每组试验均重复进行3 次,采用Origin 8.0、SPSS 22.0 对各试验数据进行处理与分析。
2 结果与分析
2.1 肌原纤维蛋白理化特性在冻融过程中的变化
2.1.1 冻融循环次数对肌原纤维蛋白含量和蛋白质组成的影响
冻融循环次数对肌原纤维蛋白含量和蛋白质组成的影响如图1 所示。
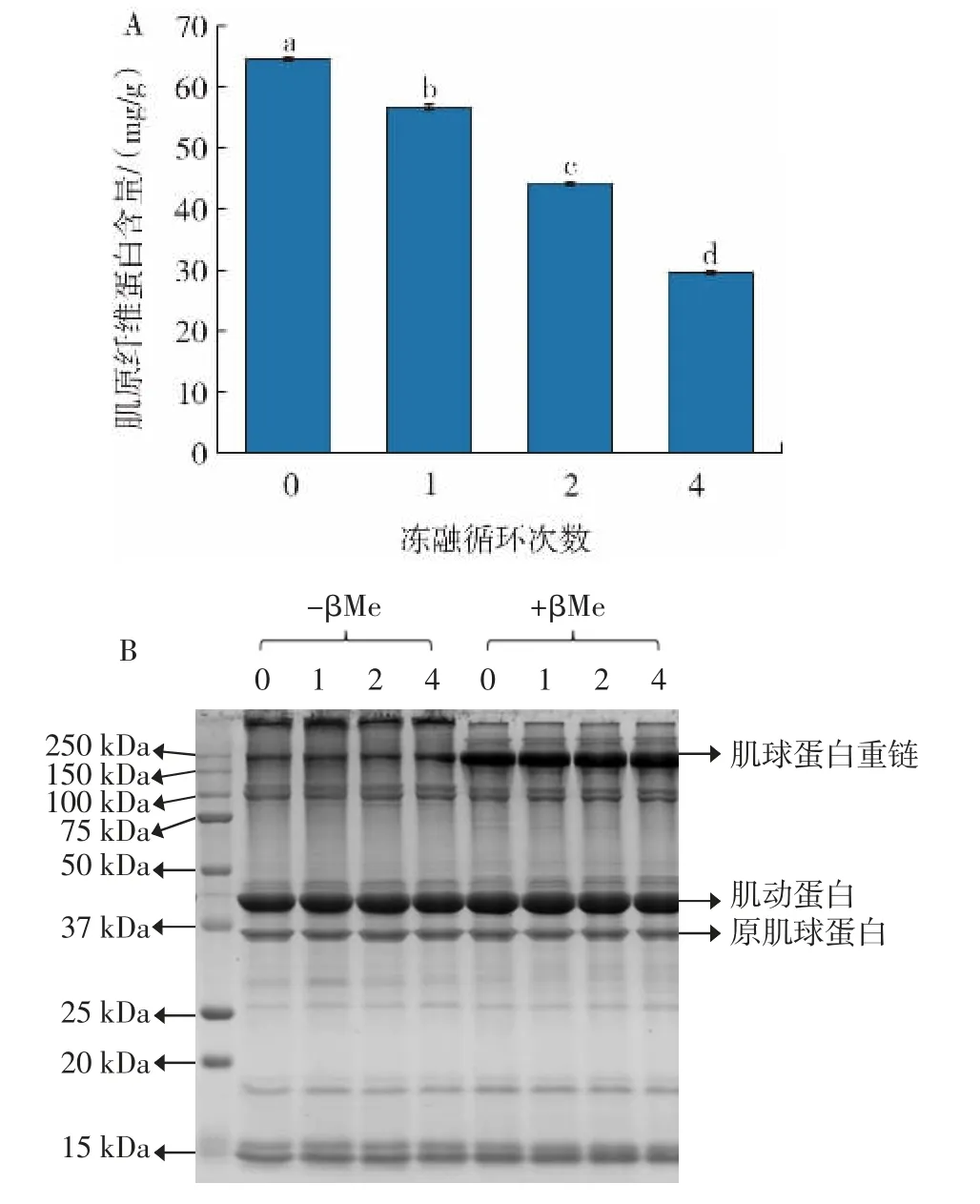
图1 冻融循环次数对肌原纤维蛋白含量和蛋白质组成的影响Fig.1 Effect of freeze-thaw cycles on myofibrillar protein content and protein composition
图1A 可知,经过冻融循环试验,随着冻融循环次数增加,扇贝内收肌中肌原纤维蛋白含量显著减少(P<0.05)。新鲜扇贝内收肌肌原纤维蛋白含量为64.50 mg/g,在经过4 次冻融循环后,其肌原纤维蛋白含量为29.60 mg/g,下降了54.1%(P<0.05)。引起肌原纤维蛋白含量下降的原因可能是反复冻融使蛋白质的部分结合水形成冰晶析出,导致肌球蛋白分子之间形成非共价键,进而形成不溶性高分子凝聚体而使肌动球蛋白溶出量下降。此外,巯基氧化形成的二硫键会导致蛋白质聚集,从而降低其溶解性。Sriket 等[10]发现冻融5 次后黑虾、白虾的蛋白溶解度显著降低(P<0.05),虾肉蛋白质的溶解度会随着反复冻融次数的增加而降低。
由图1B 可知,通过SDS-PAGE 测定冻融后的肌原纤维蛋白,结果表明在还原和非还原条件下,肌球蛋白重链(245 kDa)、肌动蛋白(43 kDa)、原肌球蛋白(36 kDa)等肌原纤维蛋白重要组成部分的电泳条带之间并未观察到明显差异。而在所有未还原样品中的堆积凝胶上发现了高分子量聚合物。这是因为,在冻融过程中巯基基团间相互作用生成二硫键有利于维持蛋白质结构的稳定性,在添加还原剂β-巯基乙醇后,可将二硫键拆分为自由巯基[11]。因此未被还原样品中的堆积凝胶上发现高分子量聚合物,而还原样品中未发现。
2.1.2 冻融循环次数对巯基含量和表面疏水性的影响
冻融循环次数对巯基含量和表面疏水性的影响如图2 所示。
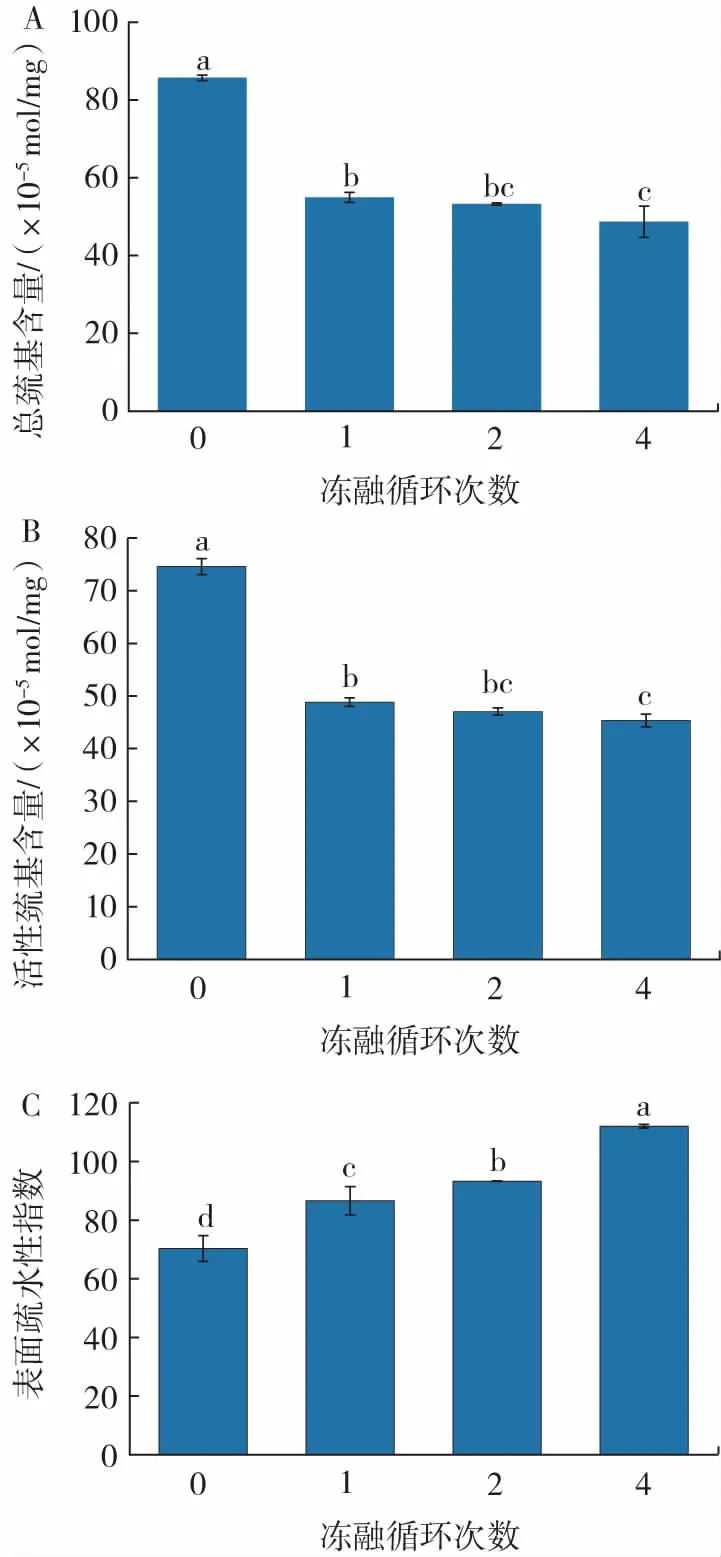
图2 冻融循环对巯基含量和表面疏水性的影响Fig.2 Effect of freeze-thaw cycles on sulfhydryl content and surface hydrophobicity
由图2A 和2B 可知,巯基是肌肉蛋白质中最敏感的官能团,巯基容易被氧化成共价二硫键(—S—S—),导致蛋白质的交联[12]。因此,巯基含量的变化可以反映肌原纤维蛋白的构象变化。随着冻融循环次数增加,肌原纤维蛋白样品的总巯基和活性巯基含量均明显降低;在经过4 次冻融处理后,样品的总巯基含量和活性巯基含量分别降低到初始值的62.7%和58.3%。总巯基和活性巯基含量减少的原因主要是多肽内部或多肽之间形成二硫键,或者巯基氧化为二硫化物和其他氧化物[13]。而活性巯基的还原可以归因于巯基的交联反应,或者暴露的巯基与氧自由基发生反应。在冻藏过程中,鲢鱼肌球蛋白中总巯基含量也出现降低的结果[14]。冷藏过程中由于半胱氨酸上的硫醇基团氧化形成二硫键,导致花鲈鱼的肌原纤维蛋白巯基含量也出现下降的趋势[15]。
蛋白质的表面疏水性反映的是蛋白质分子表面疏水性残基的相对含量,其变化说明蛋白质的表面性质发生改变,故可作为蛋白质结构改变的表征指标[16]。由图2C 可知,经过冻融循环试验,随着冻融循环次数的增加,表面疏水性出现显著增大的趋势(P<0.05)。经过4 次冻融循环后,扇贝肌原纤维蛋白的疏水性相对新鲜样品增加了48.7%。蛋白质的疏水性基团具有较低的表面疏水性,其位于蛋白质分子内部。扇贝内收肌经过冻融处理后会导致肌原纤维蛋白质构象的显著变化,进一步引起疏水氨基酸残基的暴露,这些疏水基团通过疏水相互作用聚集在一起。故随着冻融循环次数的增加,肌原纤维蛋白表面疏水性的含量不断增加。其他肌肉蛋白经冻融后也出现相同的结果。鳕鱼肌肉蛋白在经过3 次冻融循环后表面疏水性增加[17]。在-20 ℃下冷冻储存6~8 周期间,螃蟹肌肉蛋白的疏水性增加,可能与肌球蛋白头部区域的变性有关[18]。蛋白质变性主要是通过疏水相互作用导致暴露的残基聚集,从而最终降低表面疏水性。冰晶引起肌原纤维蛋白空间结构的变化,使得巯基基团、疏水基团暴露。这一结果与总巯基和活性巯基含量的下降是一致的。
2.1.3 冻融循环次数对肌原纤维蛋白质二级和三级结构的影响
冻融循环次数对肌原纤维蛋白二、三级结构的影响如图3 所示。
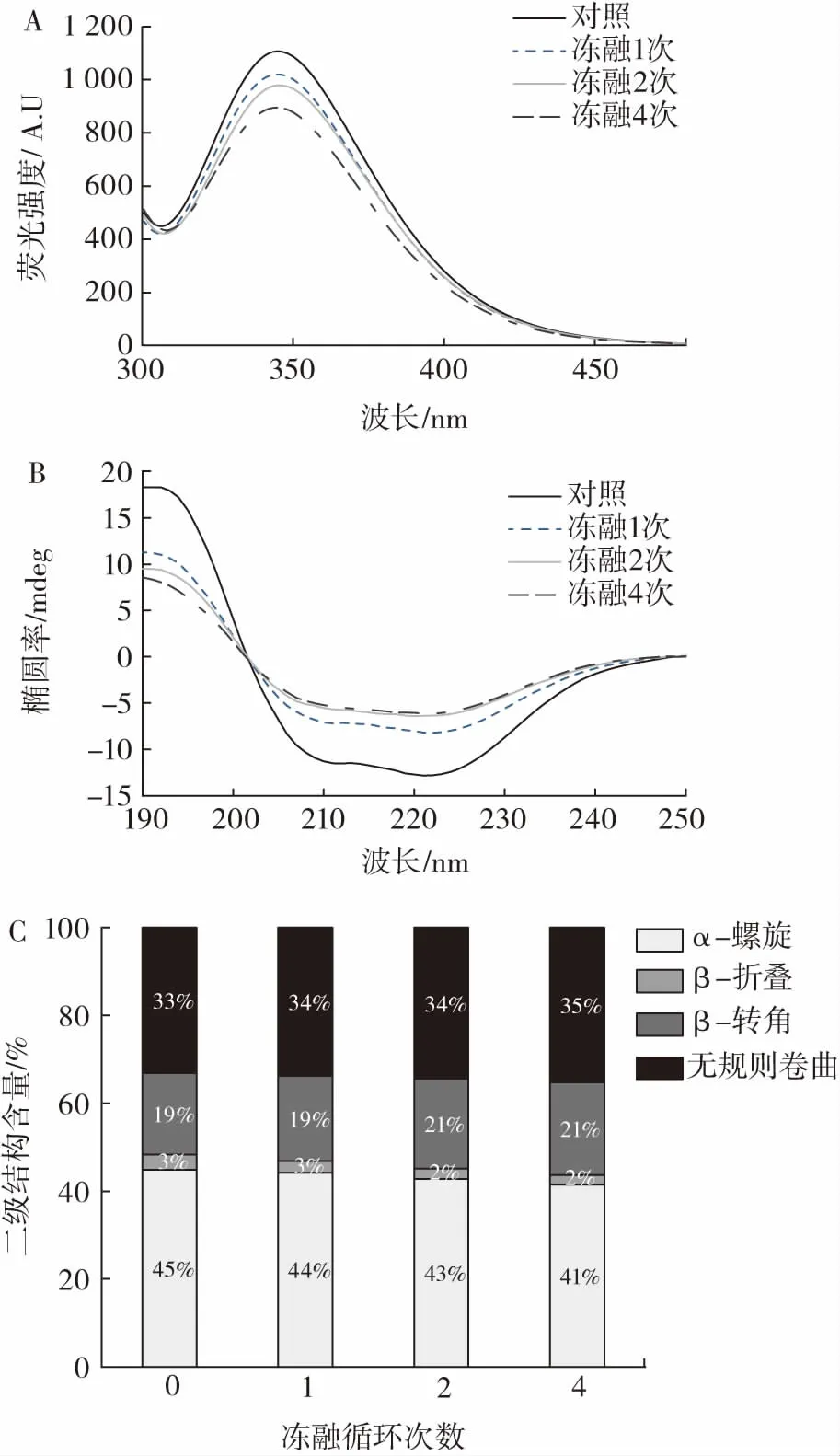
图3 冻融循环次数对肌原纤维蛋白二、三级结构的影响Fig.3 Effect of freeze-thaw cycles on secondary and tertiary structures of myofibrillar protein
蛋白质的三级结构主要由色氨酸(Trp)的荧光光谱信息来表达,色氨酸残基位于肌原纤维蛋白的核心,具有较高的荧光强度,经冷冻等处理后,荧光强度会发生变化[19]。由图3A 可知,与对照组相比,冻融样品的色氨酸荧光强度明显降低,随着冻融循环次数增加,荧光强度逐渐减弱。冻融循环的处理导致蛋白质三级结构展开,埋藏在蛋白质核心的色氨酸残基暴露在溶剂(亲水环境)中而产生猝灭作用,从而降低荧光强度。此外,肌原纤维蛋白的荧光强度下降也可能是由于肌原纤维蛋白的聚集和疏水相互作用的增加所引起的空间位阻的增加。镜鲤鱼也出现同样的结果,冻融处理也会导致镜鲤鱼蛋白凝胶的荧光强度降低,蛋白质三级结构被破坏[20]。
肌原纤维蛋白二级结构的稳定性可以用圆二色谱(circular dichroism,CD)远紫外光谱来描述,它包括α-螺旋、β-折叠、β-转角和无规则卷曲[21]。由图3B 可知,未经冻融样品的远紫外光谱波长在210 nm 和220 nm左右有典型的负峰,代表了经典的α-螺旋结构,随着冻融次数增加,负峰出现明显的衰减,峰值强度的降低意味着其结构含量的减少。由图3C 可知,随着冻融次数的增加,肌原纤维蛋白的α-螺旋和β-折叠百分比逐渐减少,β-转角、无规则卷曲百分比逐渐增加。冻融循环可引起猪最长肌肌原纤维蛋白的蛋白质聚集和降解、α-螺旋结构破坏[22]。α-螺旋结构的含量主要与多肽链上的羰基氧(—CO)和氨基氢(—NH—)之间的氢键稳定性有关。在冻融过程中,可能由于水与蛋白质结合状态的变化,导致氢键的破坏和氨基酸间静电相互作用的减弱,使得稳定性减弱[16]。蛋白质的不可逆变性将会导致α-螺旋构象含量的减少或是导致β-折叠和无规卷曲含量的增加。
2.2 在冻融循环过程中扇贝内收肌凝胶品质的变化
2.2.1 冻融循环次数对贝糜凝胶持水性和水分分布的影响
冻融循环次数对贝糜凝胶持水性和水分分布的影响如图4 所示。
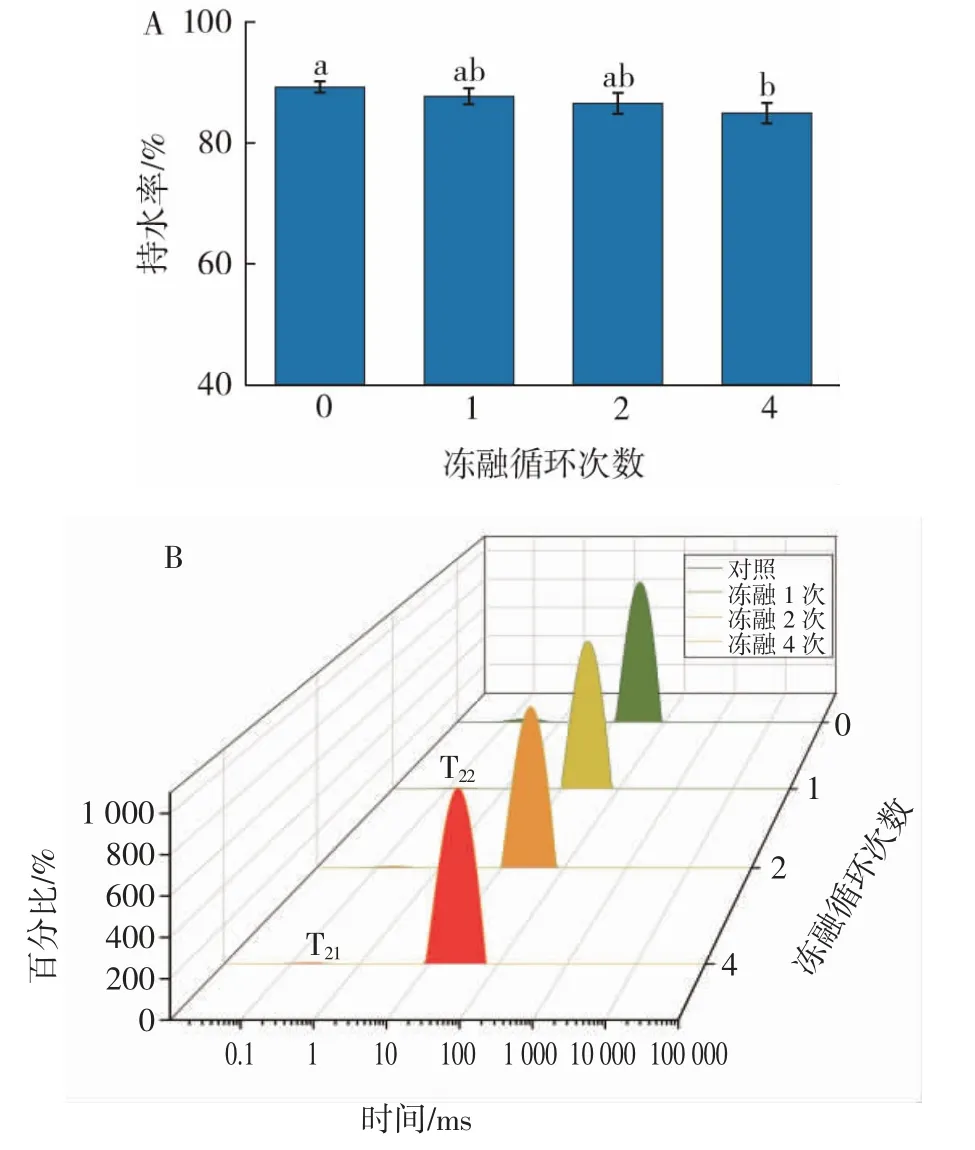
图4 冻融循环次数对贝糜凝胶持水性和水分分布的影响Fig.4 Effect of freeze-thaw cycles on water-holding capacity and water distribution of shellfish gel
持水率是蛋白质凝胶通过蛋白质-水相互作用在凝胶网络中保持水分的一种重要能力。由图4A 可知,随着冻融循环次数增加,贝糜凝胶持水率降低;未经冻融的扇贝糜凝胶的持水率为88.6%,经4 次冻融循环后下降至83.2%。泰国鱼糜凝胶在冷冻储存4 个月后持水能力急剧下降[23]。持水力下降的原因可能是在冻融过程中,冻结生成的冰晶造成蛋白的结构损伤与变性,加热形成的凝胶网络结构被破坏,失去了限制水的流动能力,而滞留在凝胶中的水缺乏流动性,不易挤出[24]。
用低频核磁共振技术检测扇贝凝胶中水分分布的变化。每个样品的两个峰表示了不同凝胶体系中的质子弛豫时间曲线[25]。如图4B 所示,与蛋白质大分子紧密结合的水被定义为T21(结合水),被困在凝胶结构中的水被定义为T22(固定水)。与对照组相比,在1、2、4 次冻融循环下,T22对应的峰面积减少。弛豫时间T22对应的峰面积代表了位于凝胶网络结构中的主要固定水的含量。结果表明,随着冻融循环次数的增加,凝胶中结合水含量减少,新鲜样品较紧密的凝胶结构比冻融循环样品具有更多的水分。水分转移和损失的原因可能是在冷冻和解冻过程中,冰晶重新分布造成蛋白质机械损伤和变性[26]。总的来说,由于肌原纤维蛋白在冻融循环过程中发生变性,使扇贝凝胶结构变得疏松,而凝胶结构的变化导致其持水能力下降。
2.2.2 冻融循环次数对贝糜凝胶品质特性的影响
冻融循环次数对贝糜凝胶品质特性的影响如图5所示。
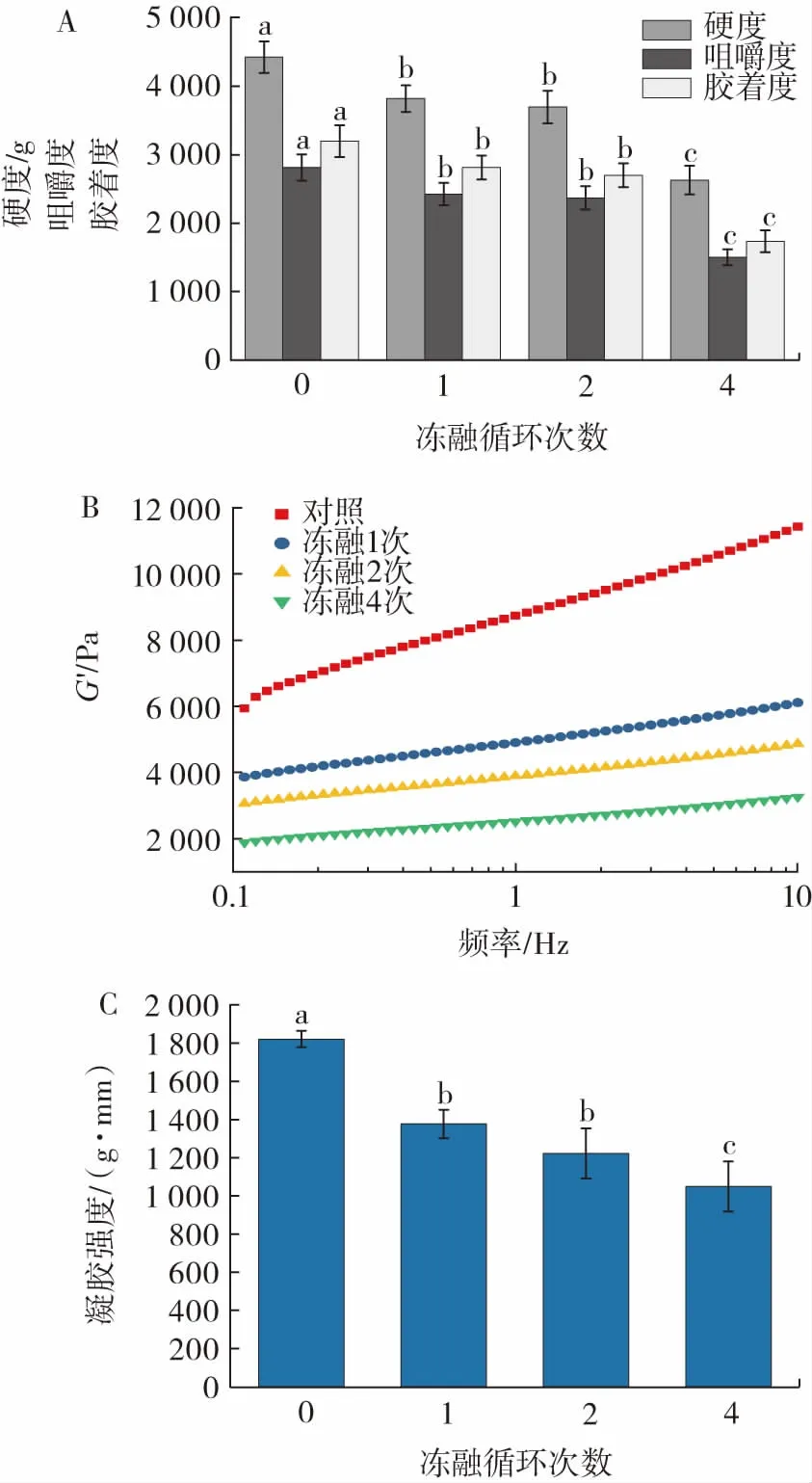
图5 冻融循环次数对贝糜凝胶品质特性的影响Fig.5 Effect of freeze-thaw cycles on quality characteristics of shellfish gel
由图5A 可知,所有的质构参数(硬度、咀嚼度和胶着度)随着冻融循环次数的增加而下降(P<0.05),凝胶硬度从4 424 g(新鲜)降至2 630 g(4 个冻融循环),降幅为41%。凝胶硬度是蛋白质凝胶最重要的功能特性之一。当扇贝内收肌样品反复冷冻和解冻时,所形成凝胶的咀嚼度和胶着度也表现出劣化(P<0.05),变化趋势与硬度相似;经过4 次冻融处理后,凝胶咀嚼度降低53.4%,胶着度降低。扇贝凝胶的咀嚼度和胶着度较差,说明扇贝凝胶更脆或更不富有弹性。在冻融的过程中扇贝内收肌的肌原纤维蛋白结构发生改变,从而在加热时形成的凝胶网络结构较弱,随着冻融次数的增加,表现出贝糜凝胶的质构特性发生劣变。质构特性的变化结果与动态流变学测量结果一致,动态流变学测量中,储能模量(G′)随着冻融循环次数的增加而逐渐下降(图5B)。
流变特性反映了贝糜凝胶质量。特别是,储能模量G′是对剪切过程中储存在样品中的变形能的测量,它代表了样品的弹性行为。由图5B 可知,在0.1~100 Hz恒定扫描频率的条件下,未经冻融样品的储能模量达到最大值,经过1 次、2 次和4 次冻融后,贝糜凝胶的G′急剧下降,说明冻融导致贝糜凝胶的弹性降低。可能是因为冻融循环导致蛋白质结构变化、蛋白质变性或者蛋白质过度聚集和不溶解[4]。
由图5C 可知,贝糜凝胶随着冻融循环次数增加,扇贝凝胶强度显著下降(P<0.05),对照组的凝胶强度为1 776.9(g·mm),经过4 次冻融循环后,凝胶强度为1 176.7(g·mm),下降了33.8%,数据表明扇贝凝胶强度的降低与冻融循环次数的增加呈正相关。冻融循环导致凝胶强度降低的原因之一是凝胶网络结构的断裂。在冷冻和解冻过程中,由于冰晶生长或重结晶可能导致肉类蛋白被氧化,破坏了蛋白质的结构,降低了蛋白质的凝胶形成能力[27]。蛋白质在冻藏过程中的变性会直接影响真鲷鱼鱼糜的成胶能力和凝胶强度[28]。说明冻融导致贝糜凝胶的凝胶强度降低的主要原因是蛋白质在冻融过程中的冷冻变性。
2.2.3 冻融循环次数对贝糜凝胶微观结构的影响
冻融循环次数对贝糜凝胶微观结构的影响如图6所示。
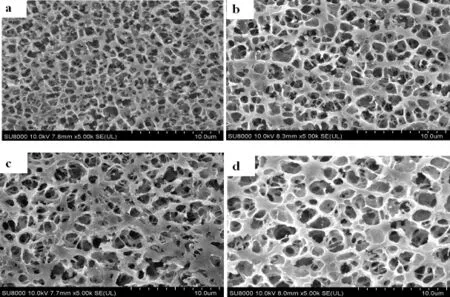
图6 冻融循环次数对贝糜凝胶微观结构的影响Fig.6 Effect of freeze-thaw cycles on microstructure of shellfish gel
由图6 可知,贝糜凝胶微观结构的显微照片显示了冻融处理的显著效果:新鲜的扇贝凝胶呈现出致密、均匀的精细网络结构;与未冻融相比,冻融1 次凝胶网状结构疏松、不均匀,蛋白质束发生断裂;冻融2次和冻融4 次凝胶网状结构更疏松、均匀度差,凝胶三维网状结构破坏严重,反复冻融后凝胶微观结构发生了明显的变化。猪肉冷冻后超微结构也发生了变化,冷冻扫描电子显微镜下发现冷冻肉类样品的空洞面积大约是新鲜样品的10 倍,很难在松散的肌肉组织中保留游离水分[29]。
优质蛋白质会形成具有较高弹性和质构良好的凝胶。蛋白质形成凝胶是由于蛋白质分子间通过共价键或非共价键(包括二硫键、疏水键)发生适度变性,但冻融过程破坏了蛋白质分子的结构,使蛋白质的凝胶形成能力下降[30]。冻融过程产生了空隙,并将聚集体凝胶结构变为粗链网络;反复冻融处理的扇贝内收肌导致凝胶网络结构的崩溃,显示出大的、不规则的裂缝。这些结构特征出现的原因可能是冻融处理的扇贝所制备的凝胶具有如上所述的水分分布和质构特性。
3 结论
本研究解析了冻融循环对扇贝内收肌肌原纤维蛋白理化特性、结构特性以及凝胶特性的影响。研究结果表明,随着冻融循环次数增加,扇贝内收肌肌原纤维蛋白含量、总巯基、活性巯基含量降低;肌原纤维蛋白分子的二、三级结构发生变化,其中α-螺旋结构逐渐解旋,部分转化为β-折叠和无规卷曲结构,色氨酸、酪氨酸等疏水性残基逐渐暴露于蛋白质表面形成疏水区域,提高了肌原纤维蛋白分子间和分子内的疏水相互作用。这些理化特性的改变,导致了扇贝内收肌凝胶性降低。本研究为海湾扇贝的进一步研究提供理论依据。

