VEGF、HIF-1α与上皮性卵巢癌血管生成及生物学行为的关系
王 稳 马军霞 崔秀娟 田翔宇
(1.滕州市中心人民医院妇产科,山东 枣庄,277599;2.滕州市中心人民医院计生办,山东 枣庄,277599;3.滕州市中心人民医院医学影像中心,山东 枣庄,277599)
由于缺乏有效的早期筛查手段,上皮性卵巢癌(Epithelial Ovarian Cancer,EOC)大多在处于广泛盆腹腔转移的晚期被发现,因早期无特异性临床表现,病死率在所有女性生殖系统恶性肿瘤中位居第一。越来越多的研究表明,在EOC的发生、发展和浸润转移过程中,血管生成发挥着极其重要的作用。血管内皮生长因子( Vascular Endothelial Growth Factor,VEGF)是由单一基因编码的同源二聚体糖蛋白,具有促进血管通透性增加等作用,是目前发现促血管生成作用最强的血管生成因子[1]。
肿瘤血管生成涉及血管内皮细胞(Endothelial cell,EC)、细胞外基质(Extracellular matrix,ECM)以及肿瘤细胞等之间的相互作用,过程尤为复杂,其中调节VEGF的重要因素包括:缺氧诱导因子(Hypoxia inducing factor 1,2,HIF-1,HIF-2)、环氧化酶(Cyclo-oxygenase,COX)以及促性腺激素等[2-5]。最新的分子生物学研究表明,在肿瘤免疫逃逸过程中,VEGF和HIF-1/2等血管生成相关因子发挥了决定性作用[6]。EOC恶性程度高,早期难以发现,本文研究者进行该试验,拟分析VEGF、HIF-1α以及MVD在上皮性卵巢癌中的表达及其与预后的关系,应用免疫组织化学方法,评估相关指标在血管形成中发挥的作用,分析其与上皮性卵巢癌临床指标间的关系。
1 材料与方法
1.1 研究材料
收集2012年1月—2017年12月滕州市中心人民医院收治的46例EOC患者的临床资料,以及同期因子宫肌瘤等良性疾病切除卵巢的39例患者的正常卵巢组织。所有EOC标本均经滕州市中心人民医院经验丰富的病理学专家进行病理分析证实,并根据世界卫生组织(World Health Organization,WHO)对组织学类型和分级进行评估[7]。本研究已被滕州市中心人民医院医学伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 纳入与排除标准
纳入标准:①EOC组织学亚型为浆液性、粘液性、透明细胞癌和子宫内膜样癌;②所有EOC患者在初次手术前均未进行新辅助化疗或放疗;③滕州市中心人民医院规范治疗,病理科保存石蜡标本;④随访5年以上。
排除标准:①转移性卵巢肿瘤;②外院手术治疗;③术前接受放化疗。临床病理特征包括年龄、分期、组织学分级和淋巴结转移。
1.3 研究方法
按照说明书提供的方案进行免疫组化染色,先经室温脱蜡、水化处理,再用Tris-EDTA缓冲液(pH=9.0)进行抗原修复,封闭采用含5%山羊血清TBS,室温孵育1.5 h,经二抗孵育、显色、复染、脱水、封片,最后进行图像采集。测定 VEGF和HIF-1α在EOC和正常卵巢组织中的表达情况,利用CD34对新生血管的微血管密度(MVD)进行评估,评估相关指标在血管形成中发挥的作用,分析其与EOC临床指标间的关系。VEGF抗体(VEGFA Polyclonal antibody,生产企业:武汉Proteintech生物技术有限公司,型号:19003-1-AP)、HIF-1α抗体(HIF-1 alpha Polyclonal antibody,生产企业:武汉Proteintech生物技术有限公司,型号:20960-1-AP)和CD34抗体(CD34 Polyclonal antibody,生产企业:武汉Proteintech生物技术有限公司,型号:14486-1-AP)。临床预后的测量指标为中生存期(Overall Survival,OS),指术后第1天至死亡的时间,未出现事件的为截尾数据。
1.4 结果判定
(1)组织化学评分(Histochemistry Score,H-Score):H-Score是一种半定量处理免疫组织化学结果的方法,同时考虑特异性染色的分布和强度。目视染色强度进行评分,按0(无染色)、1(弱染色)、2(中度染色)、3(强染色)分层,以阳性肿瘤细胞占百分比的比例评分,将百分比和强度评分相乘,得到每个病例的最终组织化学评分。H-Score的公式为:H-Score=∑(pi×i),其中i=染色强度,pi=染色肿瘤细胞的百分比,最终得分范围为0~300。高分值组的VEGF和HIF-1α表达水平等于或超过中位数,低分值组的VEGF和HIF-1α表达水平低于中位数。染色切片由两名观察员在光学显微镜下盲法检查和评分,所有切片均由两名观察员和一名病理学专家独立评分,对病理和临床特征不知情。
(2)CD34与MVD的测定:参照微血管计数方法,新生血管定义为与邻近的微血管及肿瘤组织有明确的边界,染色呈棕黄色的内皮细胞结构。结构不相连可能来源于一个新生血管时,也作为一血管计数。管腔结构不作为判定的必要条件,管腔较大且有较厚肌层的成熟血管结构需排除在外。在低倍镜视野中,选取3个微血管密集度区为血管热点,然后在高倍镜视野下计数所有的微血管,将3个数值的平均数作为MVD。
1.5 统计学分析
使用GraphPad Prism 5进行统计学分析。采用Fisher精确试验评价VEGF、HIF-1α、MVD表达与临床病理特征的关系;log-rank检验进行比较分析;Kaplan-Meier生存曲线进行预后分析;所有结果均以P<0.05为差异有统计学意义(*P<0.05,**P<0.01,***P<0.001)。
2 结果
2.1 EOC患者临床资料
VEGF、HIF-1α及MVD与EOC患者临床病理特征的相关性,见表1。研究结果表明,EOC患者肿瘤组织中VEGF、HIF-1α和MVD的表达与FIGO分期、病理学分级和有无淋巴结转移有关,差异有统计学意义(P<0.05),与年龄、组织学

表1 EOC患者临床病理特征与VEGF、HIF-1α和MVD表达的关系
2.2 EOC以及正常卵巢组织中VEGF、HIF-1α、MVD的表达
VEGF着色于细胞浆,HIF-1α在细胞核和细胞浆中同时出现,研究显示,细胞核内的HIF-1α具有转录活性,以棕黄色染色出现在细胞核为阳性。研究结果显示,VEGF和HIF-1α在EOC组织中的免疫组化染色强度和百分比明显高于正常卵巢组织,差异有统计学意义(P<0.05)。通过免疫组化分析CD34的表达,根据Weidner法评估MVD,结果显示,与正常卵巢组织相比,EOC组织中MVD的平均值显著升高,差异有统计学意义(P<0.05),见表2及图1。
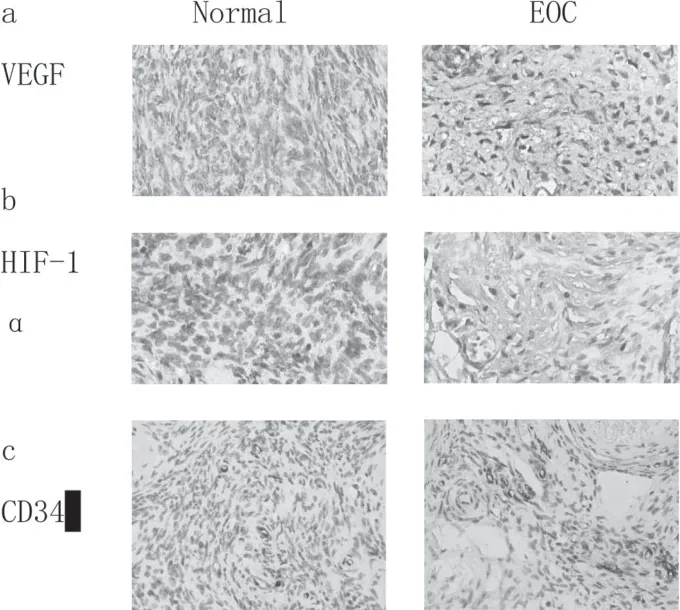
图1 EOC及正常卵巢组中VEGF、HIF-1α、MVD的表达

图2 VEGF、HIF-1α、MVD的表达与OS的关系
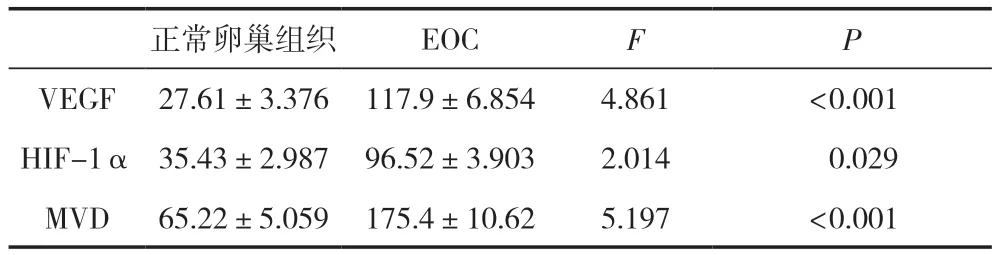
表2 EOC及正常卵巢组织中VEGF、HIF-1α、MVD的表达
VEGF、HIF-1α和CD34在正常卵巢组织和EOC肿瘤组织中的免疫组化染色结果(放大倍数:400X),a、b:VEGF和HIF-1α在EOC组织中的免疫组化染色度和百分比明显高于正常卵巢组织,差异有统计学意义(P<0.05);c:与正常卵巢组织相比,EOC组织中MVD的平均值显著升高,差异有统计学意义(P<0.05)。
2.3 VEGF、HIF-1α、MVD的表达与OS的关系
根据VEGF和HIF-1α表达的免疫组化评分,将46例EOC患者分为高分组和低分组进行Kaplan-Meier生存分析。结果显示,VEGF、HIF-1α、MVD高分组患者的总体生存概率明显低于低分组,差异有统计学意义(P<0.05)。随访结束时,VEGF低表达组有超过半数的患者仍然存活,因此不计算中位生存时间,而VEGF高表达组患者中位生存时间为28个月(HR=0.081,95%CI:0.035~0.186,P<0.001)。HIF-1α高表达组和低表达组中位生存时间分别为28个月和48个月(HR=0.259,95%CI:0.123~0.547,P<0.001)。MVD高表达组和低表达组中位生存时间分别为28.5个月和41个月(HR=0.347,95%CI:0.162~0.742,P=0.006)。
生存分析研究结果显示,VEGF、HIF-1α、MVD的表达与EOC患者的预后明显相关,高表达组预后更差。
3 讨论
血管生成与肿瘤细胞的生长、侵袭和转移有着密切的关系,显著影响患者的预后,因此,在肿瘤治疗的领域里,抗血管生成已成为不可或缺的手段之一。细胞黏附因子(Cell Adhesion Molecule,CAM)可以降低自然杀伤(Natural Killer cell,NK)细胞的毒性,有助于异位组织逃避机体的免疫攻击,从而促进血管生成。血管内皮细胞参与机体的免疫活动,血管生成因子可以通过提高内皮细胞的迁移和增殖能力促进血管生成,抑制该过程可以使肿瘤细胞的迁移和侵袭能力明显降低。
VEGF主要集中在肿瘤血管周围分泌,反应较正常血管更高,表明VEGF在肿瘤血管的生成过程中发挥着重要作用。多数肿瘤细胞VEGF均高水平表达,且与肿瘤的恶性程度呈正相关。人黑色素瘤细胞经VEGF基因转染后,可分泌大量的VEGF,肿瘤血管生成的数目和结构均随之发生了正性变化[8]。另有研究显示,血管生成能力随着上皮性卵巢恶性程度的进展而逐渐增强[9]。缺氧可以明显调控VEGF的生成,直径大于2 mm的实体肿瘤会因缺氧导致坏死,因此,为获取血液供应需要诱导新的血管生成[2-5]。Peer等[10]进行的细胞试验表明,VEGF的表达水平在缺氧条件下异常升高。另有研究发现,VEGF基因启动子区域存在HIF-1结合位点[11]。此外,VEGF还受如白细胞介素-8(IL-8)、表皮生长因子(Epidermal Growth Factor,EGF)、转化生长因子(Transforming Growth Factor,TGF)、粒细胞巨噬细胞集落刺激因子(GMCSF)等非血管特异性生长因子的调控。有研究表明,在缺氧发生时,HIF-1可结合VEGF转录起始点上的缺氧增强子序列,从而启动或增强该基因的转录[12]。
血管生成拟态(Vasculogenic Mimicry,VM)是一种全新的肿瘤微循环模式,该血管生成模式不依赖机体细胞,是经典血管生成理论的重要补充[13]。缺氧环境下VEGF环境浓度升高,诱导VEGF表达的能力提高,从而加速了卵巢癌的恶性进程。化疗耐药的原因之一在于肿瘤细胞在缺氧环境下,为适应微环境的改变, HIF表达水平升高,从而激活肿瘤细胞,使之继续增殖,细胞凋亡水平下降,从而促进血管新生[14-17]。当前的研究热点是检测肿瘤组织中VEGF和HIF-1α的表达率,以帮助早期诊断卵巢癌并且预测其侵袭性[3]。
本研究结果证实,EOC组织中VEGF和HIF-1α的免疫组化染色强度和百分比明显高于正常卵巢组织,且EOC组织中MVD的平均值显著升高,而VEGF、HIF-1α、MVD高表达组的EOC患者预后明显更差,表明缺氧微环境在肿瘤血管生成过程中扮演着重要角色。体内外研究结果表明,缺氧是决定微环境组成的共同因素,可加快肿瘤进展,低氧环境下细胞因子和细胞合作促进癌症的发展和转移,因此,减轻肿瘤微环境缺氧的新方法为卵巢癌免疫治疗策略带来了希望[3,18-19]。
基于缺氧微环境在肿瘤发生发展中的重要作用,以及血管生成在肿瘤侵袭和转移中的重要地位,针对HIF-1α的靶向治疗研究已成为目前的热点问题,例如利用缺氧微环境研发抗肿瘤药物等。随着肿瘤分子生物学的研究进展,VEGF以及HIF-1α等肿瘤生长依赖的因子成为肿瘤治疗的新靶点,肿瘤晚期患者的预后有望通过分子免疫学治疗得到改善。

