基于多个基因多态性的术后舒芬太尼镇痛效应
和浩杰,杨建新,南官江,靳 睿
(1山西医科大学麻醉学教研室,太原 030001;2山西医科大学第二医院疼痛科;*通讯作者,E-mail:yangjxin66@163.com)
疼痛直接威胁患者的身心健康,据统计临床上80%的患者因不能承受术后疼痛而出现焦虑失眠,超过30%的患者因药物镇痛不全而长期承受疼痛的折磨,急需有效的镇痛[1]。但临床上长期以来仅仅根据年龄、体质量、性别等指标指导术后镇痛,往往导致术后镇痛不足,或者术后药量过大,药物副作用过多[2]。随着遗传信息技术的发展,基因多态性逐渐被人们熟知。基因多态性包括基因长度、重复序列和单核苷酸多态性三类,目前国内外研究最热的是单核苷酸多态性(single nucleotide polymorphisms,SNP)。近几年已有较多研究从疼痛信号传导、阿片类药物代谢与排泄等方面研究影响镇痛的基因多态性[3-5],例如P2RX7(rs1718125)基因可表达特殊P2X7受体,该受体可接收疼痛因子信号,根据单核苷酸多态性(SNP)分为野生纯合子、突变杂合子、突变纯合子,分别用GG、GA、AA表示。COMT(rs4680)基因可编码儿茶酚胺氧甲基转移酶,参与体内儿茶酚胺等物质的代谢,其根据单核苷酸多态性(SNP)可分为GG、GA、AA 3种基因型,已经发现一些多态性位点影响酶的活性,从而影响疼痛的传递和调制,最终影响个人痛阈。OPRM1(rs1799971)基因可表达μ受体,接收外源阿片类药物,根据单核苷酸多态性(SNP)可分为AA、AG、GG。CYP3A4(rs2242480)基因表达细胞色素P450酶,影响人体阿片类药物的代谢,根据单核苷酸多态性(SNP)分为GG、GA、AA。ABCB1(rs1045642)表达P-糖蛋白,可将阿片类药物排泄到细胞外,从而影响阿片类药物的消耗,根据单核苷酸多态性(SNP)分为CC、CT、TT[6-11]。目前关于基因多态性指导镇痛的研究很多仅从疼痛的感知或者药物的接收、消耗等单种类型基因入手观察,忽略了多种基因之间的内部关系和相互影响。本研究改善了此不足,从疼痛信号的产生和传导、阿片类药物的接收、代谢和排泄整个过程系统思考,分析研究了P2RX7(rs1718125)、COMT(rs4680)、OPRM1(rs1799971)、CYP3A4(rs2242480)、ABCB1(rs1045642)5个基因的单核苷酸多态性对术后镇痛的影响。
1 资料与方法
1.1 病例选择
根据随机抽样调查样本数公式计算样本数[12],即:n=(Z1-a/2/e)2×P(1-P),公式中n代表样本量;e为允许误差,一般取总体率95%可信区间的一半,根据人力、物力一般情况,本项研究采用e<10%P,Z1-a/2可查阅Z值表,取α=0.05,则Z1-α/2=1.96。预实验舒芬太尼镇痛有效率考虑此处取P=70%,代入得n=104.4。
本研究获得山西医科大学第二医院伦理委员会批准,批件号:(2021)YX第(045)号,所有患者均签署知情同意书。选取100例下肢骨折患者作为研究对象,纳入标准:①年龄20~70岁;②美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ-Ⅱ级;③意识清楚,可有效言语沟通,经培训可配合完成疼痛评估。排除标准:①有椎管内麻醉禁忌证者;②长期酗酒,长期服用慢性止痛药者;③肝肾功能不佳者;④心功能异常者;⑤对阿片类药物有成瘾史者;⑥对于术后镇痛不能满足VAS<3分需要在病房给予其他镇痛药或镇痛方式的患者。
1.2 麻醉方法与样本收集
患者入室后进行心电监护,静脉采血2 ml用于基因测序。摆好体位,然后予盐酸罗哌卡因注射液(阿斯利康投资有限公司,10 ml∶100 mg,批号H20140763)2 ml,生理氯化钠溶液(华润双鹤药业股份有限公司,批号H20056130)1 ml,混合后行蛛网膜下腔麻醉,达到T8-T10阻滞平面开始手术,术毕进入恢复室,接PCA镇痛泵,镇痛泵配方为枸橼酸舒芬太尼注射液(宜昌人福药业有限责任公司,1 ml∶50 μg,批号H20140763)100 μg加入98 ml生理盐水中,配比成1 μg/ml,不设背景输入量,自控镇痛锁定时间10 min,每次按压0.03 μg/kg,最大输注量20 μg/h。随后将患者转回病房,记录其12 h和24 h时的VAS评分及舒芬太尼消耗量。
1.3 基因分型
采取外周静脉血2 ml,使用基因型DNA纯化试剂盒(天根生化DP304试剂盒)从全血中分离DNA。查询基因库(CNGBdp)合成P2RX7(rs1718125)、COMT(rs4680)、OPRM1(rs1799971)、CYP3A4(rs2242480)、ABCB1(rs1045642)5种基因型的引物,根据引物行PCR扩增(拓赫THT-96G梯度扩增仪,上海测博生物科技有限公司)。PCR反应条件为:96 ℃预变性5 min,92 ℃变性30 s,55 ℃退火30 s,74 ℃延伸1 min,74 ℃延伸修复10 min,共32个循环。然后取扩增产物送武汉迈特维尔生物科技有限公司行基因测序,以明确患者的基因SNP分型。
1.4 统计分析
统计分析采用SPSS 26.0软件,首先对样本进行正态性检验和方差齐性检验。不同手术部位患者术后舒芬太尼消耗量比较采用单因素方差分析。不同性别患者术后舒芬太尼消耗量比较使用独立样本t检验,不同患者的年龄、身高、体质量、BMI等非遗传因素与术后舒芬太尼消耗量之间的关系用单变量直线相关分析,遗传因素(不同基因型)与术后舒芬太尼消耗量之间的关系用多元逐步回归分析。每种基因型内部不同SNP舒芬太尼消耗量的比较用单因素方差分析和LSD事后比较。以P<0.05认为差异有统计学意义。
2 结果
2.1 不同手术部位患者术后舒芬太尼消耗量比较
最终收集病例数113例,根据排除标准剔除13例,共纳入100例。各基因频率及基因型分布在Hardy-Weinberg平衡方面无明显偏差(见表1),具有群体代表性。术后12 h和24 h不同手术部位患者舒芬太尼消耗量之间的差异无统计学意义(P>0.05,见表2)。
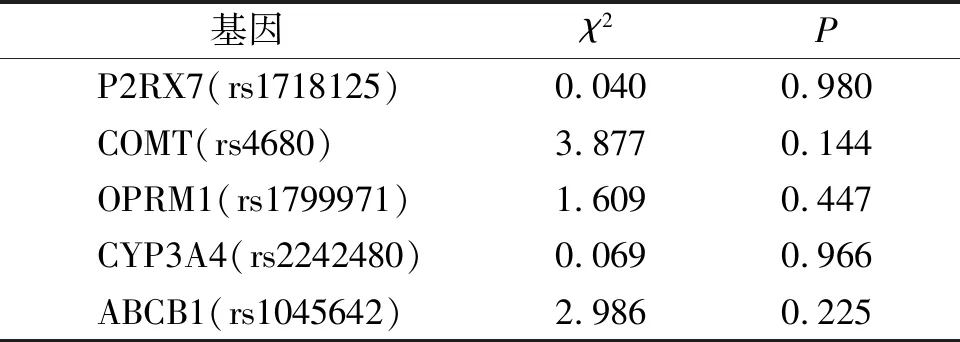
表1 Hardy-Weinberg遗传平衡检验结果
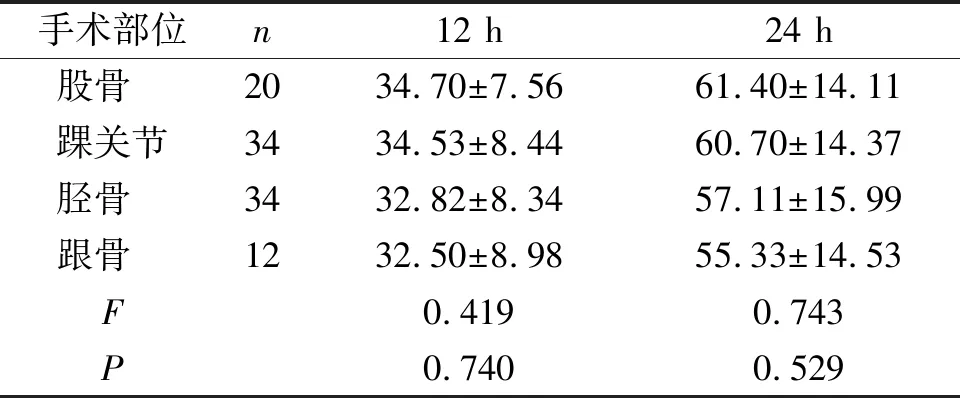
表2 不同手术部位患者术后舒芬太尼消耗量比较 (μg)
2.2 不同非遗传因素与术后舒芬太尼消耗量的直线相关分析
不同患者年龄、性别、身高、体质量、BMI等指标与术后舒芬太尼消耗量无相关关系(P>0.05,见表3)。
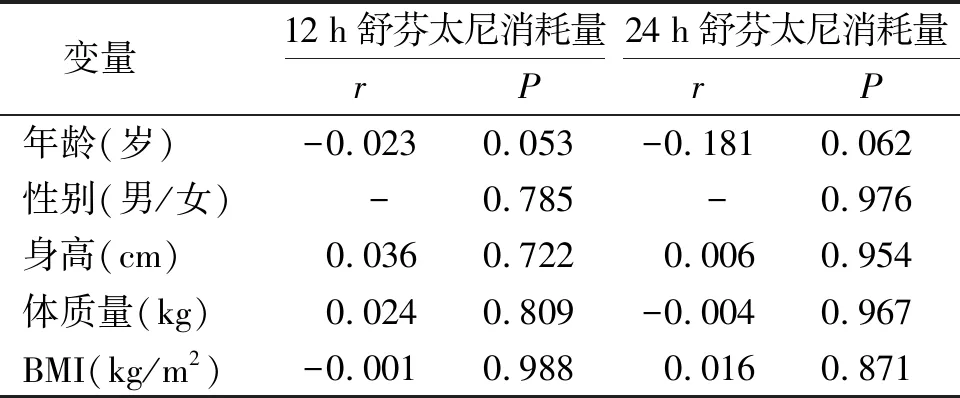
表3 不同非遗传因素与术后舒芬太尼消耗量的直线相关分析
2.3 不同基因多态性与术后舒芬太尼消耗量之间的关系分析
运用多元逐步回归之后,影响术后舒芬太尼消耗量的因素中,只有OPRM1(rs1799971)基因被排除(P>0.05),其他4种基因P2RX7(rs1718125)、COMT(rs4680)、CYP3A4(rs2242480)、ABCB1(rs1045642)与术后舒芬太尼的消耗量有相关性(P<0.05,见表4和表5)。
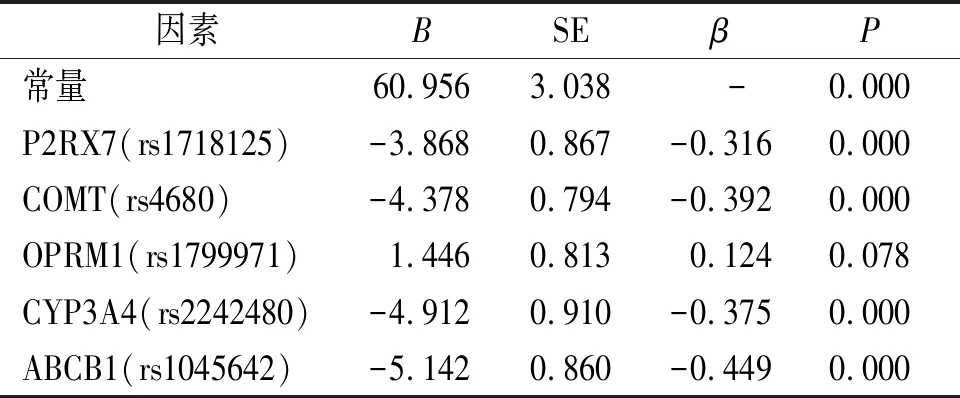
表4 不同基因与术后12 h舒芬太尼消耗量之间的关系
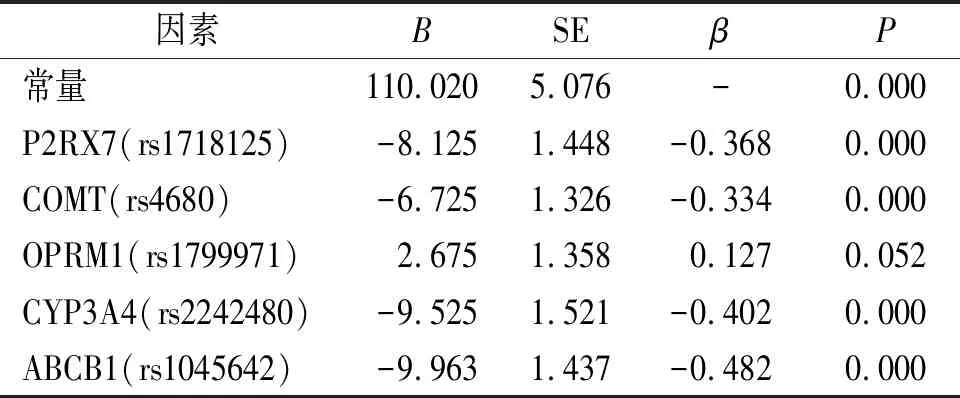
表5 不同基因与术后24 h舒芬太尼消耗量之间的关系
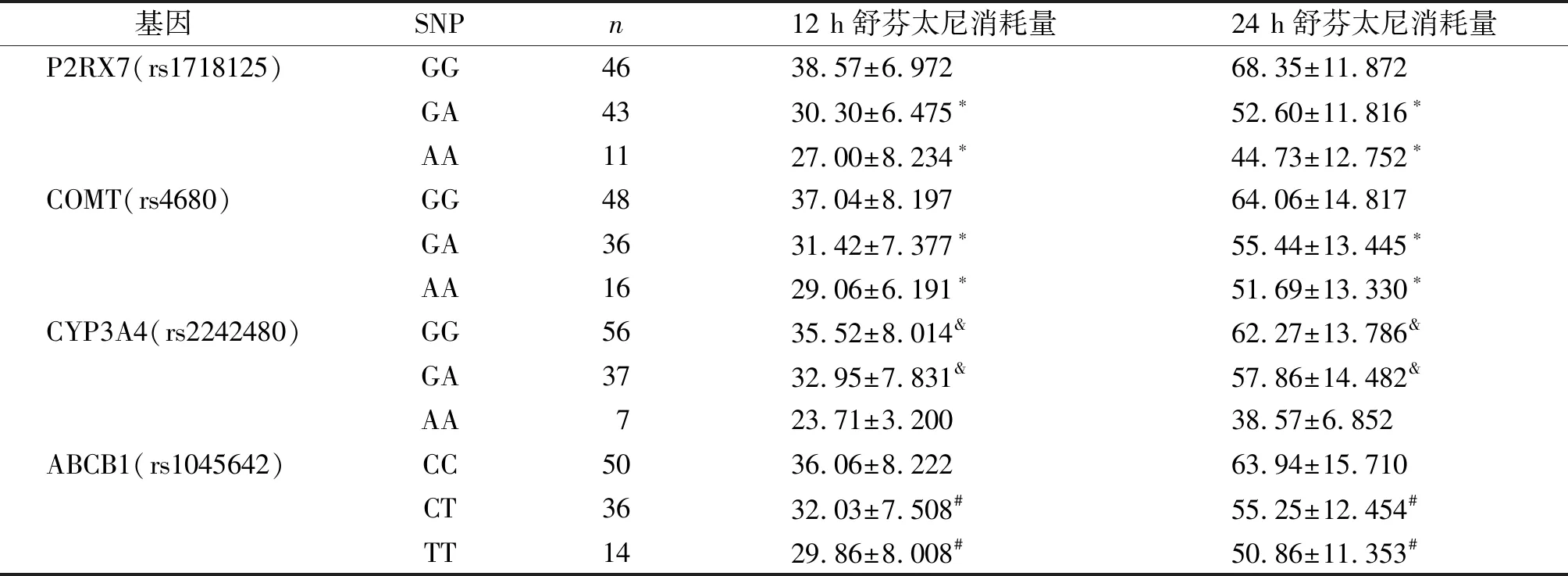
表6 各基因不同SNP间舒芬太尼消耗量比较 (μg)
2.4 各基因不同SNP间舒芬太尼消耗量比较
术后12 h和24 h,P2RX7(rs1718125),COMT(rs4680)基因野生纯合子(GG)患者舒芬太尼消耗量多于突变杂合子(GA)和突变纯合子(AA)(P<0.05),但突变杂合子(GA)与突变纯合子(AA)之间差异无统计学意义(P>0.05,见表6)。CYP3A4(rs2242480)基因野生纯合子(GG)和突变杂合子(GA)舒芬太尼消耗量多于突变纯合子(AA)(P<0.05),野生的纯合子(GG)和突变杂合子(GA)之间差异无统计学意义(P>0.05,见表6)。ABCB1(rs1045642)基因的野生纯合子(CC)患者舒芬太尼消耗量多于突变杂合子(CT)和突变纯合子(TT)(P<0.05),但突变杂合子(CT)与突变纯合子(TT)之间差异无统计学意义(P>0.05,见表6)。
3 讨论
舒芬太尼是目前临床上广泛使用的一种阿片类镇痛药。因个体之间存在遗传或非遗传因素差异,相同剂量的舒芬太尼在不同患者中的镇痛效果差异显著。临床上急需一些客观指标来指导术后舒芬太尼镇痛。本研究从遗传和非遗传方面入手观察,研究结果显示非遗传因素对下肢骨折手术的患者术后舒芬太尼消耗量无影响,部分遗传因素对术后舒芬太尼消耗量有影响。
本研究创新之处在于全面考虑了疼痛信号的产生、传导、阿片类药物接收、代谢、排泄等多种相关基因,并从它们中间找出了影响术后镇痛的基因型。P2RX7基因表达产生的P2X7受体(P2X7R)是一种非选择性ATP门控离子通道,主要存在于脊髓小胶质细胞中,是小胶质细胞活性的关键调节剂,可能影响多种炎症介质和疼痛因子的表达[13]。近来已有研究显示P2X7受体可通过对周围组织损伤的影响和对神经系统加工的调节对疼痛敏感性进行调节[14]。Zheng等[15]通过分析得出P2RX7rs1718125多态性与食管癌患者术后疼痛和芬太尼消耗相关。本研究结果也显示,该基因不论是对于术后12 h还是24 h的舒芬太尼消耗量差异均有统计学意义。可能是突变了的纯合子参与产生的嘌呤受体减少,影响了疼痛信号的传导,增加了患者的疼痛阈值,需要更少的外源性舒芬太尼镇痛。COMT基因,可编码儿茶酚胺氧甲基转移酶,参与体内儿茶酚胺等物质的代谢,从而影响内源性疼痛信号的传导。COMT基因中比较常见的单核苷酸多态性(SNP)是COMT(rs4680),AA个体具有较高的COMT酶活性,对疼痛的感知力比较低,而GG个体刚好与之相反[16]。Kumar等[17]研究后发现COMT(rs4680)携带者术后24 h疼痛评分较高。但Matsuoka等[18]则认为单独使用COMT rs4680基因型为指导,在阿片类药物吗啡和羟考酮之间进行选择以缓解疼痛不太准确。本研究结果发现该基因多态性对术后舒芬太尼的消耗有影响,GG型消耗量多于GA和AA型,可能是突变纯合子影响了儿茶酚胺氧甲基转移酶的编码,从而使得內源性儿茶酚胺的代谢受到影响,导致机体接收到了较多的疼痛信号所致。OPRM1基因为编码阿片类药物受体的基因,该基因存在多个单核苷酸多态性(SNP),其中以OPRM1 A118G(rs1799971)的研究最为广泛和深入。Yu等[19]通过荟萃分析表明,癌痛患者中,OPRM1 A118G突变基因携带者个体(AG,GG),倾向消耗更多的阿片类药物。OPRM1 A118G基因多态性可能有助于预测个体对镇痛的反应和达到令人满意的癌症镇痛。Chou等[20]通过观察全膝关节换术的患者,发现女性OPRM1基因GG患者比AA和AG基因型患者需要更多的吗啡用于术后镇痛。而男性患者的3种基因型在用于术后疼痛控制的吗啡消耗量方面没有显著差异。提示我们用OPRM1基因多态性来指导镇痛可能还需要考虑到性别因素。本研究观察分析后并未发现其多态性影响舒芬太尼消耗量,考虑原因可能是镇痛药种类、人口种族、生长环境、甚至样本量大小不同,从而产生了不同结果。CYP3A4基因,目前发现其单核苷酸多态性(SNP)已经超过40个。大多数学者认为CYP3A4的基因多态性会对P450 CYP3A4酶的表达量以及活性产生影响,继而造成镇痛效果的差异。Zhang等[21]通过观察研究患者子宫肌瘤切除术后的镇痛情况,得出CYP3A4(rs2242480)基因AA基因型的壮族患者中舒芬太尼的使用率最高。Cheng等[22]学者已经尝试建立基于基因多态性的术后个体舒芬太尼剂量预测方程,方程纳入患者的基本信息和CYP3A4*1G、COMTVal158Met、OPRM1A118G和ABCB1C3435T基因测序结果,可用于不同类型的手术,指导术后镇痛。本研究与前人研究结果一致,发现该CYP3A4(rs2242480)基因不同SNP患者,术后舒芬太尼消耗量突变纯合子消耗量小于野生纯合子和突变杂合子。ABCB1基因为影响阿片类药物排泄的基因。可编码P-糖蛋白(P-gp),此蛋白可以将细胞内的药物主动转运到细胞外,起到细胞排泄作用,从而影响术后镇痛。目前对于其研究最多的SNP是rs1045642(C3435T)。范晴晴等[23]研究认为对于西方人群而言,ABCB1 C3435T基因多态性对阿片类药物消耗量存在影响,突变基因携带者术后消耗的阿片类药物更多。但对于亚洲人群而言,ABCB1 C3435T基因多态性与阿片类药物消耗量无关,可能由于该位点存在人种间差异。Bartosova等[24]研究后发现变异OPRM1等位基因与疼痛缓解减少、阿片类药物消耗增加和不良反应发生率增加相关,而ABCB1多态性对观察到的参数并没有影响。Hooten等[25]也通过研究ABCB1 c.3435C>T(rs1045642)得出由于P-gp的表达较低,TT基因型个体中内源性阿片类肽的外排减少,这反过来又导致更高的热痛阈值。本研究结果显示术后ABCB1基因的突变型(CT型和TT型)都消耗较少的舒芬太尼,分析其原因可能是由于相关位点的突变导致编码跨膜蛋白P-gp受到影响,从而影响外源性阿片类药物的排泄,使得体内处于较高的血药浓度,从而缓解了疼痛。
本研究也具有一定的局限性,首先为单中心研究,但是基因多态性影响因素较多,还需要以后进行多中心的研究,纳入更多的手术类型、地域人口等,以增强研究的科学性和实用性。此外阿片类药物品种也较多,本研究只观察了舒芬太尼的术后镇痛效果,其他临床常用的阿片类药物与基因多态性的关系研究还需要继续扩展。未来通过更多的学者努力,完善更多的疼痛基因型,同时纳入非遗传因素建立行之有效的预测方程,才能在术后镇痛之前明确患者的镇痛药物需求,从而节约药量,减少药物过多引发的不良反应,实现真正的“个体化镇痛”。

