鸭肠炎沙门氏菌致病性差异研究*
魏可欣,石锐琪,林仲寅,李世恒,李继桐,李琦,吕俊峰
(山东省农业科学院家禽研究所,山东 济南 250100)
沙门氏菌属肠杆菌科,是一种革兰氏阴性肠道杆菌,一般无荚膜,大多数有周身鞭毛。家禽是肠炎沙门氏菌的天然感染对象,雏鸭感染尤为严重。感染雏鸭精神沉郁,食欲不振,排白色如水状的粪便,肛门周围绒毛被粪便污染[1],死亡率升高。剖检可见心脏肿大,并伴有出血现象,严重时会有干酪样物。肝脏肿大,出现点状出血或者局部坏死,卵巢和卵泡也会出现一定程度上的坏死[2]。沙门氏菌病已成为危害山东省肉鸭养殖的主要细菌性疾病之一[3],因此需对该病的病原菌分离鉴定,测定、分析不同沙门氏菌致病性差异,为临床防控与治疗提供理论依据。
1 材料与方法
1.1 样品采集
分别于山东不同地区肉鸭养殖场内采集新鲜粪便样本及泄殖腔拭子,具体采集数量见表1。
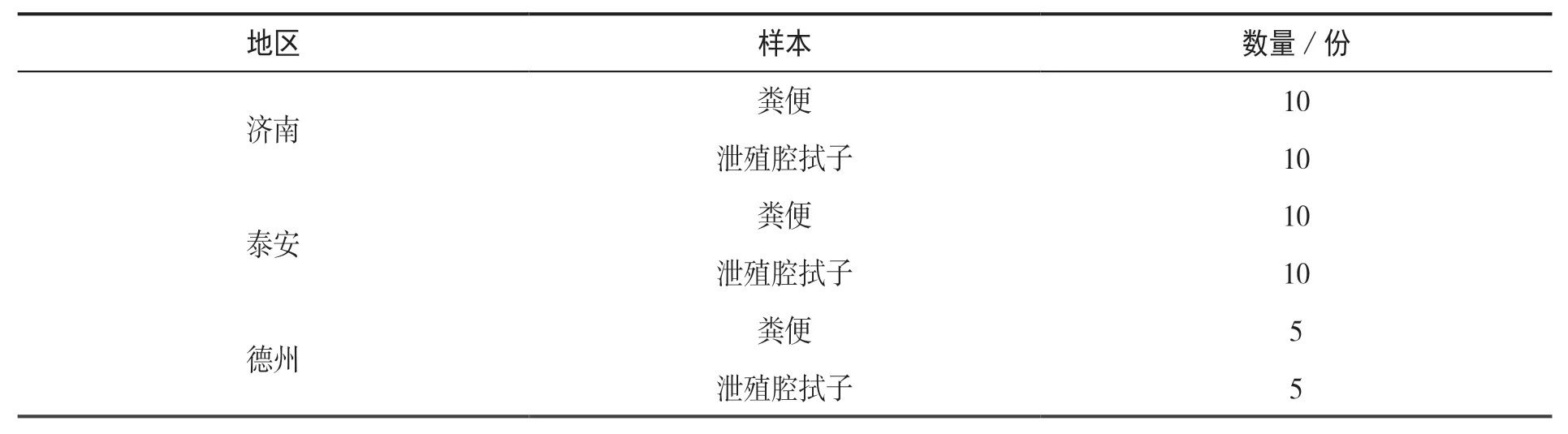
表1 样品采集信息
1.2 试剂与引物
实验所用TSA 固体培养基、LB 固体、液体培养基均由本实验室配制保存;2×Tap PCR StarMix试剂盒购自康润诚业生物科技(北京)公司。
根据胡兴娟等人的报道[4],按照肠炎沙门氏菌sdf 基因设计特异性引物,引物序列和扩增片段如表2 所示。

表2 引物序列
2 方法
2.1 细菌分离培养
吸取50 μL 采集的样品液均匀涂抹至TSA 固体培养基上,每个培养基各接种4 类样品,37 ℃培养12 h 观察TSA 培养基是否有菌落生长。挑取生长的单菌落使用四区划线法接种至LB 固体培养基中37 ℃培养12 h[5],以同种方法连续纯化3次,挑取3 次纯化后的单菌落加入LB 液体培养基,过夜培养后置4 ℃保存。
2.2 PCR 鉴定
以2.1 保存的菌液为模板,以sdf-F/R 为引物进行PCR 扩增。PCR 反应体系为2×Tap PCR StarMix 10 μL,sdf-F/R 各1 μL,模板1 μL,ddH2O 7 μL。PCR 反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸15 s,共30 个循环,72 ℃终延伸10 min。将获得的PCR 产物经1%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序。
2.3 动物回归试验
取2.1 待检沙门氏菌以1:100 比例转接至20 mL LB 液体培养基,120 r/min 摇菌培养5~6 h,经细菌平板计数可知细菌数为1.15×1012CFU/mL。将菌液11 000 r/min 离心15 min,用无菌 PBS 溶液重悬沉淀菌体并继续离心,重复3 次后用适量无菌PBS 溶液重悬制成菌液浓度为1.15×109CFU/mL的悬菌液,分为5 组并标记备用[6]。
取50 只7 日龄的雏鸭随机分为1 组对照组和5 组试验组,对照组10 只,试验组40 只,5 组试验组分别命名为沙门1、2、3、4、5 组,每组8只,各组单独饲养。将配制的5 组菌液分别接种各试验组,每只雏鸭腿部肌肉注射0.2 mL 浓度为1.15×109CFU/mL 的悬菌液,对照组每只腿部肌肉注射0.2 mL 生理盐水。
攻毒后的第1、3、5 天每组分别称重并剖检两只雏鸭,第7 天将全部雏鸭称重后颈部放血处死。取剖检雏鸭心脏、肝脏、肺脏、十二指肠、脾脏等主要脏器称取重量,观察是否出现病变。使用烧红的烙铁将剖检肝脏表面消毒,无菌接种环穿透肝脏表面接种至LB 固体培养基中,按2.2方法进行鉴定,检测剖检鸭肝脏中是否含有沙门氏菌。
3 结果
3.1 分离培养结果
细菌分离培养结果显示,在获得50 份样品中共有5 份样品(J1356、J1329、J1360、J1362、J1363)出现菌落生长。眼观菌落边缘整齐、光滑圆润(图1),与沙门氏菌菌落形态相似,故初步判定为沙门氏菌[7]。5 份样品分别命名为沙门氏菌1、2、3、4、5 组。
3.2 PCR 鉴定结果
PCR 产物经1%琼脂糖凝胶电泳,除空白对照外,试验组沙门氏菌1~5 组均于119 bp 处出现特异性条带(图2)。将PCR 产物测序结果进行Blast 比对确认检测的5 株菌均为肠炎沙门氏菌。

图2 琼脂糖凝胶电泳结果图
3.3 动物回归试验结果
致病性试验结果显示,沙门氏菌5 组毒力最强,其次依次为沙门氏菌2 组、4 组、3 组、1组,死亡率分别为87.5%、75%、62.5%、50%、12.5%,对照组无死亡(图3)。
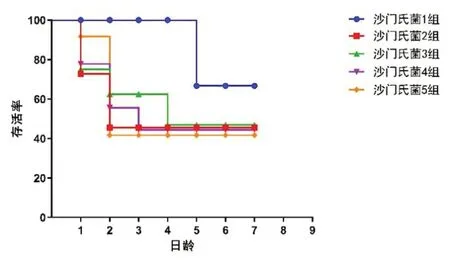
图3 试验组各组存活率(详见附录彩图)
观察攻毒组雏鸭形态体征,发现接种沙门氏菌3 组与5 组悬菌液的雏鸭体态受影响最大。感染鸭跛行严重,不能正常行走;沙门氏菌3 组对雏鸭的体态运动有较大的影响,同样出现跛行,但症状较2、5 组轻,发生运动障碍;4 组前期对体态无影响,没有症状出现,随日龄增长,逐步危害体态,使其运动发生障碍;1 组对雏鸭的体态几乎没有影响。对照组雏鸭精神状态良好,体态正常,饮食未有异常。
雏鸭剖检观察结果显示,试验组心脏、肺脏、十二指肠重量均轻于同日龄对照组雏鸭,脾脏则普遍重于同日龄对照组;沙门氏菌2 组、5 组心脏病理变化不明显,肝脏有不同程度肿胀、出现大小不一的出血点和坏死灶。接毒72 h 后,沙门氏菌1 组心脏出现心包炎及出血,心脏外膜有黄白色纤维素样物质渗出,出现坏死灶或结节;肝脏发生肝周炎,肝脏表面渗出白色纤维素状物,出现坏死灶;肝被膜与胸壁、心脏腹膜发生粘连。脾脏、肺脏、十二指肠也有轻微病变:脾脏不同程度肿胀、出血、淤血;肺脏不同程度出血,呼吸道出现大量的黏液;十二指肠仅见少量出血点,未出现明显病变。同日龄对照组雏鸭各组织脏器均正常,无任何病变和坏死灶。由此可见,分离到的5 株沙门氏菌菌株对心脏、肝脏的致病性有较大差异,对其余脏器也有致病性,但各组间差异较小。
对各组感染鸭肝脏进行细菌分离鉴定,沙门氏菌2、3、4、5 组在LB 固体培养基上生长出灰白色、半透明状的菌落,对分离得到的18 个带菌平板挑取单菌落进行PCR 反应并经1%琼脂糖凝胶电泳鉴定,结果如图4 所示。除空白对照外,挑取的18 个单菌落均于119 bp 处出现特异性条带。将PCR 产物送至生工生物工程(上海)股份有限公司测序,测序结果上传NCBI 经Blast 比对后确定为肠炎沙门氏菌。

图4 分离细菌的凝胶电泳结果图
4 结论
本试验自山东省部分地区肉鸭养殖场采集的病料中分离到5 株沙门氏菌,经过一系列检测鉴定确认为鸭肠炎沙门氏菌,分别命名为沙门氏菌1、2、3、4、5 株。动物回归试验结果表明,分离到的5 株沙门氏菌均有不同程度的致病性,且不同的菌株致病力不同,多呈现急性或者亚急性感染。从致病性来看,5 组的致病性最强,死亡率高达87.5%,其次为2 组、4 组、3 组、1 组;从病理变化来看,2 组、5 组的病理变化不明显,仅出现肝脾肿大、出血等现象,4 组感染鸭出现卵黄吸收障碍,1 组和3 组病变不明显,致死率也较低,更倾向发展为隐性感染。因此,感染沙门氏菌的雏鸭除出现病变严重、死亡等显性症状外,也极容易出现隐性感染,这种感染会使鸭产品成为肠炎沙门氏菌的隐性传染源,威胁养殖业发展,危害人类健康。若想预防沙门氏菌的感染,应从传染源、传播途径入手,注意加强鸭舍内外环境、饮食环境的消杀,阻断或降低环境因素导致的水平传播风险[8]。

