玉米番茄红素环化酶基因的克隆、表达及功能分析
王凡予,何伟伟*,李大婧,郭庆启,*,罗 浩,陆义珠,包怡红,张钟元
(1.东北林业大学生命科学学院,黑龙江 哈尔滨 150040;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏大学食品与生物工程学院,江苏 镇江 212000)
玉米(Zea maysL.)是富含VA原的主要粮食作物[1]。除微量元素和膳食纤维外,黄色玉米籽粒还富含类胡萝卜素,主要包括α-胡萝卜素、β-胡萝卜素、β-隐黄质、叶黄素和玉米黄素等。胡萝卜素类参与光合代谢,以防止高等植物氧化应激引起的损害[2],还可作为抗氧化剂[3]和必需营养素[4],同时也是重要的VA原。其中α-胡萝卜素在玉米光合组织捕获光复合物时发挥功能,同时还可有效降低人类患心血管疾病和癌症的风险[5];β-胡萝卜素不仅是最稳定的天然色素,还可作为免疫调节因子增强机体免疫力,促进细胞凋亡[6]。除了上述常见的胡萝卜素外,自然界中还存在其他结构的胡萝卜素如δ-胡萝卜素、ε-胡萝卜素等,它们是合成α-胡萝卜素和β-胡萝卜素的中间物质,但其功能研究较少。由于类胡萝卜素只能通过食物摄取[7],因此,目前诸多研究都关注于类胡萝卜素的富集调控机制方面[8-9]。
番茄红素β-环化酶(lycopeneβ-cyclase,LCYb)和ε-环化酶(lycopeneε-cyclase,LCYe)是调控类胡萝卜素合成的关键酶[10]。α-胡萝卜素源于番茄红素两端的非对称环化,而β-胡萝卜素是由番茄红素分子两端分别对称环化β-紫罗兰酮环而形成[11]。LCYb和LCYe催化番茄红素的特性已在拟南芥[12]、小麦[13]、芹菜[14]、柑橘[15]、花椰菜[16]等植物中得到研究,但在每种植物中番茄红素环化酶催化番茄红素所生成的胡萝卜素种类和含量却并不相同,最常见的是含有ε-和β-环的α-胡萝卜素及双β-环的β-胡萝卜素,而具有双ε-环的胡萝卜素却很少存在。Cunningham等[17]发现莴苣LCYe能催化全反式番茄红素的两个末端形成有两个ε-环的ε-胡萝卜素,而拟南芥更倾向合成δ-胡萝卜素。由此可见,植物中胡萝卜素的种类和积累与番茄红素环化酶的表达模式和功能特性具有一定的关系,Bai Ling等[18]研究发现在玉米不同组织中类胡萝卜素的积累模式不同,同时将玉米LCYe基因引入大肠杆菌中发现,在没有LCYb存在的情况下,玉米LCYe可催化番茄红素生成δ-和ε-胡萝卜素。而自然界植物体内往往同时存在番茄红素LCYb和LCYe,两者共同催化番茄红素的机制需进一步探究。
本研究拟通过体外获得玉米番茄红素环化酶(ZmLCYb和ZmLCYe)全长,通过生物信息学分析,预测其化学性质;利用大肠杆菌表达系统对番茄红素环化酶进行异源表达并纯化蛋白;通过“颜色互补”及产物分析测定探究ZmLCYb和ZmLCYe的催化特性。旨在揭示LCYb和LCYe催化番茄红素生成胡萝卜素的功能特性,为开展玉米类胡萝卜素分子调控机制研究奠定基础。
1 材料与方法
1.1 材料与试剂
LB(Luria-Bertani)培养基:胰蛋白胨10 g/L, 酵母提取物5 g/L,氯化钠10 g/L。
多糖多酚植物总RNA提取试剂盒 北京天根生化科技有限公司;PrimeScript RT Master Mix试剂盒、DL 2000 DNA Marker、限制性内切酶NotI、BamH I、NdeI、BglII 宝日医生物技术(北京)有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-Dthiogalactopyranoside,IPTG)、5×蛋白上样缓冲液、卡那霉素、Seamless Cloning master mix、SanPrep柱式质粒DNA小量抽提试剂盒、GST 4 FF 柱纯化回收试剂盒生工生物工程(上海)股份有限公司。
1.2 仪器与设备
JY88-II超声波细胞粉碎机 新芝生物科技股份(宁波)有限公司;LBI-150生化培养箱 龙跃仪器设备(上海)有限公司;5424R台式高速离心机 德国Eppendorf公司;BS224S电子分析天平 赛多利斯科学仪器(北京)有限公司;1260 Infinity II高效液相色谱仪美国Agilent公司。
1.3 方法
1.3.1 发芽玉米总RNA提取
取新鲜黄色玉米籽粒(‘苏玉29’)置于液氮中并在研钵中研磨成粉末,参照试剂盒说明书提取黄色玉米的总RNA,琼脂糖凝胶电泳检测其完整性,以RNA为模板进行反转录,得到cDNA。
1.3.2 重组质粒的构建
LCYb和LCYe基因克隆:根据NCBI检索结果,获得LCYb序列(基因登录号NP_001169155.1)和LCYe序列(基因登录号NP_001146840.1),并利用Primer Premier 6.0软件设计特异引物E-P1/E-P2、B-P3/B-P4、B-P5/B-P6、E-P7/E-P8、EB-P9/EB-P10、EB-P11/EB-P12(表1)。反应条件为:94 ℃预变性1 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸120 s,共循环30 次;72 ℃延伸10 min,以cDNA为模板进行扩增并回收目的基因片段。

表1 LCYe和LCYb基因的扩增引物序列Table 1 Primer sequences used for amplification of LCYe and LCYb genes
线性化载体:质粒pET-28a(+)和pGEX-4T-1分别用BamH I和NotI进行双酶切,pCDFDuet-1质粒用NdeI和BglII(LCYb插入位点)、BamH I和NotI(LCYe插入位点)进行酶切,酶切片段经纯化回收。
重组质粒的构建:参照无缝克隆试剂盒说明书,将目的基因片段与线性化载体进行连接,连接产物转化至大肠杆菌DH5α感受态细胞中,涂布在相应抗性平板,筛选转化子并通过质粒双酶切鉴定及测序验证,将测序正确的重组质粒命名为pET-B、pET-E、pCDF-BE、pGEX-B和pGEX-E(表2)。
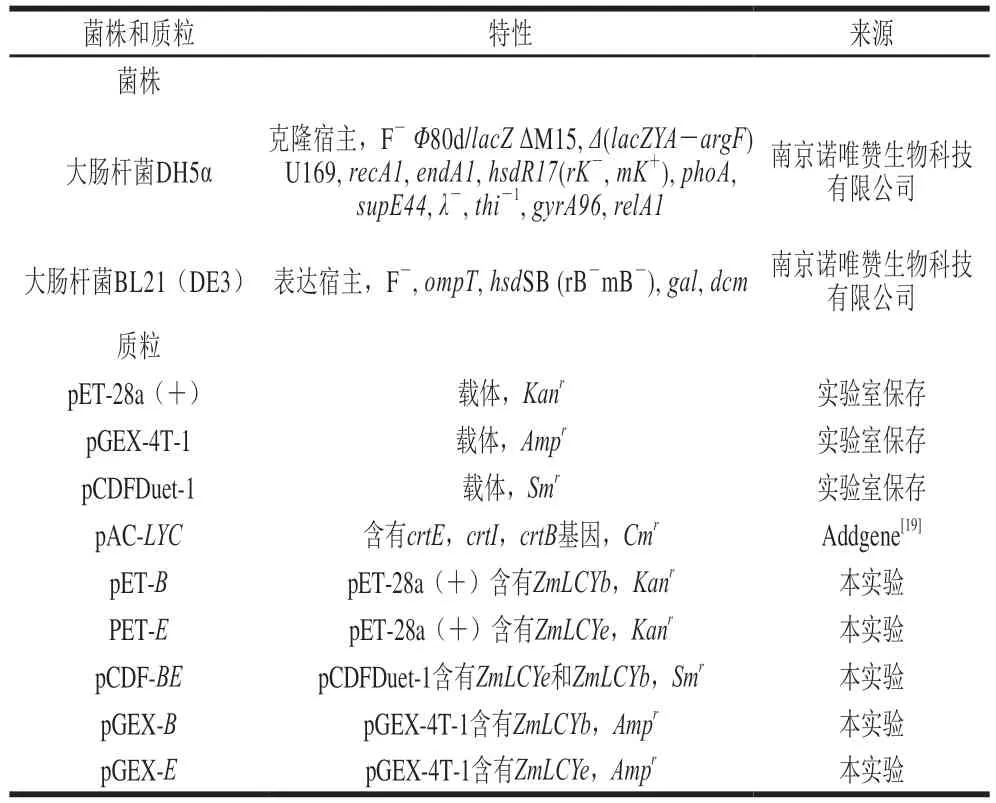
表2 菌株和质粒Table 2 Strains and plasmids used in this study
1.3.3 生物信息学分析
蛋白质的理化性质预测利用ExPASy(https://web.expasy.org)的ProtParam和ProtScale工具,蛋白质的跨膜区分析采用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/),蛋白质结构三维建模使用SWISSS MODEL(http://swissmodel.expasy.org/)工具,氨基酸序列的同源性比对利用BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi),系统发育树构建采用MEGA 6.0的邻接法。
粉彩花鸟瓷绘画中粉彩清雅的釉色与瓷器莹润的玻璃白的结合与国画中花鸟作品的线条和清雅的色彩有着异曲同工之妙。
1.3.4 重组蛋白的表达和纯化
1.3.4.1 重组融合蛋白的诱导表达
将pGEX-B和pGEX-E重组质粒分别转化至BL21(D E 3)感受态中,涂布在L B 固体培养基上(含Amp 50 μg/mL)。37 ℃过夜培养后挑取单菌落接种到5 mL LB液体培养基(含Amp 50 μg/mL)中,37 ℃、200 r/min过夜培养后,在100 mL LB培养基中以1∶100(V/V)的比例扩大培养,相同条件下再培养至OD600nm约为0.6~0.8时,向菌液中加入IPTG(终浓度1 mmol/L)进行诱导表达,诱导4 h后将培养液在4 ℃、8 000 r/min离心收集菌体,缓冲液重悬菌体后超声破碎,离心取上清液,得到ZmLCYe和ZmLCYb的蛋白粗酶液。
1.3.4.2 基于谷胱甘肽巯基转移酶(glutathioneS-transferase,GST)标签亲和层析纯化
经0.22 μm滤膜过滤粗酶液后,以0.5 mL/min的流速加入预平衡好的GST4 FF柱。加入Tris-HCl(50 mmol/L,pH 8.0,含10 mmol/L还原型谷胱甘肽)以1 mL/min进行洗脱,收集洗脱液,用12%分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)鉴定。
1.3.4.3 SDS-PAGE分析
将纯化后的ZmLCYe和ZmLCYb蛋白液加入5×蛋白上样缓冲液(1∶4,V/V),100 ℃煮沸10 min,12 000 r/min离心5 min后,分别收集上清液,检测上清液中重组蛋白。
1.3.5ZmLCYb和ZmLCYe在大肠杆菌中的颜色互补实验
将pAC-LYC质粒与pET-B、pET-E和pCDF-BE质粒分别共转化至大肠杆菌BL21(DE3)中,挑取固体培养基上的阳性单菌落,在30 ℃同样条件下过夜培养,至OD600nm为0.6~0.8。然后加入终浓度1.0 mmol/L IPTG诱导表达48 h,离心收集菌体,进行颜色比对。
1.3.6 大肠杆菌中类胡萝卜素的提取与测定
将收集的菌体加入85%丙酮溶液萃取,悬浮吹打至菌体无色,加入正己烷,吸取上清液,氮气吹干后,用甲醇复溶,有机滤膜(0.45 μm)过滤后进高效液相色谱仪分析检测[20]。
类胡萝卜素检测参考Liang Minghua等[21]的方法。通过甲醇、水和甲基叔丁基醚(tert-butyl mehyl ether,MTBE)三元梯度洗脱,检测仪器型号为Agilent G7117A二极管阵列检测器。色谱条件为:柱温25 ℃,YMC Carotenoid C30色谱柱(4.6 mm×250 mm,5 μm),流动相分为A相(97%甲醇)(含0.05 mol/L乙酸铵和0.1% BHT)和B相(100% MTBE)(含0.1% BHT),流速为1 mL/min,分析物的检测采用二极管阵列检测器(200~700 nm)进行,进样体积10 μL。梯度洗脱条件:0~10 min,100%~90% A、0%~10% B;1 0 ~2 0 m i n,9 0%~6 0% A、1 0%~4 0% B;2 0 ~2 5 m i n,6 0%~5 0% A、4 0%~5 0% B;2 5 ~2 9 m i n,5 0%~1 0% A、5 0%~9 0% B;29~29.5 min,10% A、90% B;29.5~40 min,10%~90% A、90%~10% B。一次洗脱,得到一个特征峰色谱图,在对应的最大吸收波长处都有类胡萝卜素峰。番茄红素、β-胡萝卜素通过标准品进行鉴定,α-胡萝卜素、γ-胡萝卜素、ε-胡萝卜素、δ-胡萝卜素等类胡萝卜素的定性通过样品保留时间与特征光谱值进行鉴定[22-23]。
1.4 数据分析与统计
所有实验均重复3 次。使用Excel 2021、Origin 2021进行数据处理与分析,制作相关图表。
2 结果与分析
2.1 ZmLCYb和ZmLCYe的克隆及重组质粒的构建
琼脂糖凝胶电泳结果显示,获得两条特异性条带(图1)。经测序分别得到全长LCYb1 470 bp和LCYe1 611 bp的序列,与GenBank数据库中LCYb基因和LCYe基因序列一致,结合双酶切均有两条目的条带的结果,表明已成功构建重组质粒pET-B、pET-E、pCDF-BE、pGEX-B和pGEX-E。
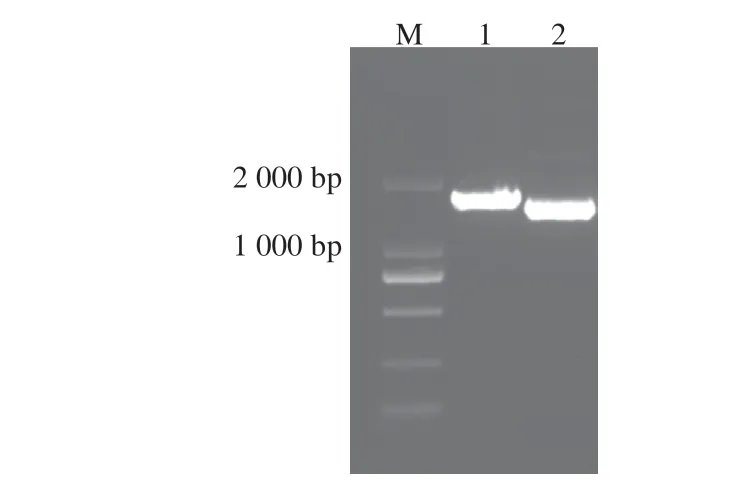
图1 ZmLCYe和ZmLCYb基因的PCR扩增电泳结果Fig.1 Electrophoresis patterns of PCR amplified ZmLCYe and ZmLCYb genes
2.2 ZmLCYb和ZmLCYe生物信息学分析
利用ExPASy的ProtParam工具推测LCYb和LCYe理化性质结果如下:ZmLCYb和ZmLCYe氨基酸序列分别包含490 个氨基酸和537 个氨基酸残基,蛋白分子质量约为53.3 kDa和59.7 kDa,亲水最大值分别为3.314和3.378,疏水最大值分别为2.678和3.044,表明ZmLCYb和ZmLCYe蛋白都为亲水性蛋白。ZmLCYb和ZmLCYe等电点分别为6.87和6.25,呈中性,预测蛋白的不稳定系数分别为45.18%和41.44%,表明ZmLCYb蛋白和ZmLCYe蛋白都为不稳定性蛋白。
首先利用NCBI BLAST对LCYb和LCYe的氨基酸序列进行同源比对,然后利用MEGA 7.0邻接法构建ZmLCYb和ZmLCYe与其他绿色植物、绿藻及微生物来源的番茄红素环化酶同源蛋白系统进化树(图2A和图3A)。结果表明,玉米与高等植物在同一分支,发现玉米LCYb与高粱LCYb和小麦LCYb的氨基酸序列相似性分别为95.75%和83.94%,玉米LCYe与高粱LCYe和小米LCYe的氨基酸序列相似性分别为95.53%和91.48%,推测玉米番茄红素环化酶的功能可能与高粱中的功能相似。跨膜区预测发现LCYb蛋白未跨膜,LCYe蛋白至少存在两处跨膜区域(图2B和图3B)。利用SWISS-MODEL对玉米番茄红素环化酶进行同源建模(图2C和图3C),对所得蛋白质三级结构建模结果进行Verify3D评价,超过80%的氨基酸序列符合评分标准,表明这个三级建模的结果可以信任。
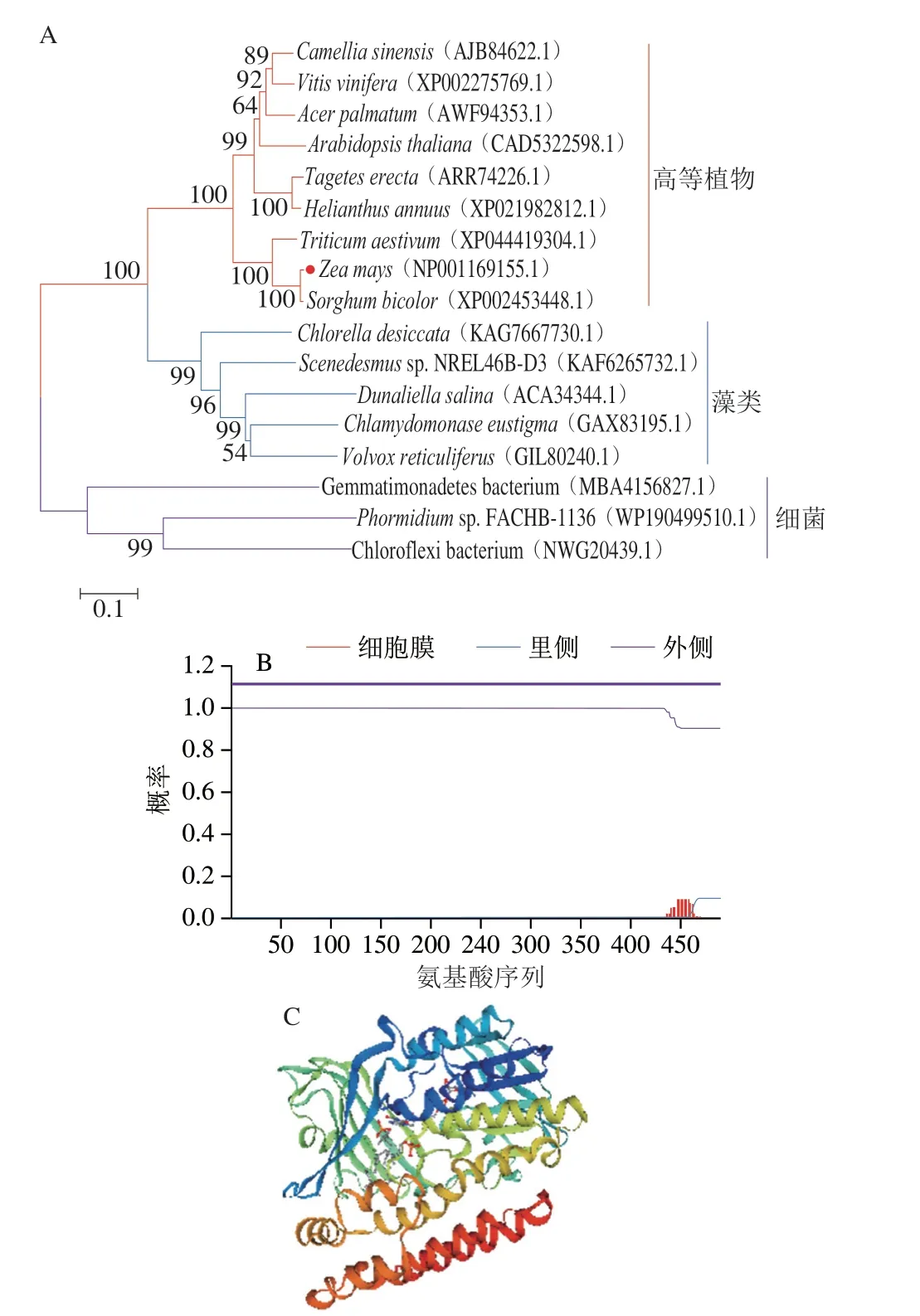
图2 ZmLCYb进化树(A)、跨膜区预测(B)和三级结构预测(C)Fig.2 ZmLCYb evolutionary tree (A), predicted transmembrane region (B) and predicted tertiary structure (C)
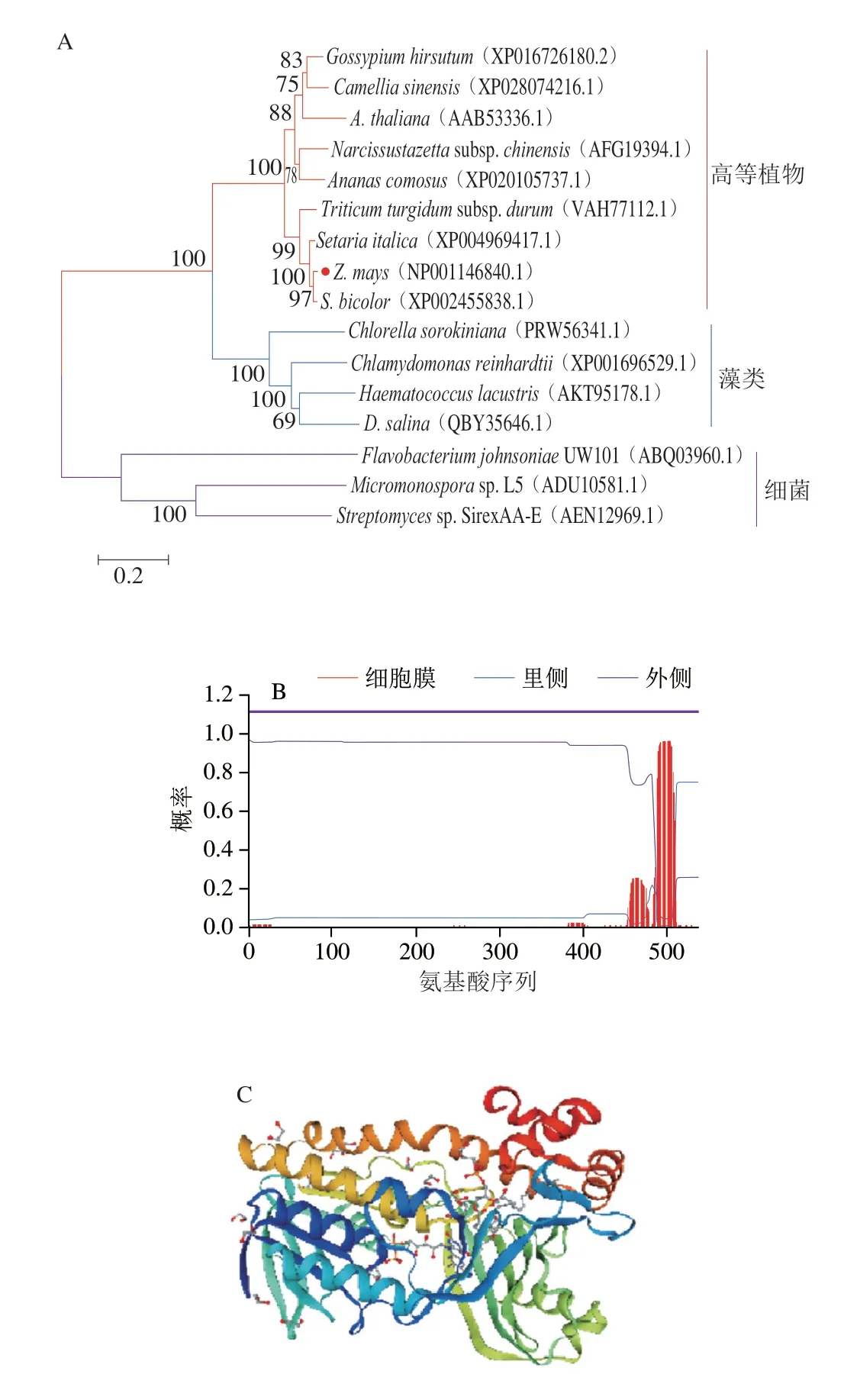
图3 ZmLCYe进化树(A)、跨膜区预测(B)和三级结构预测(C)Fig.3 ZmLCYe evolutionary tree (A), predicted transmembrane region (B) and predicted tertiary structure (C)
2.3 ZmLCYe和ZmLCYb的原核表达
重组大肠杆菌BL21/pGEX-B和BL21/pGEX-E,经诱导表达后在SDS-PAGE中73 kDa和79 kDa左右处可见两条比较明显的蛋白条带(图4)。由于GST标签本身由220 个氨基酸组成,大小约26 kDa,因此电泳图中较粗的两条带与预期的GST-LCYe(约79 kDa)和GSTLCYb(约73 kDa)蛋白大小一致。综上,通过与GST标签的融合,ZmLCYb和ZmLCYe成功在大肠杆菌中表达并纯化。
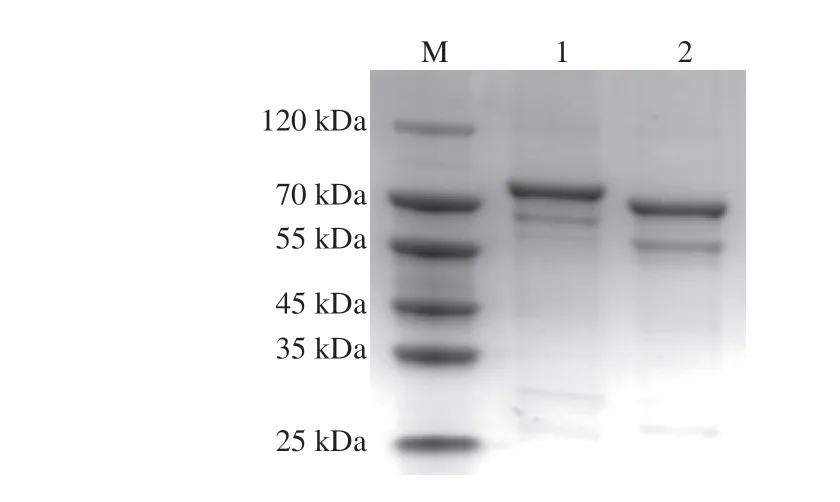
图4 GST-LCYe和GST-LCYb蛋白纯化Fig.4 SDS-PAGE patterns of purified GST-LCYe and GST-LCYb proteins
2.4 玉米番茄红素环化酶的颜色互补鉴定及功能分析
质粒pAC-LYC携带crtE、crtB和crtI基因,可使含有pAC-LYC质粒的重组大肠杆菌BL21(DE3)菌体呈现红色,在此基础上引入ZmLCYb和ZmLCYe外源基因后,由于番茄红素会转化生成不同种类的胡萝卜素,从而导致菌体颜色发生变化,呈现黄色或橙黄色[24]。因此,pET-B、pET-E和pCDF-BE分别转化至重组大肠杆菌BL21(DE3)/pAC-LYC中,通过观察菌体的颜色变化验证ZmLCYb和ZmLCYe的功能(图5A)。作为空白对照组BL21(DE3)/pAC-LYC的菌体呈现出番茄红素特有的红色。与空白对照相比,pET-B与pAC-LYC共转化的菌体呈现黄色,而pET-E与pAC-LYC共转化的菌体呈现橘黄色,此外,pCDF-BE与pAC-LYC共转化的菌体颜色也发生变化。说明LCYb和LCYe基因成功在大肠杆菌中表达并存在一定活性,将番茄红素催化生成不同种类的胡萝卜素。

图5 ZmLCYb和ZmLCYe的功能鉴定Fig.5 Functional identification of ZmLCYb and ZmLCYe
高效液相色谱结果表明,当ZmLCYb与pAC-LYC共表达时,产物主要是β-胡萝卜素,但发现了少量的α-胡萝卜素存在(图5B)。说明ZmLCYb除了具有LCYb活性外,还具有少量LCYe活性。当ZmLCYe与pAC-LYC在大肠杆菌共表达时,产物中主要是单环的δ-胡萝卜素,高效液相色谱并未检测到ε-胡萝卜素。当pCDF-BE与pAC-LYC共转化大肠杆菌中时,主要产物是α-胡萝卜素、β-胡萝卜素和δ-胡萝卜素,还有少量的γ-胡萝卜素和ε-胡萝卜素。说明番茄红素第一步环化得到的单环δ-胡萝卜素和γ-胡萝卜素并不易在体内存在,而是生成更多的α-胡萝卜素和β-胡萝卜素。此外还检测到极少量的ε-胡萝卜素,表明两端都形成ε-环的ε-胡萝卜素不易发生。在玉米番茄红素LCYb和LCYe同时存在的情况下,α-胡萝卜素/β-胡萝卜素比例更高。
3 讨 论
黄色玉米籽粒是类胡萝卜素的良好来源,并且其中部分胡萝卜素可在人体中转变为具有生理活性的VA。Liang Minghua等[25]已经对藻类细菌和植物体内类胡萝卜素的合成与代谢途径进行总结。PSY1是类胡萝卜素生物合成的关键限速酶,在玉米胚乳中过表达可使胚乳总类胡萝卜素含量增加50 倍[26]。Li Qunrui等[27]在玉米中分离出2 个类胡萝卜素异构酶(carotenoid isomerase,CRTISO)基因和2 个β-胡萝卜素羟化酶(β-carotene hydroxylase,BCH)基因,并发现玉米BCH1基因可以使β-胡萝卜素生成β-隐黄质和玉米黄质,而BCH2基因只转化成β-隐黄质;在玉米CRTISO 1存在的情况下,可形成全反式番茄红素异构体。α-胡萝卜素和β-胡萝卜素都是重要的VA的前体物质,研究表明玉米LCYb和LCYe基因表达的相对强弱决定了α-胡萝卜素/β-胡萝卜素的含量比例[28],因此研究番茄红素环化酶功能对深入解析番茄红素环化机制具有重要作用。
本实验以黄色玉米为模板克隆了玉米番茄红素环化酶ZmLCYe和ZmLCYb基因,通过多序列比对构建进化树分析了藻类番茄红素环化酶(crtL)、番茄红素环化酶(crtY)以及植物番茄红素酶(LCY)的同源性。结果表明,不同物种间虽然氨基酸序列的保守模式各不相同,但crtY、crtL和LCY基因通常被认为具有共同的系统起源(细菌crtY),且藻类crtL和植物LCY在结构上具有一定的相似性。序列比对发现玉米与高粱在高等植物中有较为接近的亲缘关系。这些单子叶植物之间的氨基酸是高度保守的,都具有共同特征“FLYAMP”序列和FAD/NAD(P)结合区[29],它们所拥有的LCYe基因和LCYb基因可能是由共同的基因进化而来,且在进化过程中没有改变,推测该保守区域为番茄红素环化酶的功能区,只能使番茄红素的一端环化[30]。
类胡萝卜素生物合成酶大多位于细胞质膜上,存在体外表达不稳定且蛋白表达量少的问题[11]。番茄红素环化酶在大肠杆菌中异源表达时,通常会形成跨膜螺旋结构域的疏水区,使LCYe和LCYb蛋白形成以包涵体形式存在的不溶性聚集体[31]。预实验中使用组氨酸标签构建融合表达蛋白发现纯化后蛋白电泳条带较浅,推测纯化得到的蛋白较少。因此,本研究将目的蛋白与高可溶性GST标签融合,结果发现在电泳胶上约79 kDa和73 kDa处有明显清晰条带,证明GST-LCYe和GST-LCYb蛋白表达并纯化成功,但是含有少量杂带,可能是由于杂蛋白与还原型谷胱甘肽相发生特异性结合。
番茄红素的环化在植物中分成两个分支,其中一个分支番茄红素被催化生成α-胡萝卜素,另一分支则生成β-胡萝卜素。尽管LCYb和LCYe已在多种植物中得到表征,但关于玉米LCYb与LCYe在类胡萝卜素生物合成中的功能信息较少,且目前研究主要集中在单独番茄红素环化酶功能。本研究发现玉米ZmLCYb具有β-环活性,可以分别催化番茄红素、γ-胡萝卜素和δ-胡萝卜素生成γ-胡萝卜素、β-胡萝卜素和α-胡萝卜素。但是重组大肠杆菌BL21(DE3)/pAC-LYC+pET-B产物中还检测到少量的α-胡萝卜素,因此,ZmLCYb同时也具有微弱番茄红素LCYe活性,推测其可以催化γ-胡萝卜素或番茄红素的一端形成了ε-环。研究发现,桂花的OfLCYb具有β-环单环酶的功能,可以将番茄红素全部转化为β-胡萝卜素,产物中未检测到单环γ-胡萝卜素存在[32]。此外,尽管藻类与植物在基因序列存在相似,但是在单细胞红藻中发现BfLCYb能够将番茄红素的一端或两端环化为β-环,但不具有ε-环活性[20]。
在植物中LCYe通常不接受单环胡萝卜素作为底物,而是在番茄红素的一端催化形成单个ε-环[33]。本研究发现ZmLCYe能够在大肠杆菌系统中具有双ε-环活性,催化δ-胡萝卜素形成双环的ε-胡萝卜素,与前期研究发现的玉米LCYe能催化番茄红素的两个末端形成ε-紫罗兰酮环而生成ε-胡萝卜素的结果一致[28]。此外,Bai Ling等[18]在LCYb基因突变失活的玉米中发现δ-胡萝卜素和ε-胡萝卜素为主要的胡萝卜素,推测玉米LCYe具有单环和双环ε-环活性。同样地,地钱LCYe能够催化番茄红素生成单环的δ-胡萝卜素,随后继续催化形成两ε-环的ε-胡萝卜素[34]。本研究通过体外克隆玉米番茄红素环化酶基因ZmLCYe和ZmLCYb,并借助于大肠杆菌表达系统探究了玉米番茄红素环化酶的催化特性,进一步解析了玉米中番茄红素环化酶催化番茄红素生成胡萝卜素的机制。
4 结 论
本实验克隆了玉米LCYe和LCYb基因,发现其与高粱编码LCYb和LCYe基因相似性分别达95.75%和95.53%。通过体外构建原核表达质粒,成功在大肠杆菌表达并纯化了玉米LCYe和LCYb蛋白。玉米LCYb和LCYe在大肠杆菌中表现出一定的活性,可以催化番茄红素生成不同颜色的胡萝卜素。ZmLCYb具有β-环催化活性,可以以番茄红素、γ-胡萝卜素和δ-胡萝卜素作为底物,分别催化生成γ-胡萝卜素、β-胡萝卜素和α-胡萝卜素。同时ZmLCYb也具有微弱ε-环的活性,能够催化番茄红素和γ-胡萝卜素,分别生成δ-胡萝卜素和α-胡萝卜素。ZmLCYe具有ε-环活性,能够催化番茄红素的两端形成双ε-环产生ε-胡萝卜素。本研究不仅为深入解析玉米类胡萝卜素合成调控机制奠定基础,同时为玉米番茄红素环化酶的应用提供了理论参考。

