适度氧化的肌原纤维蛋白与醛类化合物相互作用及机制
代欣欣,吕懿超,殷小钰,窦庆哲,孔保华,陈 倩,*,秦立刚*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.昆明理工大学食品科学与工程学院,云南 昆明 650500;3.东北农业大学动物科学技术学院,黑龙江 哈尔滨 150030)
肉制品的风味会直接影响消费者的接受程度,醛、酮、醇和酯类等挥发性化合物主要源于加工及贮藏过程中碳水化合物的分解和代谢、蛋白和脂质的水解以及脂质的氧化作用[1-3]。其中,肌肉蛋白作为肉及肉制品的主要成分之一,不仅是衡量其营养价值的重要指标,且对肉制品的风味形成有重要的影响。肌原纤维蛋白(myofibrillar proteins,MPs)作为肌肉蛋白的重要组成成分,约占肌肉蛋白总量的55%~65%[4],在肉制品加工特性及品质特性等方面起着至关重要的作用。
肌肉蛋白在肉及肉制品的加工及贮藏过程中会不可避免的受到氧化攻击[5-6]。氧化会导致肌肉蛋白的氨基酸侧链发生化学修饰以及肽骨架结构的改变,进而对蛋白质结构及性质产生影响[7]。适当的氧化处理可以提高蛋白质的乳化性、凝胶性等加工特性,进而改善肉制品的食用品质,还可以促进人体内蛋白酶对蛋白质的水解,有助于消化吸收[8-9]。然而过度的氧化会造成肉制品颜色、质构及风味劣变,以及营养损失[10]。由此可见,蛋白质氧化对肉制品品质具有双面性的影响。
蛋白氧化对风味形成的影响可表现为以下2 个方面:一是对风味物质产生的影响。蛋白氧化既可产生羰基化合物进而形成Strecker醛,又可影响蛋白质的降解程度,进而影响小肽和游离氨基酸等风味物质及前体物质的生成[11-12];二是对风味物质结合的影响。蛋白氧化会导致蛋白质结构的变化,进而影响其与风味化合物的结合能力。周非白[13]研究发现,氧化后MPs结构的改变影响了其结合特征风味物质的能力。汪娟[14]研究了氧化对大豆分离蛋白与风味化合物结合的影响,低氧化程度下有利于大豆分离蛋白与风味化合物的疏水相互作用,而高氧化程度下,大豆分离蛋白对己醛和壬醛的结合能力下降。基于此,本研究建立羟自由基氧化体系(0.1 mmol/L FeCl3,0.1 mmol/L抗坏血酸,H2O2浓度分别选择0、0.25、0.5、1.0、2.5、5.0、10 mmol/L和25 mmol/L),研究不同氧化程度对MPs与4 种典型醛类化合物(3-甲基丁醛、戊醛、己醛和庚醛)相互作用的影响及机制。采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术对MPs与醛类的结合能力进行测定,并采用紫外光谱、荧光光谱、荧光猝灭分析、热力学分析、同步荧光光谱和圆二色谱对氧化的MPs与醛类的作用机制进行分析,以期为肉制品的风味调控提供理论基础和技术指导。
1 材料与方法
1.1 材料与试剂
市购新鲜猪背最长肌取自按GB/T 17236—2019《畜禽屠宰操作规程 生猪》屠宰的哈尔滨白猪(平均月龄6 个月),用盛有碎冰的保温盒将原料肉运回实验室后,立即使用。
3-甲基丁醛、戊醛、己醛和庚醛 美国Sigma公司。氯化铁、抗坏血酸、过氧化氢等化学试剂均为分析纯。
1.2 仪器与设备
ME204E电子分析天平 梅特勒-托利多(上海)有限公司;FK-A(JJ-2)组织捣碎机 常州普天仪器制造有限公司;L720R-3高速冷冻离心机 湖南湘仪实验仪器开发有限公司;PB-10 pH计 赛多利斯公司;TU-1800紫外-可见光分光光度计 北京普析通用仪器有限责任公司;F-7100荧光分光光度计 日本日立公司;Chirascan圆二色光谱仪 英国应用光物理公司;GCMS-QP 2020 NX GC-MS联用仪 日本岛津公司。
1.3 方法
1.3.1 MPs的提取
参照Chen Qian等[15]的方法,将猪背最长肌剔除外部脂肪和结缔组织,切碎称质量,加入4 倍体积的提取液(10 mmol/L Na2HPO4、10 mmol/L NaH2PO4、0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸,pH 7.0),用组织捣碎机搅碎,离心(3 500 r/min,15 min),重复上述操作2 次,取沉淀加入4 倍体积0.1 mol/L NaCl洗液,搅碎,离心(3 500 r/min,15 min),重复上述操作1 次,取沉淀再加入4 倍体积洗液,搅碎,4 层纱布过滤,用1.0 mol/L HCl调整滤液pH值至6.0,离心(3 500 r/min,15 min),整个提取过程于4 ℃条件下进行,得到的MPs于2~4 ℃保存。采用双缩脲法用牛血清蛋白制作标准曲线对蛋白浓度进行测定,用于后续研究。
1.3.2 MPs的氧化处理
参照Li Chunqiang等[16]的方法稍作修改,采用羟基自由基氧化体系,主要由FeCl3、抗坏血酸和H2O2通过铁的氧化还原反应而产生自由基。体系中FeCl3和抗坏血酸的浓度为固定值,即0.1 mmol/L FeCl3和0.1 mmol/L抗坏血酸,H2O2浓度分别选择0、0.25、0.5、1.0、2.5、5、10 mmol/L和25 mmol/L。用含有上述氧化体系的20 mmol/L磷酸盐缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、0.6 mol/L NaCl,pH 6.0)将提取的MPs质量浓度调整为20 mg/mL。然后将样品放置在4 ℃氧化6 h,以得到不同氧化程度的MPs。最后,通过添加2,6-二叔丁基对甲酚(1 mmol/L)终止氧化反应。未经任何处理的蛋白为对照组。
1.3.3 结合能力测定
顶空风味化合物的含量测定参照Wang Haitang等[17]的方法稍作修改。用固相微萃取法结合GC-MS测定。将8 mL经氧化处理的MPs(6 mg/mL)置于20 mL的顶空萃取瓶中,加入4 种醛类,调节其终质量浓度为5 mg/L,用PTEE硅胶隔垫密封。空白组用20 mmol/L磷酸盐缓冲液替代MPs,其余保持一致。萃取瓶置于30 ℃平衡12 h后,用固相微萃取头在30 ℃条件下萃取30 min,富集挥发性化合物,然后将萃取头在进样口220 ℃解吸附5 min,用GC-MS对萃取物进行分离鉴定。
GC条件:InertCapWaX惰性毛细管气相色谱柱(0.25 mm×60 m,0.25 μm);载气为氦气,流速1 mL/min;起始温度38 ℃,保持6 min,6 ℃/min 升温至105 ℃,随后以15 ℃/min升温至220 ℃,保持5 min。
MS条件:电子电离源,正离子模式;离子源温度200 ℃;电子能量为70 eV;质量扫描范围m/z35~350。蛋白样品顶空风味化合物含量以百分比表示(设定空白组中顶空的风味化合物含量为100%)。按式(1)、(2)计算:
1.3.4 相互作用机制研究
1.3.4.1 蛋白样品制备
选取MPs与4 种醛类结合能力最强所用的H2O2浓度,对MPs进行氧化处理。取0.5 mL经氧化处理的MPs(6 mg/mL)分别与不同体积(0、50、100、150、200 μL和250 μL)的醛类化合物储备液(100 mg/L)混合,使醛类化合物的终质量浓度分别为0、1、2、3、4 mg/L和5 mg/L;然后,用磷酸盐缓冲液补充至体系体积为5 mL,涡旋混匀,置于相应的温度反应后进行紫外光谱、荧光光谱和圆二色谱分析。
1.3.4.2 紫外光谱分析
参照申辉[18]的方法稍作修改,将1.3.4.1节配制的样品分别置于(20±1)℃反应30 min。磷酸盐缓冲液作为基线,扫描范围190~400 nm,每个样品扫描3 次。
1.3.4.3 荧光光谱、荧光猝灭及热力学分析
参照Shen Hui等[19]的方法稍作修改,将1.3.4.1节配制的样品分别置于293、303 K和310 K反应40 min后进行荧光光谱分析。发射荧光光谱条件:激发和发射波长的狭缝宽度均为5 nm,激发波长为280 nm,扫描范围为240~450 nm。同步荧光光谱条件与发射荧光光谱类似,在激发波长和发射波长间隔Δλ=15 nm和Δλ=60 nm时分别进行扫描。
采用Stern-Volmer方程进行荧光猝灭分析,如式(3)所示:
式中:F0为未添加猝灭剂时蛋白的荧光强度;F为添加猝灭剂时蛋白的荧光强度;Kq为猝灭速率常数/(L/(mol•s));Ksv为猝灭常数/(L/mol);[Q]为猝灭剂浓度/(mol/L);τ0为未添加猝灭剂时生物大分子的荧光寿命(平均值约为10-8s)。
采用Stern-Volmer改进方程及Van’t Hoff方程进行热力学分析,如式(4)~(6)所示:
式中:F0为未添加猝灭剂时蛋白的荧光强度;F为添加猝灭剂时蛋白的荧光强度;Ka为结合常数;n为结合位点数;[Q]为猝灭剂浓度/(mol/L)。
式中:K为相应温度下的结合常数Ka;ΔH为焓变;ΔS为熵变;ΔG为吉布斯自由能变;R为气态常数(8.314 J/(mol•K));T为热力学温度。
1.3.4.4 圆二色谱分析
参照Zhang Chao等[20]的方法,将1.3.4.1节配制的样品分别置于(20±1)℃反应40 min。在Chirascan光谱仪上获得圆二色谱,用磷酸盐缓冲液作背景,每个样品扫描3 次,扣除背景后求平均值。圆二色谱在室温下进行扫描,氮气(N2)充当保护气,扫描范围200~260 nm,扫描速率120 nm/min,扫描间隔1 nm。氨基酸残基的平均摩尔分子质量为110 g/mol。使用Chirascan光谱仪提供的CDNN程序计算蛋白质的二级结构相对含量。
1.4 数据处理
2 结果与分析
2.1 结合能力分析
如图1所示,不含蛋白的空白组中风味化合物的顶空含量为100%,当顶空含量小于100%时,则表示蛋白对风味化合物有相互作用。风味化合物的顶空含量越小,表明蛋白对其的结合能力越强[21]。对照组中3-甲基丁醛、戊醛、己醛和庚醛的顶空含量均小于100%,表明MPs对它们均有结合能力,并且MPs对醛类的结合能力随碳链长度的增加而增大,庚醛>己醛>戊醛=3-甲基丁醛。在4 种醛类中,庚醛与MPs的结合能力最强(P<0.05),这可能是碳链较长的化合物具有较小的空气/水分配系数(化合物更难在气相中分散,更容易在水相中结合蛋白质),3-甲基丁醛和戊醛与MPs的结合能力没有显著性差异,这是由于3-甲基丁醛(1.08×10-2)的空气/水分配系数相对低于戊醛(1.31×10-2),更容易在水相中结合蛋白质,而3-甲基丁醛又表现出空间位阻效应,会阻止其与蛋白质结合,这些原因相互作用下使得3-甲基丁醛和戊醛与MPs的结合能力没有显著性差异[17]。另外,随着氧化程度的增加,除了3-甲基丁醛,3 种醛类的顶空含量均呈现先降低后增加的趋势,表明戊醛、己醛和庚醛与MPs的结合能力先增加后降低,并在1.0 mmol/L H2O2氧化处理时MPs与4 种醛的结合能力达到最大(P<0.05)。低氧化程度下(H2O2≤1.0 mmol/L),MPs对4 种醛的结合能力随着氧化程度的增加而增强,可能是由于低强度的氧化使得MPs结构展开,暴露出内部的疏水性氨基酸,增强了MPs与4 种醛的疏水相互作用[18]。然而,高氧化程度下(H2O2≥1.0 mmol/L),随着氧化程度的加深MPs与4 种醛的结合能力降低,可能是由于过度的氧化使蛋白质发生聚集[13],阻碍了MPs与4 种醛的结合[14]。

图1 不同氧化程度处理对MPs与4 种醛类化合物结合能力的影响Fig.1 Effects of different oxidation levels on the binding capacity of MPs with four selected aldehydes
2.2 紫外光谱分析
由2.1节中结合能力分析结果可知,H2O2浓度为1.0 mmol/L时MPs结合4 种醛类的能力最强,因此后续相互作用机制研究均采用1.0 mmol/L H2O2氧化处理MPs。紫外光谱是一种用来研究蛋白质结构变化的有效方法,其谱图变化可以用来衡量生物分子之间是否发生了相互作用[22-23]。由图2可知,MPs在波长208 nm和280 nm附近有2 个特征吸收峰。208 nm的峰源于蛋白质内部的肽键,280 nm的峰源于蛋白质内部的芳香族氨基酸(色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸)残基[24-25]。经预实验可知,4 种醛类在200~400 nm范围均没有明显的吸收峰。随着醛类质量浓度增加,MPs在波长208 nm附近的吸收峰发生了波动,说明4 种醛类均改变了MPs的构象,即4 种醛类与MPs发生了相互作用。然而,MPs在波长280 nm附近的吸收峰没有明显改变,表明4 种醛类与MPs未形成稳态复合物,即其与MPs发生了动态猝灭[26]。

图2 经1.0 mmol/L H2O2氧化处理的MPs与不同浓度3-甲基丁醛(A)、戊醛(B)、己醛(C)和庚醛(D)作用后的紫外吸收光谱Fig.2 UV absorption spectra of MPs treated with 1.0 mmol/L H2O2 and various concentrations of 3-methyl butanal (A), pentanal (B),hexanal (C) or heptanal (D)
2.3 荧光光谱分析
荧光光谱法被广泛应用于研究蛋白与小分子的相互作用,可以反映蛋白质的三级结构变化情况[27-28]。如图3所示,MPs的发射荧光强度在波长340 nm附近达到最大值,且随着4 种醛类质量浓度的增加,MPs的发射荧光强度呈现降低的趋势。经过预实验得知,4 种醛类均无荧光强度,这一结果表明4 种醛类猝灭了MPs的荧光,MPs与4 种醛类之间发生了相互作用[29]。这与周非白[13]的结论相同,随着3-甲硫基丙醛添加量的增大,MPs的荧光强度逐渐减弱。
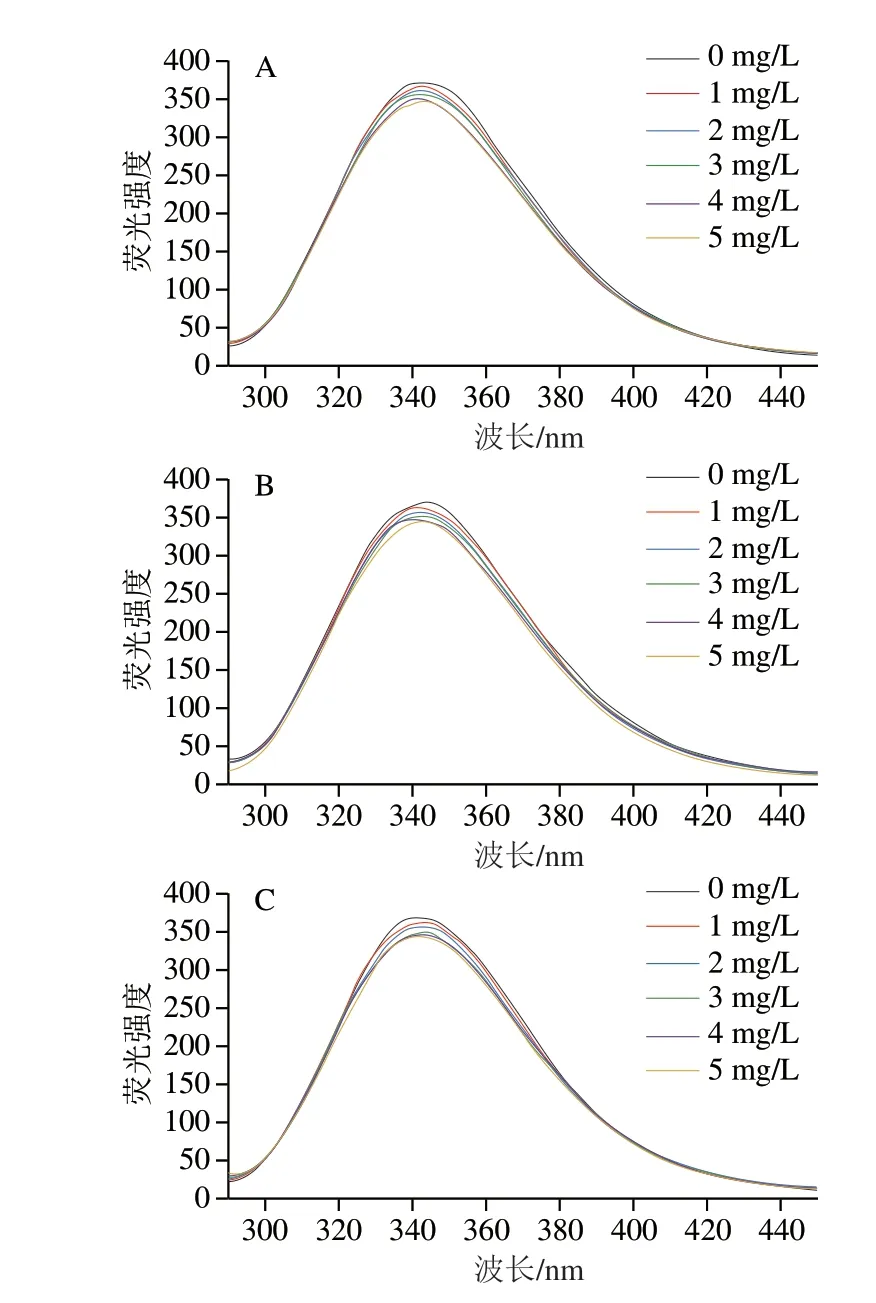

图3 经1.0 mmol/L H2O2氧化处理的MPs与不同质量浓度的3-甲基丁醛(A)、戊醛(B)、己醛(C)和庚醛(D)相互作用的荧光光谱Fig.3 Fluorescence spectra of MPs treated with 1.0 mmol/L H2O2 and various concentrations of 3-methyl butanal (A), pentanal (B),hexanal (C) or heptanal (D)
2.4 荧光猝灭分析
荧光猝灭包括静态猝灭和动态猝灭,或2 种猝灭组合。静态猝灭是指猝灭剂与蛋白荧光团形成无荧光基态的复合物,而动态猝灭则源于激发态猝灭剂与蛋白荧光团之间的碰撞[30]。由2.3节荧光光谱分析可知,4 种醛类猝灭了MPs的固有荧光,因此利用Stern-Volmer方程进一步探索猝灭的机制。如图4所示,4 条曲线都呈现良好的线性关系,3-甲基丁醛、戊醛、己醛和庚醛的拟合优度分别为0.993 2、0.970 7、0.981 7和0.985 1。如表1所示,Stern-Volmer方程的斜率为猝灭常数Ksv,经计算3-甲基丁醛、戊醛、己醛和庚醛的Ksv分别为1.15×103、1.37×103、1.64×103L/mol和2.75×103L/mol。通过Ksv进一步计算可得到猝灭速率常数Kq,3-甲基丁醛、戊醛、己醛和庚醛分别为1.15×1011、1.37×1011、1.64×1011L/(mol•s)和2.75×1011L/(mol•s),均远大于生物大分子的最大动态扩散猝灭常数2×1010L/(mol•s),表明这4 种醛类引发的MPs荧光猝灭是静态猝灭[17,31]。结合2.2节紫外光谱结果可知,4 种醛类与MPs发生了动态猝灭,加之荧光猝灭分析,说明4 种醛类与MPs的相互作用是静态猝灭和动态猝灭相结合的作用机制。

表1 经1.0 mmol/L H2O2氧化处理的MPs与4 种醛类化合物的Stern-Volmer方程中猝灭常数Ksv和猝灭速率常数KqTable 1 Quenching constant (Ksv) and quenching rate constant (Kq) in Stern-Volmer plots for MPs treated with 1.0 mmol/L H2O2 by four aldehydes

图4 经1.0 mmol/L H2O2氧化处理的MPs与4 种醛类化合物发生猝灭的Stern-Volmer方程Fig.4 Stern-Volmer plots for quenching of MPs treated with 1.0 mmol/L H2O2 by various concentrations of four aldehydes
2.5 热力学分析
4 种醛类与MPs的相互作用机制相同,且庚醛与MPs的结合能力最强,因此后续以庚醛为代表,对其与MPs相互作用机制进行进一步探究。在发生静态猝灭的情况下,当小分子独立地与蛋白质上一组等效位点结合时,其结合常数(Ka)和结合位点数(n)可通过Stern-Volmer改进方程获得[32],本实验改进方程如图5所示。由表2可知,在3 个温度条件下的n值约为1,Ka保持在104L/mol的量级范围内,这说明MPs与庚醛的亲和力适中[33-34]。

表2 经1.0 mmol/L H2O2氧化处理的MPs与庚醛猝灭的改进Stern-Volmer方程中结合常数Ka和结合位点数nTable 2 Binding constant (Ka) and binding site number (n) in modified Stern-Volmer plots for MPs treated with 1.0 mmol/L H2O2 by heptanal

图5 经1.0 mmol/L H2O2氧化处理的MPs在不同温度下与庚醛发生猝灭的Stern-Volmer改进方程Fig.5 Modified Stern-Volmer plots for quenching of MPs treated with 1.0 mmol/L H2O2 by heptanal at different temperatures
小分子配体通过4 种结合模式与生物大分子结合,分别是范德华力、疏水相互作用、氢键和静电相互作用,这4 种结合模式可通过热力学分析中的焓变ΔH和熵变ΔS值进行区分[35]:1)当ΔH>0和ΔS>0时为疏水相互作用;2)当ΔH<0和ΔS<0时为范德华力和氢键;3)当ΔH<0和ΔS>0时为静电相互作用[30]。对于较小的温度变化,ΔH可被视为常数,并可根据lnK与1/T的曲线斜率计算。由表3可知,ΔG<0表明MPs和庚醛之间的相互作用是自发的。此外,ΔH>0和ΔS>0还表明MPs与庚醛之间的相互作用靠疏水相互作用驱动。

表3 经1.0 mmol/L H2O2氧化处理的MPs与庚醛相互作用的相关热力学参数Table 3 Thermodynamic parameters for interaction of MPs treated with 1.0 mmol/L H2O2 and heptanal
2.6 同步荧光光谱分析
蛋白质固有荧光的变化可以反映荧光团周围微环境的变化,而Tyr和Trp残基对其所处微环境极为敏感,Δλ=15 nm和Δλ=60 nm分别代表Tyr和Trp残基的光谱特征[36-37]。在同步荧光光谱中,峰的红移表示荧光团所处的微环境极性增强,疏水性减弱;蓝移表示微环境疏水性增强,极性减弱[38]。由图6可知,随着庚醛质量浓度的增加,Tyr和Trp残基的最大吸收峰均发生红移,表明MPs的Tyr和Trp残基暴露在更亲水的环境中。也就是说,Tyr和Trp残基周围的微环境极性增加,疏水性减弱。MPs中与庚醛结合的位置可能在Tyr和Trp残基附近。基于以上分析,推测庚醛与MPs的结合会影响MPs的构象。

图6 经1.0 mmol/L H2O2氧化处理的MPs与不同质量浓度庚醛作用后的同步荧光光谱Fig.6 Synchronous fluorescence spectra for interaction of MPs treated with 1.0 mmol/L H2O2 and various concentrations of heptanal
2.7 圆二色谱分析
采用圆二色谱进一步分析4 种醛类对MPs构象的影响,经1.0 mmol/L H2O2氧化处理的MPs与4 种醛类作用后的圆二色谱如图7所示。MPs的圆二光谱在208 nm和222 nm处有2 个负峰,这是α-螺旋结构中肽键的n-π*跃迁所致[39-40]。

图7 经1.0 mmol/L H2O2氧化处理的MPs与不同质量浓度3-甲基丁醛(A)、戊醛(B)、己醛(C)和庚醛(D)作用后的圆二色谱Fig.7 CD spectra of MPs treated with 1.0 mmol/L H2O2 before and after interaction with various concentrations of 3-methyl butanal (A),pentanal (B), hexanal (C) or heptanal (D)
添加4 种醛类后MPs的圆二色谱呈现相同的变化趋势,以庚醛为例计算MPs中二级结构的变化情况。如表4所示,随着庚醛质量浓度的增加,α-螺旋相对含量从19.24%下降至16.88%(P<0.05),β-折叠相对含量从24.59%增加至26.47%(P<0.05),这说明MPs的结构由有序状态向无序状态转变[17,27]。α-螺旋相对含量的减少说明庚醛能与MPs中的氨基酸残基相互作用,破坏氢键(包括分子内氢键);此外,α-螺旋相对含量的减少可能使MPs内部的疏水性基团暴露[41-42],这一结果与同步荧光光谱结果(红移)相一致。总体而言,MPs与庚醛的相互作用改变了MPs的二级结构。

表4 经1.0 mmol/L H2O2氧化处理的MPs与不同质量浓度庚醛作用后二级结构的变化Table 4 Secondary structural changes of MPs treated with 1.0 mmol/L H2O2 before and after interaction with various concentrations of heptanal
3 结 论
本研究建立了羟自由基氧化体系,探究不同氧化程度的MPs与3-甲基丁醛、戊醛、己醛和庚醛的相互作用。结果表明,庚醛与MPs的结合能力最强,且H2O2浓度为1.0 mmol/L时MPs与4 种醛类结合能力最强,说明适度氧化可以促进MPs与醛类化合物的相互作用,热力学分析进一步揭示了疏水相互作用是维持两者结合的主要驱动力。紫外光谱及荧光光谱分析表明,醛类通过静态和动态猝灭相结合的机制猝灭MPs的荧光;同步荧光光谱特征峰的红移和α-螺旋相对含量的降低进一步证实了MPs中的氨基酸残基与醛类发生了相互作用。本研究从分子水平揭示了MPs与醛的相互作用机制,为肉制品的风味调控提供了理论基础及技术支持。

