ADNEX模型融入O-RADS超声风险分层在良恶性卵巢肿块鉴别诊断中的应用价值▲
林紫晴 罗 慧 冯艳萍 王玉莹 刘小燕 温晓怡
(佛山市妇幼保健院1 功能科,2 病理科,广东省佛山市 528000)
卵巢癌是女性生殖系统三大恶性肿瘤之一,调查显示,全球每年卵巢癌新发病例313 959例,死亡病例207 252例[1-2],大多数国家卵巢癌患者的5年生存率仅为30%~40%[3]。早发现、早治疗是提高卵巢癌患者生存率的关键。虽然超声检查是目前诊断卵巢肿瘤的首选影像学方法,但卵巢肿瘤的超声图像特征差异性较大,目前尚无统一的诊断标准,且对操作者的要求较高,故超声检查在术前评估卵巢肿瘤的良恶性、亚分类及恶性分期方面的效果仍不理想[4]。2020年,美国放射学会发布的卵巢-附件报告和数据系统(Ovarian-Adnexal Reporting and Data System,O-RADS)超声风险分层与管理共识指南提出,将O-RADS超声风险分层与不同类型附件肿瘤的评价(Assessment of Different Neoplasias in the Adnexa,ADNEX)模型相结合,可以同时发挥两种诊断模型的优势[5-6],但目前国内尚无采用该诊断方法评估卵巢肿瘤性质的相关研究报告。本研究探讨ADNEX模型融入O-RADS超声风险分层在鉴别良恶性卵巢肿块中的应用价值。
1 资料与方法
1.1 临床资料 回顾性分析2019年1月至2021年12月在佛山市妇幼保健院行彩色多普勒超声检查发现卵巢肿块并接受手术治疗的311例患者的临床资料。纳入标准:一般临床资料完整;术前1周内在本院完成经阴道或经直肠超声检查,并有完整、清晰、可供调阅分析的超声图像;具有术前血清糖类抗原125(carbohydrate antigen 125,CA125)水平检测结果;术后有明确的病理结果,若为恶性肿瘤有明确的肿瘤分期。排除标准:合并正常或异常妊娠。311例患者的年龄为15~85(39.10±12.09)岁,主要临床症状包括腹痛、阴道异常出血、腹胀、不孕等。本研究已通过佛山市妇幼保健院医学伦理委员会审查批准。
1.2 检查仪器与检查方法 检查仪器为UGEO WS80A彩色多普勒超声诊断仪(SAMSUNG公司)、Aplio300彩色多普勒超声诊断仪(Canon 公司)、 Resona 8 Elite彩色多普勒超声诊断仪(深圳迈瑞生物医疗电子股份有限公司),腔内探头频率为3 MHz~10 MHz,腹部探头频率为1 MHz~5 MHz。对于未婚女性,在征得其同意后行清洁灌肠,再使用腔内探头行经直肠超声检查;对于已婚女性,嘱其排尿后取膀胱截石位,再使用腔内探头行经阴道超声检查。若病灶较大(病灶直径>10 mm),可配合经腹部超声检查。从影像归档和通信系统调取患者的超声图像,记录肿块的位置、大小、边缘、内部回声、后方回声改变、彩色血流,以及是否存在腹水情况等。血清CA125水平的检测由本院检验科采用Alinity i全自动分析仪完成(Abbott Laboratories公司)。
1.3 诊断标准 由3名从事妇科超声工作10年以上的医生分别利用3种评估方法进行评估,评估前均不了解患者的病理结果。每名医生评估前均接受ADNEX 模型及O-RADS超声风险分层的相关培训。对于单侧多个病灶或双侧病灶,需要对每个病灶进行单独评估。
1.3.1 ADNEX 模型的诊断标准:打开ADNEX模型在线分析软件(http://www.iotagroup.org/adnexmodel/),录入相关变量,包括年龄(岁)、诊治中心的类别(肿瘤中心或综合医院)、肿瘤最大径(mm)、实性部分最大径(mm)、囊腔是否>10个、乳头数目、肿块后方有无声影、有无腹水、血清CA125水平(U/mL)。点击“分析”后,ADNEX 模型自动判断肿块的良恶性,结果以恶性率(%)、良性率(%)表示,当恶性率>良性率时说明肿块为恶性病变的可能性更大。
1.3.2 O-RADS超声风险分层的诊断标准:根据美国放射学会的O-RADS超声风险分层与管理共识指南[5-6],将卵巢肿块超声风险分为6类(O-RADS 0~5类)。O-RADS 0类为受外界或患者自身因素影响,无法完成检查,不能进行评价;O-RADS 1类为正常卵巢(恶性风险0);O-RADS 2类为几乎可以肯定的良性病变(恶性风险<1%);O-RADS 3类为恶性低风险病变(1%≤恶性风险<10%);O-RADS 4类为恶性中等风险病变(10%≤恶性风险<50%);O-RADS 5类为恶性高风险病变(恶性风险≥50%)。O-RADS 4类及以上即可判定为卵巢恶性肿块[7]。
1.3.3 ADNEX模型融合O-RADS超声风险分层的诊断标准:首先根据O-RADS超声风险分层将直径<10 cm的典型良性病变或直径<10 cm的单纯囊肿归为O-RADS 2类,即判定为良性病变,对于其余肿块,利用ADNEX模型判断良恶性。
1.4 统计学分析 应用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示;计数资料以例数或百分比表示,组间比较采用χ2检验。以病理结果为金标准,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC)、敏感度、特异度、阳性预测值、阴性预测值及约登指数,评价ADNEX 模型、O-RADS超声风险分层及二者联合鉴别诊断良恶性卵巢肿块的价值。以P<0.05为差异有统计学意义。
2 结 果
2.1 311例患者的病理结果 311例患者共计340个卵巢肿块,术后病理结果证实为良性肿块263个、恶性肿块77个,见表1。

表1 340个卵巢肿块的病理结果
2.2 ADNEX模型、O-RADS超声风险分层及ADNEX模型融入O-RADS超声风险分层对良恶性卵巢肿块的鉴别诊断价值 ADNEX 模型、O-RADS超声风险分层及ADNEX模型融入O-RADS超声风险分层鉴别诊断良恶性卵巢肿块的AUC分别为0.899、0.861、0.904,三者比较差异无统计学意义(P>0.05),但ADNEX模型融入O-RADS超声风险分层的特异度及阳性预测值高于另外两种方法(P<0.05),见图1、表2、表3。
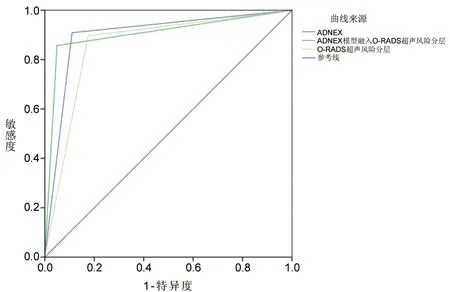
图1 3种方法鉴别诊断良恶性卵巢肿块的ROC曲线图
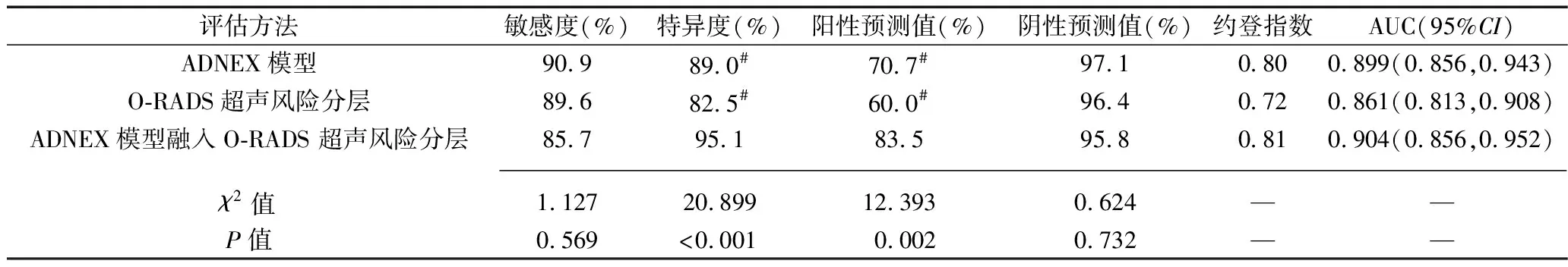
表2 3种方法对良恶性卵巢肿块的鉴别诊断效能

表3 3种方法鉴别诊断良恶性卵巢肿块的AUC比较
2.3 典型病例分析 病例1,患者15岁,以腹痛为主诉入院。入院血清CA125水平为399.2 U/mL,超声检查提示下腹部有一稍高回声光团,最大径为83 mm,内见散在不规则液暗区及点条样血流信号,腹腔见游离液性暗区,见图2A、图2B。术后病理结果为卵巢卵黄囊瘤,见图2C(HE染色,×40)。临床诊断右侧卵巢卵黄囊瘤蒂扭转合并破裂出血(Ⅳ期)。

图2 病例1的超声图像和病理结果图
病例2,患者51岁,以阴道不规则出血为主诉入院。入院时血清CA125水平为5 305.9 U/mL,超声提示子宫后方有一囊实性包块,大小约为163 mm×101 mm×128 mm,边界清,壁厚薄不均,内见密集的大小不等的实性高回声团及不规则网格样液性暗区,后方回声增强,彩色多普勒血流显像显示包块周边及内部有少许血流信号,见图3A、3B、3C。术后病理结果为卵巢透明细胞癌,见图3D(HE染色,×40)。临床诊断为卵巢透明细胞癌(Ⅳb期)。
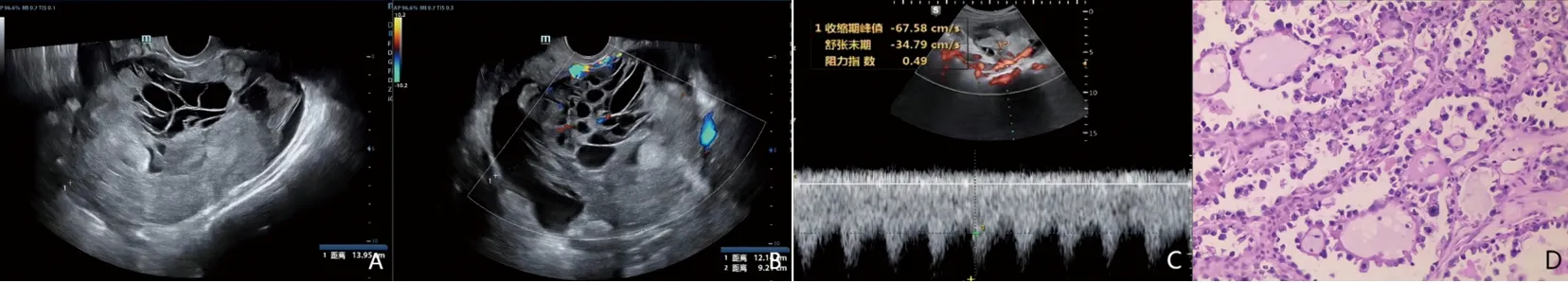
图3 病例2的超声图像和病理结果图
病例3,患者36岁,因常规体检发现附件包块入院。入院时血清CA125水平为246.9 U/mL,经阴道超声检查提示子宫右后方有一混合回声团,最大径为62 mm,形态不规则,内见无回声及稍强回声区,周边及稍高回声区内未见明显血流信号,见图4A、4B。ADNEX模型评估其恶性率为81.0%,见图4C;当取消实性部分最大径、乳头数目及血清CA125水平这3个变量后,恶性率降低至3.4%,见图4D。术后病理结果为卵巢子宫内膜异位症。

图4 病例3的超声图像和ADNEX模型分析结果图
病例4,患者27岁,以下腹痛3 d为主诉入院。入院时血清CA125水平为276.6 U/mL,超声检查提示附件区有不规则低回声团,最大径为39 mm,低回声团内血流信号2级,周边网膜回声增强,见图5A、5B。ADNEX模型评估其恶性率为63.2%,见图5C;取消血清CA125水平这一变量后,恶性率降低至35.0%,见图5D。术后病理结果为输卵管积脓。
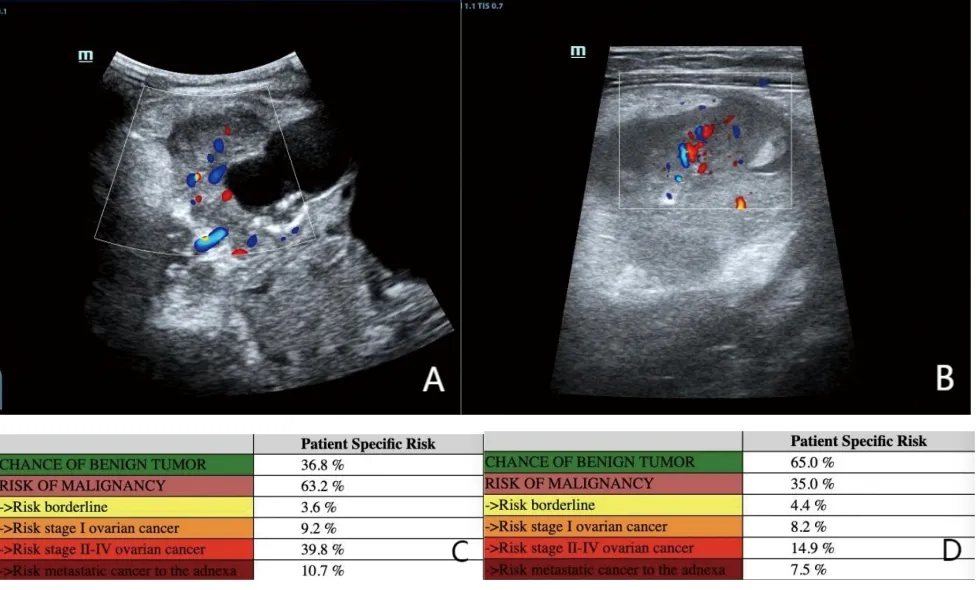
图5 病例4的超声图像和ADNEX模型分析结果图
3 讨 论
随着计算机技术及影像技术的飞速发展,在临床实践中使用计算机算法辅助分析已经成为未来医学影像学发展的趋势[8]。目前,国内外用于评估卵巢肿瘤良恶性的影像学系统主要包括卵巢肿瘤恶性风险指数、妇科影像报告和数据系统、国际卵巢肿瘤分析(International Ovarian Tumor Analysis,IOTA)系统及O-RADS超声风险分层。有学者比较了各种诊断系统的诊断效能,发现O-RADS超声风险分层在鉴别诊断卵巢肿瘤性质方面具有更高的敏感性[9],且该诊断系统以特征性词汇描述典型良性病变,如出血性囊肿、皮样囊肿、内膜异位囊肿、输卵管积水等,对病变特征的描述更为规范、统一[10],但是其不能对卵巢恶性肿瘤进行术前肿瘤分期。IOTA系统的ADNEX模型是首个对卵巢肿瘤进行亚分类的诊断模型,具有较高的阴性预测值,可作为排除恶性肿瘤的有效工具[11]。2020年O-RADS超声风险分层与管理共识指南提出将O-RADS超声风险分层与ADNEX模型相融合,可提高对卵巢肿瘤的诊断效能。
本研究的ROC曲线分析结果显示,ADNEX模型、O-RADS超声风险分层及ADNEX模型融入O-RADS超声风险分层鉴别诊断良恶性卵巢肿块的AUC分别为0.899、0.861、0.904,均具有良好的诊断效能,虽然三者的AUC差异无统计学意义(P>0.05),但是ADNEX模型融入O-RADS超声风险分层的特异度及阳性预测值高于另外两种方法(P<0.05)。研究显示,单独使用ADNEX模型判断卵巢肿块性质难免会出现假阳性病例,常见情况有以下三类:一是将囊肿内的血凝块误诊为实性组织,如子宫内膜异位囊肿(本研究的病例3)。ADNEX模型没有引入血流参数作为评估指标,虽然可以避免不同仪器因血流参数差异引起的误差,但也会降低其对病灶内实性组织与血凝块的鉴别诊断能力[12]。二是将子宫内膜异位囊肿、卵巢输卵管炎症或脓肿或结核(本研究的病例4)及附件多个不同组织类型肿块(如囊腺瘤合并子宫内膜异位囊肿等)误诊为恶性病变,原因主要为子宫内膜异位症及炎性病变患者的血清CA125水平也会异常增高[13]。三是囊肿破裂引起腹水,特别是子宫内膜异位囊肿破裂或者囊肿破裂合并囊腺瘤时,会因血清CA125水平及腹水两个变量导致ADNEX模型判定卵巢肿块为恶性的风险升高,出现假阳性。而当使用ADNEX模型融入O-RADS超声风险分层时,首先利用O-RADS特征性词汇描述典型良性病变,将输卵管炎性病变及子宫内膜异位囊肿评估为良性病灶,可以提高ADNEX模型的诊断特异度,可作为排除卵巢恶性肿瘤的有效方法,减少患者不必要的恐慌和焦虑。
综上所述,ADNEX模型融入O-RADS超声风险分层对良恶性卵巢肿块具有良好的诊断效能,不仅能提高诊断效能,还能为卵巢肿瘤术前分期提供客观依据。但如何将ADNEX模型得出的恶性率与O-RADS 超声风险分层相匹配,还需要在今后的研究中进一步探讨。

