溶剂萃取法从低品位高黏土浸出液中提取锂的研究
李慧芳,王 晓,白有鹏,张世翔
(青海大学化工学院,青海西宁 810016)
锂是自然界中标准电极电势最低、电化学当量最大、最轻的金属元素,是电池的理想原材料,是天生的“能源金属”,也是新型清洁能源的主要原材料[1-2]。锂在自然界中主要以固体矿和盐湖卤水两种形式存在,其中盐湖锂资源占59%以上[3-4]。中国盐湖卤水主要分布于青海和西藏地区,其显著特点是镁锂比较高,这一特点使得中国盐湖卤水开发无法借鉴国外成熟的技术。此外,青海和西藏的自然环境较为恶劣,湖区生态较为脆弱[5-6],因此,盐湖提锂能否顺利实现大规模工业化生产除了受生产技术的限制,还受限于当地的生态环境。而从固体锂矿中提取分离锂已经有多年开采历史[7-9],且技术较为成熟,但目前高品位的锂矿已基本被开采,如何从现有的低品位锂矿中回收提取锂资源是目前的研究热点。
从低品位锂矿中提取锂首先需要将锂矿溶解得到含锂的浸出液,再从含锂浸出液中进行锂的分离提取。从含锂溶液中分离提取锂的方法主要有沉淀法[10-11]、离子交换法[12-13]、膜分离法[14-15]和溶剂萃取法[16-17]等,溶剂萃取法因对溶液中的锂离子具有较高的选择性、操作简单、易于实现连续化操作和自动化控制等一系列优点备受学者们关注[18-19]。本文中所用高黏土浸出液的主要成分是AlCl3、LiCl 和FeCl3。前期研究表明,TBP-FeCl3萃取体系从含锂溶液中分离提取锂的效果最优[20-22]。同时,水相中含有充足的MgCl2或AlCl3对锂的萃取都是有利的,且AlCl3对锂的作用效果更强[23]。因此,本文采用TBP-FeCl3萃取体系从低品位高黏土浸出液的模拟溶液中开展锂的分离提取实验,分别考察水相组成、负载有机相组成、TBP含量、Fe与Li物质的量比、相比(有机相与水相的体积比)等因素对萃取锂的影响。为了实现萃取有机相的循环使用,对萃取后的有机相进行反萃和再生研究,确定各工艺参数。
1 实验部分
1.1 实验试剂
六水氯化铝、无水氯化锂、六水三氯化铁、六水氯化镁、碳酸氢钠、无水碳酸钠、盐酸、磷酸三丁酯、甲基异丁基酮(MIBK)、乙酸乙酯(EA)、乙酸丁酯(BA)、(2-乙基己基)磷酸单-2-乙基己基酯(P507)、二(2-乙基己基)磷酸酯(P204)、N,N-双(1-甲基庚基)乙酰胺(N503),均为分析纯;煤油,工业级。
1.2 实验仪器
SHA-B 型恒温振荡器;JA50038 型电子天平;DHG9053A型吸热恒温鼓风干燥箱;另外,实验中还使用了移液枪、锥形瓶、容量瓶、漏斗、量筒、烧杯等仪器。
1.3 实验过程
水相的制备:称取一定量的LiCl、AlCl3·6H2O和FeCl3·6H2O 置于烧杯中,加入一定量的去离子水溶解,待彻底溶解后进行过滤,将滤液置于试剂瓶中存放,备用。
负载有机相的制备:首先配制水相,称取一定量的金属卤化物(如NaCl、KCl、MgCl2、AlCl3·6H2O 和FeCl3·6H2O)置于烧杯中,加入一定量的去离子水溶解,待彻底溶解后取溶液过滤,将滤液置于试剂瓶中存放,备用;然后配制有机相,用量筒量取一定体积的萃取剂和稀释剂置于试剂瓶中,混合均匀,备用;最后将配制好的水相和有机相按照一定的相比加入到分液漏斗中,将其置于水浴摇床中振荡10 min,待振荡结束后取出分液漏斗静置分相,待两相彻底分开后将水相由分液漏斗下端出口放出,有机相从分液漏斗上端倒入试剂瓶,即得负载有机相。
1.4 数据处理
萃取率是萃取体系对萃取效果的最直接体现,也是萃取过程的核心考察指标,通过测定萃取前后水相金属离子含量,即可由式(1)计算出金属离子的萃取率E:
式中,ρ0和ρe分别代表萃取前和萃取后水相金属离子的含量,mg/L。
采用溶剂萃取法进行物质的提取分离时,通常采用分配比D表示物质被提取的难易程度。当萃取达到平衡时,被萃取物质在有机相的总浓度与水相的总浓度之比即为D,D的计算式为:
2 结果与讨论
2.1 萃取过程
2.1.1 水相组成对萃取锂的影响
本实验首先制备负载有机相,将80%(体积分数,下同)TBP和20%煤油组成的有机相与2 mol/L MgCl2和0.036 5 mol/L FeCl3组成的水相按照相比为2∶1进行萃取实验,待两相彻底分开后,上层有机相即为负载Mg 的有机相。为了考察水相组成对萃取锂的影响,分别配制水相组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3、0.028 8 mol/L LiCl+2 mol/L AlCl3和0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3,将负载Mg的有机相与水相分别按相比为2∶1进行萃取反应,之后分别将萃取后有机相与6 mol/L HCl 按相比为1∶2 进行反萃实验,实验结果见表1。由表1可知,当水相中仅有LiCl和FeCl3无AlCl3时,锂的萃取率为0,即负载有机相对锂无萃取作用,这可能是因为水相中LiCl和FeCl3浓度仅有0.028 8 mol/L和0.036 5 mol/L,当其与有机相接触时水相中的Li+无法与有机相中的Mg2+进行有效的离子交换,因此有机相对锂几乎没有萃取作用;当水相中仅有LiCl和AlCl3无FeCl3时,锂的萃取率为38.54%,负载有机相对水相的锂有一定的萃取作用,虽然水相中LiCl浓度只有0.028 8 mol/L,但是AlCl3浓度为2 mol/L,水相离子强度增大,增加了水相中Li+与有机相中的Mg2+进行离子交换的概率;当水相中含有LiCl、AlCl3和FeCl3时,锂的萃取率为82.66%,负载有机相对水相的锂有较强的萃取作用,这可能是因为当水相同时含有0.028 8 mol/L LiCl、2 mol/L AlCl3和0.036 5 mol/L FeCl3时,不仅水相的离子强度增大了,还形成了FeCl4-[23],该配阴离子也可与Li+共同被萃入有机相。因此,在后续实验中将水相组成确定为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3。
2.1.2 有机相金属离子种类对萃取锂的影响
为了考察有机相中金属离子种类对萃取锂的影响,本实验首先将80%TBP 和20%煤油组成的有机相分别与饱和NaCl、饱和KCl、3 mol/L MgCl2、2 mol/L AlCl3和0.036 5 mol/L FeCl3组成的水相按照相比为2∶1进行萃取实验,待两相彻底分开后,上层即为负载Na+、K+、Mg2+或Al3+的有机相;然后将4 种负载不同金属离子的有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按相比为2∶1 进行萃取反应,有机相金属离子种类对萃取锂的影响如图1所示。由图1可知,当有机相负载金属离子为Na+、Mg2+、Al3+时,锂的萃取率均超过70%;当金属离子为K+时,锂的萃取率小于60%,有机相中锂离子浓度与锂萃取率呈现出相同的变化趋势。由2.1.1的研究内容可知,负载有机相与水相进行萃取反应时,除了发生离子交换反应还发生了萃取反应。当负载金属离子为Na+、Mg2+和Al3+时,有机相中金属离子与水相Li+进行离子交换反应时,有机相中的Na+、Mg2+和Al3+均会不同程度地进入水相,由于水相所含金属离子主要是Li+、Fe3+和Al3+,当有机相负载金属离子为Na+和Mg2+时,二者在与水相Li+进行离子交换反应时,会将Na+和Mg2+引入水相,当有机相负载金属离子为Al3+时,无论是发生萃取反应还是离子交换反应,均不会将杂质离子引入水相。因此,后续实验将负载Al3+有机相作为萃取锂的有机相。

图1 有机相负载不同金属离子对萃取锂的影响Fig.1 Effect of organic phase loading with different metal ion on lithium extraction
2.1.3 有机相AlCl3浓度对萃取锂的影响
为了考察有机相AlCl3浓度对萃取锂的影响,本实验首先将80%TBP和20%煤油组成的有机相分别与0、0.5、1、1.5、2、3 mol/L AlCl3和0.036 5 mol/L FeCl3组成的水相按照相比为2∶1 进行萃取实验,待两相彻底分开后,上层即为负载不同浓度Al3+的有机相;然后将负载不同浓度Al3+的有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按相比为2∶1 进行萃取反应。有机相AlCl3浓度对萃取锂的影响如图2 所示。由图2 可知,有机相中锂离子浓度和锂的萃取率均随着有机相AlCl3浓度的增加而增加,当AlCl3浓度为2 mol/L时,有机相中锂离子浓度和锂的萃取率基本趋于稳定。这可能是因为制备负载有机相的水相中AlCl3浓度增加,有利于负载有机相中形成更多的FeCl4-配阴离子,该配阴离子的增加对锂的萃取有利[23]。此外,水相过多的AlCl3也会被萃入负载有机相,游离在有机相中的AlCl3在负载有机相和水相发生萃取锂的反应时,还可起到盐析剂的作用。为了保证负载有机相对水相锂离子有较高的萃取率,将制备负载有机相的水相AlCl3浓度确定为2 mol/L。

图2 有机相AlCl3浓度对萃取锂的影响Fig.2 Effect of AlCl3 concentration in organic phase on lithium extraction
2.1.4 有机相TBP浓度对萃取锂的影响
萃取剂浓度在萃取过程中起着非常重要的作用,为了考察有机相TBP浓度对萃取锂的影响,本实验首先将含0、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%(体积分数)TBP 的有机相分别与2 mol/L AlCl3和0.036 5 mol/L FeCl3组成的水相按照相比为2∶1 进行萃取实验,待两相彻底分开后,上层即为负载不同浓度TBP的有机相。然后将负载不同浓度TBP的有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按相比为2∶1 进行萃取反应,有机相TBP 浓度对萃取锂的影响如图3所示。由图3可知,当TBP体积分数低于50%时,锂萃取率和有机相中锂离子浓度均随TBP浓度增加而增加;当TBP体积分数为50%~80%时,锂萃取率和有机相中锂离子浓度基本不变;当TBP 体积分数高于80%时,锂萃取率和有机相中锂离子浓度均随TBP 浓度增加而降低。因此,后续实验将制备有机相的TBP体积分数确定为50%。

图3 有机相TBP浓度对萃取锂的影响Fig.3 Effect of TBP concentration in organic phase on lithium extraction
2.1.5 稀释剂种类对萃取锂的影响
在研究有机相TBP 浓度对萃取锂的影响时发现,当TBP 体积分数低于60%以后,萃取过程中会出现第三相,这是因为煤油为非极性溶剂,萃取过程中形成的萃合物在煤油中的溶解性较差,当TBP 浓度较低时萃合物从有机相中析出即出现第三相,这对于萃取反应和分相都是极为不利的。为了解决第三相出现的问题,本实验分别将组成为50%TBP+50%稀释剂(煤油、MIBK、EA、BA、N503、P507和P204)的有机相与0.036 5 mol/L FeCl3和2 mol/L AlCl3组成的水相按照相比为2∶1 进行萃取实验,待两相彻底分开后,上层即为负载不同稀释剂的有机相,然后将负载不同稀释剂的有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按相比为2∶1 进行萃取反应,稀释剂种类对萃取锂的影响如图4所示。由图4可知,当稀释剂为煤油、MIBK 和BA 时,锂萃取率和有机相中锂浓度较高;当稀释剂为MIBK时两相分相最快,且萃取过程中无第三相产生。因此,后续实验采用MIBK 作为稀释剂。

图4 稀释剂种类对萃取锂的影响Fig.4 Effect of kinds of diluent on lithium extraction
2.1.6 有机相Fe与Li物质的量比对萃取锂的影响
TBP-FeCl3萃取体系从含锂溶液中分离提取Li的过程中FeCl3起着共萃剂的作用。该体系真正起萃取作用的是FeCl4-,FeCl4-和Li+共同被TBP萃入有机相[19]。负载有机相中FeCl4-的主要来源是FeCl3,为了考察有机相FeCl3浓度对萃取锂的影响,本实验首先将组成为50%TBP+50%MIBK 的有机相分别与0、0.014 0、0.028 1、0.036 5、0.042 1、0.047 7、0.056 2、0.084 2 mol/L FeCl3和2 mol/L AlCl3组成的水相按照相比为2∶1进行萃取实验,待两相彻底分开后,上层即为负载不同浓度铁的有机相;然后将负载不同浓度铁的有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按照相比为2∶1进行萃取反应,有机相FeCl3浓度对萃取锂的影响如图5 所示。由图5 可知,随着Fe 与Li 物质的量比(LiCl 浓度为0.028 8 mol/L,改变FeCl3浓度)的增加,有机相中锂浓度和锂萃取率均呈现上升趋势,当Fe 与Li 物质的量比为1.7,即FeCl3浓度为0.047 7 mol/L 时,锂的萃取率和有机相中锂浓度基本趋于稳定。这是因为水相中LiCl 含量是一定的,当TBP 对FeCl4-和Li+的萃取达到极限时,继续增加FeCl3浓度对锂的萃取作用不大。因此,制备负载有机相的FeCl3浓度确定为0.047 7 mol/L。
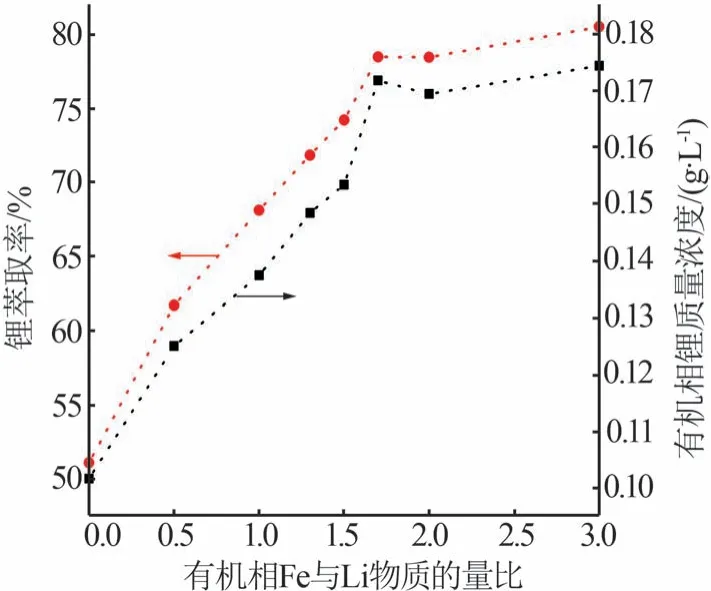
图5 有机相FeCl3浓度对萃取锂的影响Fig.5 Effect of FeCl3 concentration in organic phase on lithium extraction
2.1.7 相比对萃取锂的影响
实验中选择合适的相比不仅可以提高锂的萃取效果,还可以改善分相效果。为了考察相比对萃取锂的影响,本实验首先将组成为50%TBP+50%MIBK的有机相与0.047 7 mol/L FeCl3和2 mol/L AlCl3组成的水相按照相比为2∶1 进行萃取实验,待两相彻底分开后,上层即为负载有机相;然后将负载有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按照相比为1∶2、1∶1、2∶1、3∶1、4∶1、5∶1 进行萃取反应,相比对萃取锂的影响如图6所示。由图6可知,随着相比的增加有机相中锂浓度和锂萃取率均呈现上升趋势,但当相比达到2∶1 时,有机相中的锂浓度和锂萃取率上升趋势减缓。这是因为在相比较小时,有机相和水相的锂浓度差别较大,萃取过程中的传质推动力较强,当相比较大时,传质推动力相对较弱。因此,后续实验将相比确定为2∶1。

图6 相比对萃取锂的影响Fig.6 Effect of phase ratio of O/A on lithium extraction
2.2 反萃过程
TBP-FeCl3萃取体系对H+的萃取顺序优于Li+,因此本实验选择HCl为反萃液[18]。为了考察不同盐酸浓度对反萃效果的影响,本实验分别采用0、1、2、3、4、5、6、8 mol/L HCl 作为反萃液,对萃取锂后的有机相按照相比为1∶2 进行反萃取实验,不同盐酸浓度对反萃效果的影响如图7所示。由图7可知,反萃液中锂浓度随着盐酸浓度的增加逐渐下降,铁浓度表现出先快速下降后保持稳定的趋势,当HCl 浓度为3 mol/L 时,反萃液中铁浓度几乎为0。为了实现负载有机相的循环使用,在反萃过程中需将Fe3+保持在有机相中。因此,反萃液选择3 mol/L HCl。

图7 盐酸浓度对反萃效果的影响Fig.7 Effect of HCl concentration on stripping
2.3 再生过程
经反萃后负载有机相中的FeCl4-大部分被H+结合,有机相整体呈现酸性。酸性有机相对含锂溶液几乎没有萃取作用,前期研究中常选用2 mol/L NaOH 作为再生液,但由于NaOH 碱性较强,再生过程中会使负载有机相中Fe3+发生不同程度的水解。为了恢复有机相萃取锂的能力,本实验分别采用0.5、1、1.5、2、2.5、3 mol/L Na2CO3作为再生液对反萃有机相按照相比为10∶1进行再生,然后将经再生后的有机相与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按照相比为2∶1进行萃取反应,Na2CO3浓度对再生效果的影响如图8 所示。由图8 可知,当Na2CO3浓度为1 mol/L 时,锂的萃取率最高,且有机相中锂浓度相对较高。因此,本实验选择1 mol/L Na2CO3作为再生液。

图8 Na2CO3浓度对再生效果的影响Fig.8 Effect of Na2CO3 concentration on regeneration
2.4 三级串级逆流实验
单级萃取由于受两相传质推动力限制,其传质效果不太理想。为了加强两相的传质推动力,根据操作线和平衡线绘制梯级,为了实现95%以上的锂萃取率,需要采用三级串级操作。按照串级实验的流程(如图9 所示),本实验首先将组成为50%TBP+50%MIBK 的有机相与0.047 7 mol/L FeCl3和2 mol/L AlCl3组成的水相按照相比为2∶1 进行萃取实验,待两相彻底分开后,上层即为负载有机相;然后将负载有机相分别与组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3的水相按照相比为2∶1进行了五排三级串级逆流实验。对萃取锂后的有机相采用3 mol/L HCl 按照相比为1∶2 进行反萃取实验,对反萃液和萃余液中的锂离子进行检测,结果如表2 所示。由表2可知,经三级串级逆流实验后,锂的萃取率达到了99.72%,实现了从低品位高黏土浸出液中萃取锂的目的。

图9 串级实验流程图Fig.9 Flow diagram of cascade experiments

表2 串级实验结果Table 2 Results of cascade experiments
3 结论
本实验以TBP 为萃取剂、MIBK 为稀释剂、FeCl3为共萃剂,开展从高黏土浸出液的模拟溶液中萃取锂的研究,通过考察水相组成、负载有机相金属离子种类、负载有机相AlCl3浓度、负载有机相TBP 浓度、Fe 与Li 物质的量比、相比等因素对锂萃取性能的影响。确定了水相组成为0.028 8 mol/L LiCl+0.036 5 mol/L FeCl3+2 mol/L AlCl3、负载有机相金属离子为Al3+、负载有机相中AlCl3浓度为2 mol/L、TBP体积分数为50%、Fe 与Li 物质的量比为1.7、萃取相比为2∶1。为了避免萃取过程中出现第三相,选择极性较强的MIBK 作为稀释剂。3 mol/L HCl 和1 mol/L Na2CO3分别被确定为反萃液和再生液。为了实现锂的高效回收,本实验采用三级串级逆流实验进行锂的萃取实验,经串级萃取实验后锂萃取率达到了99.72%,这一结果表明TBP-MIBK-FeCl3萃取体系实现了从低品位高黏土浸出液的模拟溶液中有效分离提取锂的目的。

