酸敏感离子通道1a对全脑缺血再灌注损伤大鼠神经元凋亡的影响及其可能机制▲
王 梅 许志斌
(泰州市人民医院1 麻醉科,2 泌尿外科,江苏省泰州市 225300)
心搏骤停、休克、脑卒中、低血压等均可导致脑缺血再灌注损伤。能量代谢障碍与细胞酸中毒、兴奋性氨基酸毒性作用、钙超载、氧化应激损伤、炎症损伤和细胞凋亡等机制互为因果,构成了脑缺血再灌注损伤的级联反应,其中,细胞凋亡是主要机制之一。酸敏感离子通道(acid-sensing ion channel,ASIC)是一类由胞外酸化激活的阳离子通道,广泛存在于哺乳动物中枢及外周神经系统,参与机体感觉传递、学习记忆、恐惧焦虑、炎症、缺血性损伤等多种生理及病理过程,在脑缺血再灌注损伤的病理生理过程中发挥重要作用[1-4]。其中,ASIC1a对酸的敏感性较高,与脑缺血再灌注损伤关系最为密切,具有多种生理功能和重要的病理生理学意义[5]。研究表明,抑制ASIC1a可提高急性缺血再灌注损伤后心肌细胞的存活率[6]。而狼蛛毒素1(psalmotoxin 1,PcTx1)对ASIC1a的抑制效率极高[7],且在脑缺血等病理条件下,PcTx1对ASIC1a的抑制作用将增强[8]。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族的重要成员,在所有真核细胞中均有表达,其激活与细胞生长、分化、增殖、转化等有关。目前研究最为广泛的是ERK1/2,其存在于细胞浆,可被多种因子激活而发生磷酸化,随后转至细胞核,调节转录因子的活性。已有研究表明,在脑缺血性损伤中活化的ERK1/2具有神经保护作用[9]。近期有学者发现,ERK/MAPK信号通路参与ASIC1a的激活[10]。本研究构建全脑缺血再灌注损伤大鼠模型,并给予PcTx1干预,探讨ASIC1a对全脑缺血再灌注损伤大鼠海马神经元细胞凋亡的影响及其相关机制,以期为脑缺血再灌注损伤的临床治疗提供新靶点。
1 材料与方法
1.1 实验动物 健康清洁成年雄性SD大鼠180只,体重180~220 g,由西安交通大学医学部实验动物中心提供[许可证号:SYXK(陕)2018-001]。将大鼠饲养于无特定病原体级的实验室,经检查确认大鼠无异常行为。饲养环境温度为18 ℃~26 ℃,给予标准全价颗粒饲料喂养,不限食、不限水,适应性饲养1周后进行实验。
1.2 主要试剂与药品 Annexin Ⅴ-FITC凋亡试剂盒(珠海健康元生物医药有限公司,批号:FXP018),PcTx1(Alomone Labs公司,批号:RTP-100),原位细胞凋亡检测试剂盒(Roche公司,批号:17901),DAB显色试剂(北京中杉金桥生物技术有限公司,批号:ZLI9019),链霉素亲和素-生物素复合物(streptavidin-biotin complex,SABC)免疫组化试剂盒(武汉博士德生物工程有限公司,批号:SA2005),磷酸化ERK1/2单克隆抗体(Cell Signaling Technology公司,批号:4370),多聚甲醛(上海麦克林生化科技股份有限公司,批号:P924368)。其余试剂为实验室常用规格。
1.3 主要仪器 流式细胞仪(Becton,Dickinson and Company,型号:FACSCalibur),脑立体定位仪(徐州利华电子科技发展有限公司,型号:ZH-蓝星C),石蜡切片机(Leica公司,型号:Leica-2045),计算机图像分析系统(Leica公司,型号:Leica Quantiment 570),倒置显微镜(OLYMPUS公司,型号:BH-2)。
1.4 动物分组与建模
1.4.1 动物分组:采用随机数字表法将180只大鼠分为假手术组、模型组、ASIC1a抑制剂组(PcTx1组),每组60只。根据再灌注时间的不同将每组再分为2 h组、6 h组、12 h组、24 h组、48 h组5个亚组,每个亚组12只。
1.4.2 建立动物模型:对模型组和PcTx1组大鼠采用经典四血管阻断法制备全脑缺血再灌注损伤模型。通过腹腔注射10%水合氯醛(40 mg/100 g)对大鼠施行麻醉,麻醉满意后以俯卧位固定大鼠四肢,将其头前倾约30°,用橡皮筋拴住尾部并适度牵拉使颈椎伸直,在枕骨下平第1颈椎水平处做一正中切口,逐层分离并充分暴露第1颈椎横突上的翼小孔,将烧红的探针插入翼小孔,烧灼双侧椎动脉使之永久闭塞,逐层缝合皮下组织及皮肤。除不给予烧灼椎动脉外,假手术组的其他操作同其余两组。术后单笼饲养,保持大鼠呼吸道通畅,维持室温在20 ℃~25 ℃,用60 W白炽灯持续照射24 h,观察大鼠苏醒过程。术后第2天,通过腹腔注射10%水合氯醛(40 mg/100 g)对大鼠施行麻醉,麻醉满意后以仰卧位固定大鼠四肢,做一颈部正中切口,分离双侧颈总动脉,采用微动脉夹夹闭双侧颈总动脉6 min,夹闭1 min内大鼠如出现瞳孔散大、眼球苍白、嘴唇发绀、呼吸急促等反应说明造模成功,若未出现上述现象或出现偏瘫则认为建模不成功,将其剔除实验。夹闭6 min后迅速松开微动脉夹恢复大鼠脑血流,然后逐层严密缝合皮下组织及皮肤。按上述方法分离并暴露假手术组大鼠的双侧颈总动脉,但不给予夹闭,6 min后逐层缝合皮下组织及皮肤。本研究的模型组、ASIC1a组大鼠均建模成功。术后所有大鼠单笼饲养,饲养条件如前。
1.5 干预方法 再灌注后30 min,向PcTx1组大鼠侧脑室注射PcTx1溶液(给药剂量为1 ng/100 g,用无菌无酶PBS配置为浓度500 ng/mL的溶液)[11],向假手术组、模型组大鼠侧脑室注射等体积无菌无酶PBS,均在5 min内分次注完药物,留针2 min后缝合皮下组织及皮肤。术后单笼饲养,饲养条件如前。侧脑室注射方法:通过腹腔注射10%水合氯醛(40 mg/100 g)麻醉大鼠后,将其头部固定于脑立体定位仪上,将微量注射器固定于脑立体定位仪的游动支架上,并记录各标尺的坐标刻度。对大鼠头部进行备皮消毒后做一正中切口,分离头皮及皮下组织,暴露颅骨后用棉球擦拭及洗耳球吹干,充分暴露前囟、后囟,以前囟为标志,移动微量注射器以向左侧1.2 cm、尾侧0.8 cm定位,用微型钻头电钻钻一直径约2.0 mm的小孔,下移微量注射器,当针尖贴紧硬脑膜时,记录标尺刻度,继续下移微量注射器约3.5 mm即达侧脑室,分次缓慢注射药物,注射时应无阻力。
1.6 观察指标
1.6.1 流式细胞仪检测海马细胞凋亡率:分别于再灌注后2 h、6 h、12 h、24 h、48 h,取各亚组6只大鼠,经腹腔注射10%水合氯醛(40 mg/100 g)麻醉后处死大鼠,完整取出大鼠大脑组织并置于冰盘上,在装有4℃ PBS的培养皿中分离出海马组织,使用PBS洗去残留血液,放入装有4 ℃ PBS的离心管后于4℃保存备用。取大鼠海马组织并用预冷的PBS冲洗,置入研磨皿研磨1 min,铜网过滤除去细胞团块,取上清液置入离心管,重复以上操作2次后以4℃、 2 000 r/min离心5 min,弃上清液,获得海马细胞。用预冷PBS溶液清洗细胞2次后,采用250 μL结合缓冲液重新悬浮细胞,并充分混匀,获得单细胞悬液。将100 μL单细胞悬液加入流式管中,依次加入5 μL Annexin Ⅴ、10 μL PI溶液。室温条件下避光孵育20 min,在1 h内上流式细胞仪检测细胞凋亡率。
1.6.2 HE染色观察海马组织形态学改变及TUNEL法检测海马细胞凋亡指数:(1)分别于再灌注后2 h、6 h、12 h、24 h、48 h,取各亚组剩余6只大鼠,经腹腔注射10%水合氯醛(40 mg/100 g)麻醉后处死大鼠,充分暴露心脏,剪开心包,用磨钝的9号针头从心尖部插入升主动脉,在针头尾部连接灌注装置,剪开右心房的同时快速灌注肝素生理盐水250 mL,随后将4%多聚甲醛溶液300 mL缓慢灌入直至大鼠全身僵硬。随后撬开颅骨取出完整大脑组织,大脑组织呈瓷白色提示灌注成功。在视交叉后1 mm及视交叉后4 mm处各切取一块冠状面组织,将组织置于4%多聚甲醛溶液中浸泡,4℃保存3 d后制备蜡块,然后制作厚度为5 μm的海马组织冠状薄片。(2)取备好的海马组织冠状切片行HE染色,光镜下观察海马CA1区神经元的形态结构变化。(3)取备好的海马组织冠状切片进行脱蜡及水化,使用4%多聚甲醛溶液室温孵育15 min后,使用PBS冲洗2次(5 min/次),滴加20 μg/mL蛋白酶K溶液100 μL后室温孵育10 min,使用PBS冲洗5 min,使用4%多聚甲醛溶液室温孵育5 min,使用PBS冲洗2次(5 min/次),滴加100 μL平衡缓冲液室温孵育10 min,滴加100 μL rTdT孵育缓冲液后在37 ℃下湿盒避光孵育60 min,加入2×SSC缓冲液终止反应,室温放置15 min后,使用PBS冲洗3次(5 min/次),采用含0.3%过氧化氢的PBS孵育5 min,使用PBS冲洗3次(5 min/次);滴加辣根过氧化物酶标记的链霉素亲和素100 μL,室温孵育30 min,使用PBS冲洗3次(5 min/次),透明、封片。在400倍光学显微镜下计数海马CA1区中1/3段内及CA3区中段的TUNEL染色阳性细胞(棕黄色)数和总细胞数,计算凋亡指数,凋亡指数=阳性细胞数/总细胞数×100%。
1.6.3 免疫组织化学染色法检测磷酸化ERK1/2的表达水平:取海马组织冠状面石蜡切片进行脱蜡水化后,加入3.0% H2O2室温孵育10 min,用蒸馏水冲洗5 min后,再用PBS冲洗5 min,高压加热法修复抗原,用PBS冲洗3次(3 min/次),滴加正常山羊血清封闭液,室温孵育30 min,滴加磷酸化ERK1/2单克隆抗体(1 ∶100)4 ℃过夜,用PBS冲洗3次(5 min/次),滴加生物素标记的山羊抗兔IgG工作液,37℃孵育40 min,用PBS冲洗3次(5 min/次),滴加SABC,37 ℃孵育20 min,用PBS冲洗3次(5 min/次),DAB显色,苏木素复染,脱水、透明、封片后进行图像采集和分析。在400倍光镜下计数海马CA1区中1/3段及CA3区中段的磷酸化ERK1/2染色阳性细胞(棕黄色)数和总细胞数。计算阳性细胞指数以反映磷酸化ERK1/2的表达水平,阳性细胞指数=阳性细胞数/总细胞数×100%。
1.7 统计学分析 采用SPSS 25.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用Bonferroni检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 再灌注后各时间点3组大鼠海马细胞凋亡率的比较 在再灌注后各时间点,假手术组、PcTx1组、模型组海马细胞凋亡率依次升高(P<0.05),其中,PcTx1组、模型组海马细胞凋亡率在再灌注24 h后达高峰,见表1、图1。
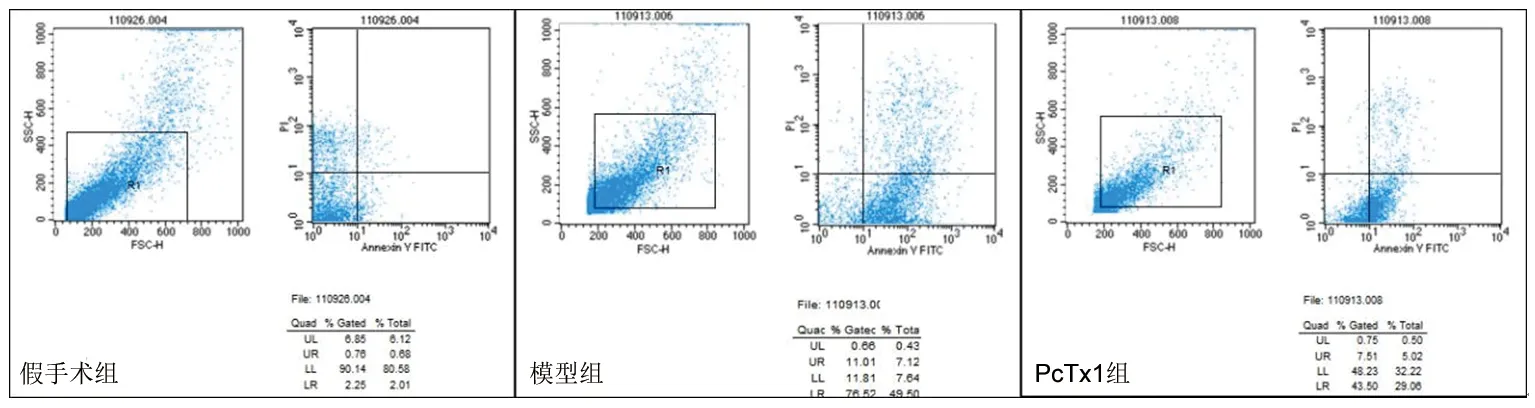
图1 再灌注后24 h 3组大鼠海马细胞凋亡情况
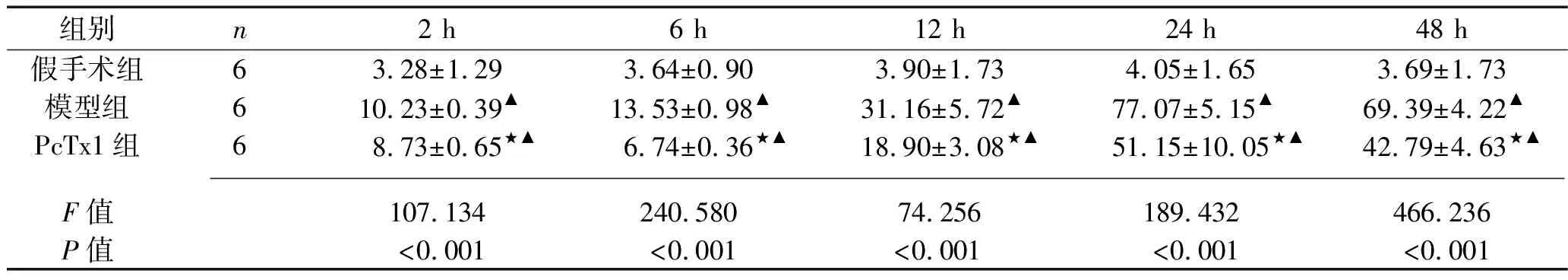
表1 再灌注后各时间点3组大鼠海马细胞凋亡率的比较(x±s,%)
2.2 3组大鼠海马组织形态学改变 HE染色结果显示,在再灌注后各时间点,假手术组大鼠海马CA1区锥体细胞共有3~4层,细胞排列整齐、紧密,边界清,胞质淡红,胞核蓝染,高倍镜下可见细胞核大而圆,核仁清晰,核仁数量1~2个;模型组大鼠海马CA1区锥体细胞结构被破坏,排列紊乱松散,细胞间隙增大,边界不清,细胞大小不等、数量减少,胞核皱缩,可见凋亡小体;PcTx1组大鼠海马CA1区的锥体细胞形态变化介于上述两组之间,见图2。

图2 再灌注后12 h 3组海马CA1区组织形态学改变(HE染色,×400)
2.3 再灌注后各时间点3组大鼠海马细胞凋亡指数的比较 在再灌注后各时间点,假手术组中海马CA1区及CA3区的凋亡细胞均极少,模型组、PcTx1组的凋亡指数较假手术组升高,而PcTx1组的凋亡指数较模型组降低(P<0.05),模型组、PcTx1组的细胞凋亡指数在再灌注后24 h达高峰,见表2、表3、图3。

图3 3组大鼠海马CA1区及CA3区细胞凋亡情况(TUNEL染色,×400)

表2 再灌注后各时间点3组大鼠海马CA1区细胞凋亡指数的比较(x±s,%)

表3 再灌注各时间点后3组大鼠海马CA3区细胞凋亡指数的比较(x±s,%)
2.4 3组大鼠海马CA1区及CA3区磷酸化ERK1/2表达水平的比较 (1)大鼠海马CA1区:在再灌注后2 h、6 h、12 h、24 h,假手术组、模型组、PcTx1组的磷酸化ERK1/2表达水平依次升高;在再灌注后48 h,PcTx1组的磷酸化ERK1/2表达水平亦高于其他两组(P<0.05),见表4、图4。(2)大鼠海马CA3区:在再灌注后2 h、6 h,假手术组、模型组、PcTx1组的磷酸化ERK1/2表达水平依次升高(P<0.05);在再灌注后12 h,模型组、PcTx1组的磷酸化ERK1/2表达水平高于假手术组(P<0.05);在再灌注后24 h、48 h,3组的磷酸化ERK1/2表达水平差异无统计学意义(P>0.05),见表5、图4。
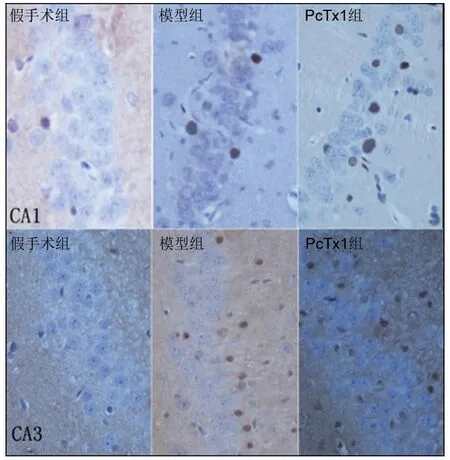
图4 3组大鼠海马CA1区及CA3区磷酸化ERK1/2表达情况(免疫组织化学染色,×400)

表4 再灌注后各时间点3组大鼠海马CA1区磷酸化ERK1/2表达水平的比较(x±s,%)

表5 再灌注后各时间点3组大鼠海马CA3区磷酸化ERK1/2相对表达水平的比较(x±s,%)
3 讨 论
组织酸化是脑缺血性损伤的共同特征之一,pH值降低诱发ASIC电流的产生。脑组织缺血时其周围pH值下降,ASIC1a通道被激活,引起神经元损伤,而ASIC1a阻滞剂可减轻神经元损伤[12]。PcTx1是ASIC1a特异性阻滞剂,对ASIC1a的抑制效率极高。Xiong等[13]在局部脑缺血小鼠模型中发现,经侧脑室内注射ASIC1a非特异性阻滞剂阿米洛利、特异性阻滞剂PcTx1或敲除ASIC1a基因均可显著减少小鼠大脑梗死面积。
本研究构建全脑缺血再灌注损伤大鼠模型,并给予ASIC1a的特异性阻滞剂PcTx1进行干预。流式细胞仪检测结果显示,在再灌注后各时间点,假手术组、PcTx1组、模型组海马细胞凋亡率依次升高(P<0.05);HE染色结果显示,在再灌注后各时间点,模型组海马CA1区锥体细胞结构破坏,排列紊乱松散,胞核皱缩,可见凋亡小体,而PcTx1组海马CA1区锥体细胞形态结构较模型组改善;TUNEL法检测结果显示,在再灌注后各时间点,假手术组、PcTx1组、模型组大鼠海马CA1区、CA3区的凋亡指数依次升高(P<0.05)。上述研究结果提示全脑缺血再灌注损伤大鼠的海马神经元细胞凋亡现象明显,而给予PcTx1干预后可减轻神经元细胞的凋亡,说明在全脑缺血再灌注损伤中ASIC1a有加重脑损伤的作用。
研究显示,ERK活化转变为磷酸化ERK可抑制心肌细胞凋亡,而给予ERK抑制剂后心肌细胞凋亡增多[14]。有学者认为,ERK1/2被激活发生磷酸化后,可抑制细胞凋亡,减轻脑缺血再灌注损伤,发挥神经保护作用[15-16]。本研究结果显示,与假手术组相比,模型组大鼠海马CA1区和CA3区的磷酸化ERK1/2表达水平增高,磷酸化ERK1/2于再灌注后2 h即可在大鼠海马CA1区和CA3区被检测到,其在大鼠海马CA1区的表达水平于再灌注后12 h达高峰,于再灌注后48 h恢复至假手术组水平,而其在海马CA3区的表达水平于再灌注后6 h达高峰,于再灌注后24 h即恢复至假手术组水平。上述结果提示海马神经元细胞发生凋亡时,ERK1/2被激活发生磷酸化,原因可能是由于脑组织缺血时其周围pH值下降,ASIC1a被激活,导致神经元损伤,ERK1/2信号通路代偿性激活,以减轻神经元细胞凋亡,而随着再灌注时间的延长,脑组织pH值逐渐恢复正常,ASIC1a失活,磷酸化ERK1/2的表达趋于正常。此外,在再灌注后2 h、6 h、12 h、24 h、48 h,PcTx1组大鼠海马CA1区的磷酸化ERK1/2表达水平高于模型组,而在再灌注后2 h、6 h,其海马CA3区的磷酸化ERK1/2表达水平也高于模型组(P<0.05),这提示给予PcTx1干预后ASIC1a受到抑制,海马神经元细胞凋亡减少,ERK1/2信号通路进一步被激活。由此推测,在全脑缺血再灌注损伤大鼠中,ERK1/2信号通路与ASIC1a存在一定的关系:脑组织缺血再灌注后,ASIC1a被激活而引起神经元损伤的同时,磷酸化ERK1/2的神经保护作用出现代偿性增强,而给予ASIC1a特异性阻滞剂后,可使磷酸化ERK1/2的神经保护作用进一步增强,以减少神经元凋亡。但是,ERK1/2信号通路与ASIC1a之间相互作用的具体机制还有待进一步研究和探讨。
综上所述,ASIC1a可能参与全脑缺血再灌注损伤大鼠海马神经元细胞凋亡的发生,其特异性阻滞剂PcTx1可减轻神经元细胞凋亡,作用机制可能与促进ERK1/2磷酸化有关。

