Mzb1通过内质网应激途径改善过氧化氢所致人心肌细胞损伤的研究
薛姣姣 顾晶 张棋 周明生 姚阳 蔡瑞平 徐茜 徐志华 贾辉 张璐
心肌梗死是全球发病率和死亡率的主要原因[1]。随着药物治疗的应用越来越多以及几种冠状动脉再灌注策略的出现,急性心肌梗死的治疗、护理和预防取得了显著进展。心肌梗死的病理生理机制包括心肌细胞凋亡、炎症、钙超载和活性氧(reactive oxygen species,ROS)相关损伤也逐渐被揭示,但很少阐明循证策略来预防心肌梗死损伤[2]。因此,需要深入探索心肌梗死发生机制,寻找诊断、预防、治疗心肌梗死的新靶点。心肌梗死发生后引起细胞内质网应激的发生,较短时间的内质网应激可以对细胞起到一定的修复和缓解作用,而持续的内质网应激则会引起不可逆的细胞凋亡。内质网应激因子CCAAT/增强子结合蛋白的同源蛋白(CCAAT/enhancer binding protein homologous protein,CHOP)、葡萄糖调节蛋白94(glucoseregulated protein 94,GRP94)等均参与心肌梗死过程[3-4]。寻找抑制内质网应激过度发生的方法可以作为心肌梗死治疗的有效手段。缘区B 和B1 细胞特异性蛋白(marginal zone B and B1 cell specific protein,Mzb1)是一种B 细胞特异性编码蛋白,主要定位于内质网上,在内质网应激条件下作为底物特异性伴侣GRP94 的辅助伴侣发挥作用,并参与对整合素β1的激活[5-6]。此前,关于Mzb1 作用的研究主要集中在免疫性疾病、癌症和慢性淋巴细胞白血病[7-8]。然而,Mzb1 是否在其他炎症性疾病中发挥重要的作用一直受到质疑。前期研究显示,心肌梗死组织中Mzb1 的表达下降,沉默Mzb1 会加重心肌细胞损伤,过表达Mzb1 可以恢复线粒体功能改善心肌损伤[9]。基于前期的研究,本实验探索Mzb1 对过氧化氢(hydrogen peroxide,H2O2)诱导的人心肌细胞损伤内质网应激相关因子及凋亡的影响。
1 资料与方法
1.1 一般资料
人永生化心肌细胞(AC16)由哈尔滨医科大学提供。高糖培养基购于美国Cytiva 公司;牛血清白蛋白、青链霉素双抗混合液、3-(4,5-二甲基噻唑-2)-2,5-二 苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT] 检 测 试 剂 盒、luriabertani(LB)培养基与氨苄青霉素钠(ampicillin)购于北京索莱宝生物科技有限公司;胰蛋白酶/乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液购于天津灏洋生物制品科技有限责任公司;超敏化学发光底物(enhanced chemiluminescent,ECL)购于上海碧云天生物技术有限公司;Mzb1 一抗抗体购于美国Abcam 公司;GRP94、CHOP、Caspase3 以及3- 磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗抗体购于武汉Proteintech 公司;Mzb1 过表达质粒(氨苄霉素抗性)购于武汉维诺赛生物技术有限公司;Lipofectamine®3 000 购于美国Invitrogen 公司;质粒提取试剂盒购于美国爱思进公司。
1.2 方法
此文的研究体现了《精编分子生物学实验指南》[10]的执行标准。
1.2.1 AC16 细胞培养
AC16 细胞培养在含有10%的胎牛血清(fetal bovine serum,FBS)及1%青链霉素双抗的高糖完全培养基中(dulbecco's modified eagle medium,DMEM),置于含有37℃、5%CO2和95%空气的细胞培养箱中培养;细胞汇合度达90%以上,用胰蛋白酶消化细胞,将混悬细胞分别接种于6 孔板及96 孔板,用于后续实验研究。加入终浓度为200 μmol/L 的H2O2或等体积高糖培养基继续培养12 h,收集细胞用于下一步实验的检测。
1.2.2 Mzb1 质粒扩增
取10 μL 质粒与100 μL 感受态细菌混匀后冰浴30 min,42 ℃热激45 s,立即置冰上放置2 min,加入预热至室温的400 μL LB 培养基,37 ℃恒温摇床培养1 h,4 000 rpm 离心1 min,弃去400 μL 培养上清,剩余100 μL 用移液器混匀后均匀涂布于含100 μg/mL Ampicillin 抗性的LB 平板上,37℃恒温培养箱倒置培养过夜。挑取3 个单菌落接种于含5 mL,100 μg/mL Ampicillin抗性的LB 培养液中,250 rpm,37℃恒温摇床培养过夜,用小量质粒抽提试剂盒按照步骤抽提质粒,采用微量分光光度计测量浓度,稀释质粒浓度约500 ng/μL,-20℃保存。
1.2.3 细胞转染
将AC16 细胞按照1.0×105/ 孔的密度接种与6 孔板,培养12 h;待细胞汇合度达到70%~90%后,根据Lipofectamine®3 000 说明书转染质粒,制备质粒DNA-脂质体复合物;加入DNA-脂质体复合物至细胞;放入细胞培养箱中培养48 h 后,收集细胞用于进一步的检测。
1.2.4 MTT 实验检测细胞活力
将AC16 细胞按照3.0×103/孔接种于96 孔板,培养12 h;按照细胞分组处理细胞;设置分组:对照组、H2O2组、Mzb1+H2O2组;用5 mg/mL MTT(20 μL/孔)处理细胞4 h。小心地吸出DMEM 保留结晶,加入二甲基亚砜(dimethyl sulfoxide,DMSO)(150 μL/孔),室温状态下放置水平摇床10 min;使用荧光酶标仪检测490 nm 波长的吸光度值。
1.2.5 蛋白质印迹法(western blot,WB)检测细胞内Mzb1、GRP94、CHOP、Cleaved-caspase3 蛋白水平的变化情况
将细胞接种于6 孔板培养12 h;按照细胞分组处理细胞;设置分组:对照组、H2O2组、Mzb1+H2O2组;采用细胞裂解液裂解细胞,超声离心后,采用二喹啉甲酸(bicinchoninic acid, BCA)法检测蛋白浓度,将样品标准化浓度后,100℃变性7 min。配制SDS-PAGE 凝胶电泳分离,然后转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,5% BSA 室温摇床封闭1 h。加入Mzb1(1 ∶500)、GRP94(1 ∶500)、CHOP(1 ∶500)、Caspase3(1 ∶500)、GAPDH(1 ∶2 000)一抗,于4℃孵育过夜。次日TBST 洗膜后用二抗(1 ∶4 000)孵育1 h,再次洗膜后用ECL 显影,并采用ImageJ 软件进行分析。蛋白相对表达量=目的蛋白灰度值/ 内参灰度值。
1.3 统计学方法
采用Prism 8.4.0 软件进行分析。计量资料以(±s)表示,采用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 H2O2 损伤心肌细胞的活力
当AC16 细胞汇合度达70%左右,分别给予各组细胞200 μmol/L H2O2或体积高糖培养基,继续培养12 h后,采用MTT 检测各组的细胞活力。实验结果显示,对照组细胞活力为(100.000±8.767)%,H2O2组细胞活力为(33.250±4.956)%;与对照组相比,H2O2处理的AC16 心肌细胞活力明显降低(t=3.896,P<0.01)。见图1。

图1 H2O2 处理后对AC16 细胞活力的影响
2.2 H2O2 引起心肌细胞内质网应激
接下来,检测H2O2引起的细胞内内质网应激水平变化。采用WB 检测内质网应激相关分子GRP94 以及CHOP的表达水平。结果显示,在对照组细胞中,GRP94 蛋白相对表达量为(1.000±0.000),在H2O2组中,GRP94 的蛋白相对表达量为(1.713±0.046);在对照组细胞中,CHOP蛋白相对表达量为(1.000±0.000),在H2O2组中CHOP 的蛋白相对表达量为(2.512±0.553);与对照相比,H2O2处理后引起细胞内GRP94(t=15.660,P<0.05)以及CHOP(t=2.736,P<0.05)蛋白表达量明显升高。见图2。
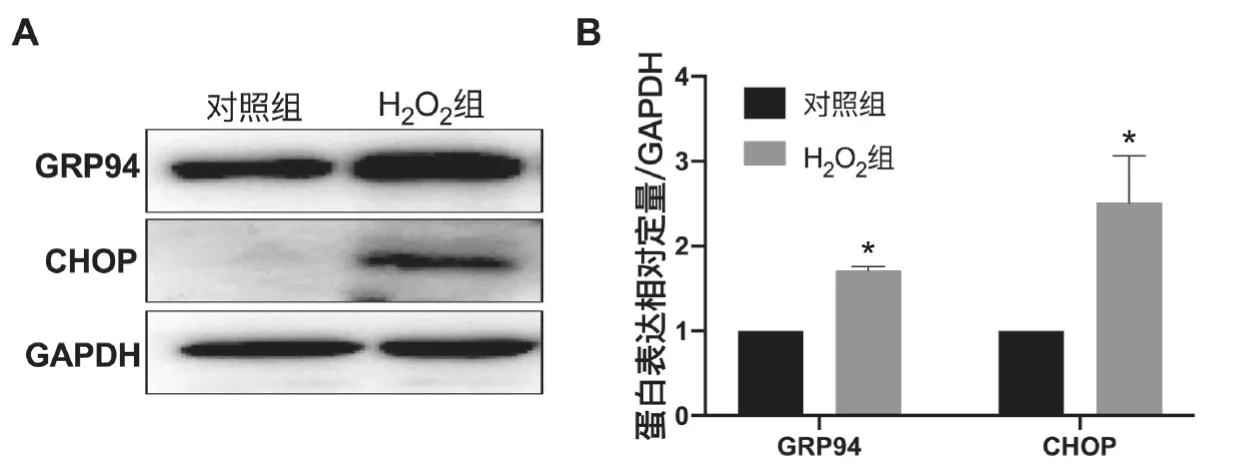
图2 H2O2 引起AC16 细胞内质网应激发生
2.3 H2O2 引起AC16 心肌细胞Mzb1 表达下调
WB 检测结果显示,对照组内Mzb1 的蛋白相对表达量为(1.000±0.000),H2O2处理的AC16 细胞中Mzb1 的蛋白相对表达水平为(0.455±0.066)。H2O2处理后引起细胞内Mzb1 的表达显著下降(t=16.490,P<0.05)。Mzb1 可能在H2O2引起的氧化应激过程中扮演重要角色。见图3。
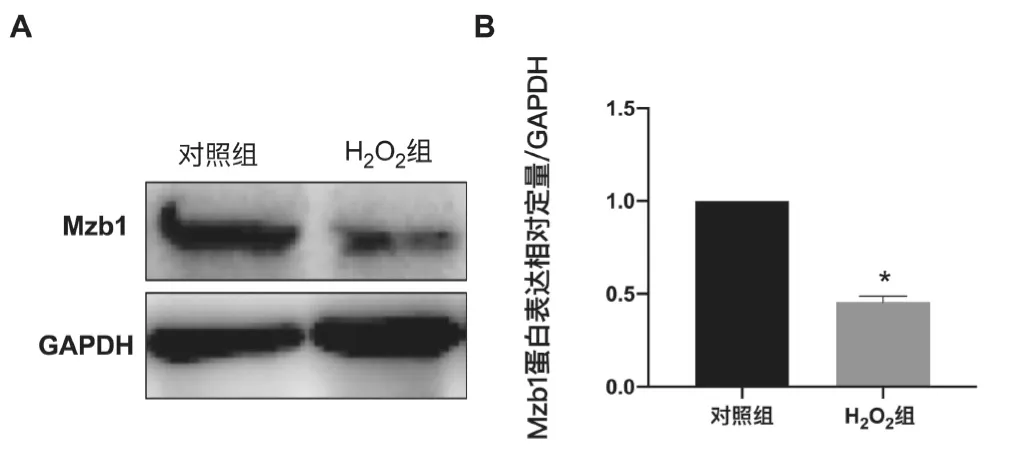
图3 H2O2 对AC16 细胞内Mzb1 表达的影响
2.4 过表达Mzb1 改善AC16 细胞活力
MTT 检测细胞活力结果显示,对照组相对细胞活 力 为(100.000±3.420)%,H2O2组 细 胞 相 对 活 力为(29.870±4.129)%,Mzb1+H2O2组相对细胞活力为(73.000±12.860)%;与对照组相比,H2O2引起细胞活力下降(t=12.380,P<0.01),与H2O2处理组相比,Mzb1过表达显著改善由H2O2处理后的细胞活力(t=3.193,P<0.05)。见图4。

图4 Mzb1 对AC16 细胞活力的影响
2.5 过表达Mzb1 抑制内质网应激
WB 结果显示,对照组内GRP94 蛋白相对表达量为(1.000±0.000),H2O2组GRP94 相对表达量对为(1.647±0.086),Mzb1+H2O2组GRP94 相对表达量对为(1.056±0.050);对照组内CHOP 蛋白相对表达量为(1.000±0.000),H2O2组CHOP 相对表达量对为(3.648±0.725),Mzb1+H2O2组CHOP相对表达量对为(2.484±0.273);与对照组相比,H2O2处理的细胞中GRP94及CHOP表达显著升高(t=7.486,P<0.05;t=3.654,P<0.01);与H2O2组相比,Mzb1 过表达降低了GRP94 及CHOP 的表达水平(t=7.635,P<0.05;t=2.577,P<0.05)。Mzb1 过表达可以抑制H2O2引起的内质网应激。见图5。
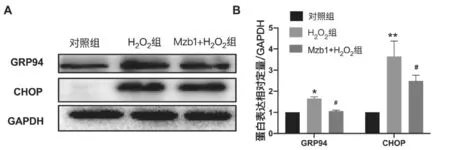
图5 Mzb1 对内质网应激相关蛋白表达的影响
2.6 过表达Mzb1 抑制H2O2 引起的细胞凋亡
WB 结果显示,对照组内活化型的Caspsase3(Cleaved-Caspase3)蛋白相对表达量为(1.000±0.000),H2O2组Cleaved-Caspase3 相对表达量为(2.196±0.237),Mzb1+H2O2组Cleaved-Caspase3 相对表达量为(1.197±0.165);与对照组相比,在H2O2处理的细胞中,Cleaved-Caspase3 水平升高(t=5.042,P<0.05);过表达Mzb1 后,Cleaved-Caspase3 水平降低(t=6.886,P<0.05)。见图6。

图6 过表达Mzb1 对细胞凋亡的影响
3 讨论
前期研究表明,在急性心肌梗死损伤的组织和心肌细胞中,Mzb1 的表达异常降低,恢复其表达可以降低心肌细胞内ROS 水平,增加腺嘌呤核苷三磷酸(adenosinetriphosphate,ATP)含量,恢复线粒体膜电位,增加细胞耗氧量进而恢复线粒体功能;同时减轻心肌梗死损伤心肌细胞内炎症,改善心脏功能表明Mzb1 在心肌损伤过程中发挥保护效应[9]。有研究报道,Mzb1 调节体液免疫应答与抗体产生的过程,Mzb1 与底物特异性伴侣GRP94 直接作用,参与内质网应激下的免疫球蛋白重链(immunoglobulin μ heavy chains,μHCs)生物合成,这表明Mzb1 是GRP94的底物特异性伴侣蛋白,可能在内质网应激途径中发挥重要作用[5,11]。因此推断,Mzb1 可能通过内质网应激途径影响细胞功能。
氧化应激和缺血会扰乱钙稳态,诱导错误折叠和未折叠蛋白积累,导致内质网应激。内质网应激是心血管疾病发生发展的主要原因。以往的研究发现炎症反应和细胞凋亡与心肌梗死损伤密切相关,而内质网应激是诱导炎症反应和细胞凋亡的重要信号通路。此外,细胞凋亡的特征是染色质浓缩和分离,细胞皱缩,碎裂成凋亡小体,可被巨噬细胞清除[12]。虽然凋亡和坏死的信号通路不同,但它们涉及相同的步骤,如半胱氨酸天冬氨酸蛋白酶(Caspase)的激活[13]。在调控细胞凋亡的信号通路中,与内质网应激相关的凋亡信号已被认为是心肌梗死损伤的重要机制之一[14]。已有文献表明,在缺血或缺血再灌注后,内质网应激被激活,持续发生的内质网应激引起细胞凋亡[15]。内质网应激分子伴侣GRP94 是热休克蛋白(heat shock protein,HSP)的同源蛋白,在生理条件下主要介导未折叠蛋白反应(unfolded protein response,UPR)。它们的表达水平与内质网管理未折叠和错误折叠蛋白质的能力相关[16-17]。因此,GRP94 被广泛认为是内质网应激的标志物。严重的缺血缺氧可能导致心肌细胞凋亡增加,心肌梗死后GRP94 表达增加[18]。这些发现是与实验数据一致,结果显示H2O2诱导的损伤细胞模型中GRP94 表达增高,而在过表达Mzb1 后GRP94 的表达水平有下降。因此,结果表明Mzb1 的基因表达上调有助于抑制心肌细胞损伤后内质网应激的水平。
此外,Caspase12 位于内质网外膜中,它作为一种主酶发挥着特殊的作用,参与内质网应激诱导的凋亡通路。与Caspase9 共同作用,反过来激活Caspase3,细胞凋亡执行者Caspsase3 属于半胱氨酸蛋白水解酶家族,其被激活后经剪切分离成活化型的Caspsase3(Cleaved-Caspase3),引发细胞凋亡。此外,心肌细胞损伤后CHOP 的表达也明显升高[19]。CHOP 是一种重要的转录因子调节内质网应激诱导的细胞凋亡。CHOP 还可能通过下调Bcl-2 的表达,激活Caspase3,最终导致细胞凋亡[20]。有报道指出,沉默CHOP基因可以减弱内质网应激引起的细胞凋亡[21]。本研究结果显示,H2O2诱导的损伤细胞模型CHOP 的表达上调,而在过表达Mzb1 后CHOP 的表达水平有下降。这表明Mzb1 过表达可以抑制心肌细胞损伤后内质网应激引起的细胞凋亡。
综上所述,Mzb1 能改善H2O2引起的心肌细胞损伤,其机制与抑制内质网应激,减少Cleaved-caspase3 的激活,减少心肌细胞凋亡相关。

