1例胰岛素自身免疫综合征临床病例的分析
姚晓青,张红梅
(1.江汉大学医学部,湖北 武汉 430056 ;2.武汉市中心医院,湖北 武汉 430014)
1 病例资料
患者男,69 岁,因“反复心慌、胸闷1 周”入院。患者1 周前无明显诱因出现反复心慌、胸闷,伴四肢发抖、头晕、出冷汗,持续10 分钟左右进食后可自行好转,夜间多发,无其他特殊不适。2022 年1 月19 日至武汉市亚洲心脏病医院就诊,测随机静脉血糖3.19 mmol/L,心电图正常,门诊以“低血糖查因、冠心病、胃溃疡”收入我科。患者既往有慢性阻塞性肺病,具体病程不详,目前未用药未戒烟;冠心病病史12 年,长期使用通心络胶囊及阿托伐他汀;自诉发病前口服氯吡格雷片2 个月;有胃溃疡病史、血吸虫接触史。入院后体格检查未发现明显阳性体征。入院后辅助检查:2022 年1 月19 日夜间低血糖发作时测得静脉血糖2.1 mmol/L,C 肽2.50 ng/mL,胰岛素240.49 uIU/mL。2022 年1 月23 日:空腹胰岛素:90.06 uIU/mL;胰岛素自身抗体(insulin autoantibodies,IAA)>175.00 IU/mL;抗胰岛细胞抗体、心肌酶谱、肌钙蛋白、凝血常规、D-二聚体、甲功三项、皮质醇节律、生长激素、抗核抗体谱等未见明显异常。腹部MRI 提示肝脏多发小囊肿;胰腺分裂,主胰管轻度扩张;胆囊息肉,局部考虑腺肌症;左肾小囊肿;盆腔少量积液;左侧股骨头异常信号影,考虑良性,建议复查。垂体MRI 平扫+ 增强未见异常。无痛超声胃镜胰腺扫查未见明显异常。
本例患者根据病史、体格检查及相关辅助检查,可排除胰岛细胞瘤、糖尿病等其他原因导致的低血糖。患者在心慌发作时测得血糖2.1 mmol/L、C 肽2.50 ng/mL、胰岛素240.49 uIU/mL,静滴葡萄糖后血糖可恢复至正常,符合Whipple 三联征表现;同时患者测得空腹胰 岛 素90.06 uIU/mL,IAA >175.00 IU/mL。患 者既往无自身免疫性疾病、外源性胰岛素用药史,结合患者有氯吡格雷服药史,诊断为药物导致的胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)。患者的IAS 确诊后停用氯吡格雷,2022 年1 月20 日静脉滴注葡萄糖,2022 年1 月26 日晚餐前口服阿卡波糖50 mg,餐后血糖显著降低, 2022 年1 月27 日开始口服泼尼松:早上8 点20 mg,下午4 点10 mg,2 天后低血糖症状明显减轻;2022 年1 月29 日患者症状好转,予以出院。门诊每月随诊1 次(2022 年随诊情况见表1)。2022 年4 月23 日调整治疗方案:泼尼松早上8 点20 mg,下午4 点5 mg。2022 年5 月28 日调整治疗方案:泼尼松早上8 点10 mg,之后每2 周减5 mg。
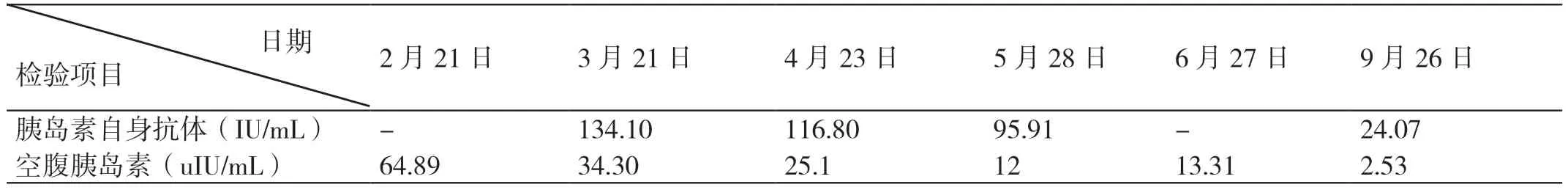
表1 2022 年随诊情况
2 分析讨论
IAS 最初是由Hirata 及其同事在20 世纪70 年代首次报道[1],目前全球大约有500 例IAS 的报道,其中大部分来源于日本[2]。有研究指出,截至2009 年,日本发现了超过380 例IAS 病例。在日本,IAS 在导致自发性低血糖的常见病因中仅次于胰岛素瘤和胰腺外肿瘤[3]。我国首例IAS 是1985 年由向大振等[4]报道的, 虽然目前我国对IAS 的研究仍限于个案,但从1985 年至今,相关报道也已超过了90 例。
IAS 主要发生在40 岁以上成人中,与性别没有直接关系。研究表明IAS 与遗传易感性有关,特别是HLA-DR4。在日本人中主要是DRB1*0406,而HLADR*0403 在白种人中更常见,目前DQA1*0301、DQB1*0302、DRB1*0407 等也被发现与IAS 的发生有关[5]。多种自身免疫性疾病可以在同一个体中共存,并可归因于共同的遗传易感因素。IAS 的发病机制与格雷夫斯病、系统性红斑狼疮、系统性硬皮病、强直性脊柱炎这类自身免疫系统疾病也有尚未明确的关系。Hirata 在1983 年确定了IAS 与巯基类药物使用的相关性[6]。相关研究发现在除日本人外的其他亚洲人中,约50% 的IAS 患者有巯基类药物用药史,其中甲巯咪唑约占64.5%[7]。另外亚胺培南、泮托拉唑、青霉胺、依那普利、异烟肼、谷胱甘肽及氯吡格雷也是常见的IAS 诱发药物[8]。氯吡格雷本身不含有巯基,但其在肝脏中的活性代谢产物含有巯基。巯基类药物的相关作用原理为与胰岛素分组二硫键相结合使其裂解,增强后者的免疫原性,使内源性胰岛素结构发生改变,从而促进特异T 细胞克隆增殖及IAA 的产生。在受到食物摄入刺激后,IAA 上的可用位点可与多个胰岛素分子结合,从而形成大的抗原- 抗体复合物;在餐后状态时,内源性胰岛素水平下降,从而可引起低血糖[9]。另外Kusano 曾在研究中发现辅酶Q10 具有抗氧化作用,可通过清除自由基使细胞免受氧化,补充外源性辅酶Q10 可以改善氧化应激诱导的线粒体功能异常,但其导致IAS 的机制目前尚不清楚[10]。一般情况下,药物导致IAS 的变构是可逆的,停用诱导药物,胰岛素抗原抗体逐渐恢复正常后,临床症状可得到缓解。
IAS 在临床上主要表现为高胰岛素性低血糖、IAA 的滴度升高、无外源性胰岛素接触史、影像学及胰岛病理未见阳性征象。虽然现在IAS 尚未形成公认的诊断标准,但符合下列条件可协助诊断IAS :(1)自发性低血糖的临床表现:焦虑、饥饿、意识丧失、癫痫发作、全身乏力等;(2)发作时血糖低于2.8 mmol/L, 服用升糖药物后症状可迅速缓解;(3)低血糖时血清胰岛素>1000 mU/L(注意放射免疫测得值的准确性要高于化学荧光免疫法);(4)无外源性胰岛素使用史,高滴度IAA 是目前诊断IAS 的可靠指标;(5)排除了胰岛素瘤、B 型胰岛素抵抗综合征等可引起低血糖的疾病;(6)既往有格雷夫斯病、黑棘皮病等自身免疫性疾病,目前正服用可诱导IAS 的药物[3]。在临床上易将IAS 误诊为胰岛素瘤,行手术探查,两者的主要鉴别点是:(1)胰岛素瘤低血糖多发生于空腹时,IAS 空腹和餐后均可发生;(2)除自身免疫性低血糖外,其他原因所致低血糖的血清胰岛素浓度均低于正常值的10 倍,故IAS 患者的血清胰岛素浓度呈特征性的异常升高,明显高于胰岛素瘤患者,大于1000 mU/L 时常提示IAS ;(3)影像学检查胰岛素瘤常有占位表现,IAS 则无占位表现。当患者出现反复低血糖发作且伴高胰岛素血症时,一定要考虑到IAS 的可能[11]。本文报道了1 例有氯吡格雷服药史的男性患者,既往无自身免疫性疾病、外源性胰岛素使用史,低血糖发作时符合“Whipple 三联征”的表现,同时低血糖发生时测得胰岛素及C 肽水平异常升高,IAA 呈高滴度表现,排除胰腺占位等其他低血糖病因,符合药物导致IAS 的诊断。
国内外文献对于IAS 的治疗方案尚无系统性的研究,针对不同的个体一般根据治疗中的病情变化合理调整治疗方案。IAS 患者的低血糖发作是短暂的,多数患者有自发缓解倾向,症状可在6 个月至1 年内消失[12]。目前我们常用的治疗IAS 的方法有:(1)首选停止服用诱导药物,同时采用低碳水化合物、高蛋白、高纤维饮食,少食多餐的方式来控制餐后高血糖导致的胰岛素释放。玉米淀粉是一种吸收缓慢的葡萄糖聚合物,能够预防低血糖,因此推荐食用[13]。(2)通过使用α- 糖苷酶抑制剂延长肠道对食物吸收的时间来减少对胰岛素分泌的刺激,减小IAS 的血糖波动幅度。(3)在病情持续时间较长的病例中,可使用糖皮质激素、免疫抑制剂,通过消耗胰岛β 细胞来抑制免疫,相关临床效果一般在3 个月后出现,病情稳定后逐渐减量。(4)对于药物治疗未见明显疗效的难治性IAS患者,可选择行侵入性的血浆置换或胰腺切除[14]。(5)方立曙等[15]报道采用生脉散结合西医治疗IAS,通过加减化裁可起到益气养阴、清热解毒、祛痰醒神的功效,对IAS 的治疗有良好的效果。虽然相关治疗方法多样,但由于缺乏可靠的特定治疗方法,并且已提出的不同治疗方案之间缺乏比较,故IAS 的管理仍然具有挑战性。临床上大部分的病人选择饮食疗法及阿卡波糖治疗,效果良好。
IAS 是临床上并不常见的内分泌疾病,当患者出现自发性低血糖而又有相关诱导药物服用史,并排除胰岛素瘤等其他病因时, 应注意考虑IAS 的可能,以减少临床上的误诊和漏诊。尽管IAS 的患者在中国并不多,但我们仍要积极研究,寻找相关循证医学证据,以指导临床上的诊治工作,提高患者的生活质量,降低相关致死率。

