原核生物HipBST毒素-抗毒素系统
黄志杰, 欧阳松应, 甄向凯
(1)福建师范大学南方生物医学研究中心, 福州 350117;2)福建师范大学生命科学学院, 福州 350117)
毒素-抗毒素(toxin-antitoxin system,TA)系统广泛存在于细菌和古细菌的染色体及质粒上[1],通常由抑制细菌生长的毒素和能够中和其毒性的抗毒素所组成,TA广泛参与到细胞的生命活动中,在维持基因组稳定性[2, 3]和抵御噬菌体感染[4-7]等方面发挥重要功能。TA目前被分为I-VIII型[2, 8],通常包含2个组分(毒素和抗毒素)。最近一些非经典TA被报道,包括毒素和抗毒素融合在一起的单顺反子TA系统[9, 10]和3组分TA系统[11-13],丰富了我们对于TA的认识。例如在单顺反子CapRelSJ46TA中,其N端结构域和C端结构域分别充当毒素和抗毒素功能[9, 10]。3组分TA则大多数为II型TA的衍生物[14-17],例如,在人类病原菌结核分枝杆菌(Mycobacteriumtuberculosis)中发现的TAC系统,它由3个基因Rv1955-Rv1956-Rv1957组成,分别编码1个抗毒素HigA和1个毒素HigB,以及发挥分子伴侣功能的MtbSecB,其中HigBA是一个典型的II型TA[18]。
HipBST是近期由多个研究团队发现的一种广泛存在于原核生物的新颖的3组分非经典TA[12, 14],与大肠杆菌HipBA具有较高的同源性[13]。其中毒素HipT与HipA的C端相似,同样有1个保守的激酶结构域,能够对大肠杆菌产生毒性,抑制大肠杆菌的生长[11-13]。抗毒素HipS位于毒素HipT上游,与大肠杆菌毒素HipA的N端具有20%相似性,能够直接中和HipT的毒性[11-13]。在hipS上游还编码1个与大肠杆菌抗毒素HipB相似的HTH结构域的DNA结合因子HipB,但HipB并不能直接中和毒素HipT的毒性,却可以调节hipBST操纵子的转录水平[11-13]。本文对最近发现的几种非经典TA进行总结,包括单顺反子的TA系统和3组分TA系统,特别是对这一广泛存在于原核生物的HipBST的中和机制进行概述。
1 毒素-抗毒素的分类及功能
1.1 TA的分类
据抗毒素的性质(蛋白质或RNA)及毒素被中和的方式,TA可以分为I~Ⅷ型(Fig.1)[8]。其中,I型、III型和VIII型TA中的抗毒素是RNA,而其余TA系统中抗毒素都是蛋白质。I型TA中的毒素一般是小的(一般小于60个氨基酸)疏水性的膜蛋白质,会造成细胞膜损伤和细胞分裂缺陷,抗毒素是短的反义RNA,通过与编码毒素的mRNA结合,抑制毒素的转录来中和毒性[15-17];III型TA中,毒素一般为核酸内切酶,抗毒素通过与毒素形成蛋白质-RNA复合物从而抑制毒素的活性[18-21]。II型、Ⅳ型、V型、VI型和VII型TA中抗毒素和毒素都是蛋白质。II型TA中的毒素一般为酶,主要抑制DNA复制和翻译过程,例如含RES结构域的毒素ParT通过水解细胞内的NAD使细菌死亡,抗毒素ParS可以直接抑制毒素的酶活[3, 22-25]。在Ⅳ型TA中,抗毒素能够通过干扰毒素与底物的结合,而并不是通过直接与毒素的结合调节毒素的毒性,IV型TA YeeU-CbtA,毒素CbtA靶向结合MreB和FtsZ来影响细胞形态和分裂,抗毒素YeeU与FtsZ结合,通过维持它的稳定性抑制毒素CbtA的活性[26]。V型TA中的抗毒素则是一种RNA酶,通过切割对应毒素的mRNA来阻止毒素的积累,GhoT-GhoS首个被发现的V型TA,其中毒素GhoT通过破坏细胞膜来发挥毒性,抗毒素GhoS能够靶向GhoT的mRNA并切割[27-29]。VI型TA中毒素SocB通过抑制DNA复制延伸来抑制细胞活性,抗毒素SocA促使毒素SocB被蛋白酶ClpXP降解[30]。VII型TA中毒素的活性主要是影响细胞膜的形成和核酸酶活性,而抗毒素同样具有酶的功能,通过对毒素进行翻译后修饰,例如磷酸化、腺苷酸化修饰等从而中和毒性[31-37]。而VIII型TA中毒素与抗毒素同为RNA,毒素活性主要是隔绝tRNA或抑制mRNA靶标,抗毒素则通过抑制毒素的转录来中和毒性[38]。
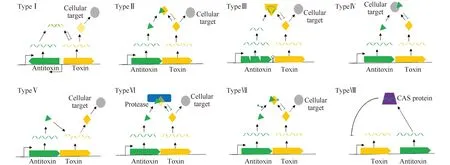
Fig.1 Schematic diagram of toxin and antitoxin effect of type I-VIII TA The antitoxin of type I and III TA system is RNA. The antitoxin of type I TA neutralizes the toxicity by binding to the mRNA encoding the membrane protein toxin and inhibiting its transcription, while the antitoxin of type III TA neutralizes the toxicity by binding to the toxin forming protein-RNA complex. The antitoxin and toxin of type II, IV, V, VI and VII TA systems are all proteins. The antitoxin of type II TA system binds directly to the toxin, inhibits the enzyme activity of the toxin or regulates the activity of the toxin through allosteric effect. The antitoxin of type IV TA system can interfere with the binding of toxin to substrate, and the antitoxin of type V TA system prevents the accumulation of toxin by cutting the mRNA of the toxin. The antitoxin in type VI TA system promotes the toxin to be degraded by protease, and the antitoxin in type VII TA system neutralizes the toxicity by post-translational modification. In type VIII TA system, the toxin and antitoxin are both RNA and the antitoxin neutralizes toxicity by inhibiting the transcription of toxin (modified from references[8])
1.2 TA的生物学功能
虽然TA在微生物中普遍存在,但是绝大多数TA的生物学功能仍然未知。研究表明,TA在促进微生物抗逆性[22, 39, 40]、维持基因组稳定性[2, 3]、促进持留菌形成[22, 39, 40]、抵抗噬菌体感染[4-7]和促进细菌程序性死亡[41]等方面发挥功能,但一些功能尚有争议。目前TA被广泛接受的功能如下。
1.2.1 维持质粒稳定性 F质粒上的CcdA/CcdB是首个被鉴定的TA[2],它能够稳定质粒,毒素CcdB是一个解旋酶,通过抑制促旋酶Gyrase的活性影响DNA复制,最终导致细菌死亡,而抗毒素CcdA不稳定,必须持续不断的合成才能阻止毒素CcdB的释放[3]。如果携带ccdAB的质粒丢失,由于抗毒素不能得到补充,导致毒素CcdB从细胞中存在的CcdAB蛋白质复合体脱离,从而对细菌产生毒性[3]。
1.2.2 TA在抵御噬菌体中的作用 在长期的进化过程中,细菌进化出多种策略抵御噬菌体的侵染,例如CRIPSR系统和限制-修饰系统等[42, 43]。TA自1996年首次报道可以抗噬菌体[44]。目前,TA在抵御噬菌体中的作用得到了广泛认可。细菌的其他防御系统通常能够区分非己和自己,而TA则不能,因此,细菌中的TA必须在被噬菌体感染前保持沉默[4-7],一旦被噬菌体感染,TA就会快速激活,毒素可以干扰噬菌体感染的各个阶段而不仅仅是CRISPR和限制-修饰系统主要针对噬菌体DNA或者RNA[42, 43],例如毒素可以通过抑制噬菌体的复制,阻止子代噬菌体的成熟[45],也可以靶向宿主关键蛋白质,导致被噬菌体感染的细菌的死亡,防止噬菌体扩散感染[46]。
大肠杆菌RnlAB 是研究比较清楚的具有抗噬菌体功能的TA,RnlA作为毒素,是1个HEPN家族核酸内切酶,可以降解大肠杆菌的mRNA,抑制其生长,RnlB是抗毒素,通过结合在HEPN二聚体界面,阻止底物接近其RX4H酶活中心[4, 5]。它对缺乏dmd基因的T4噬菌体表现出极强的抵御能力[5, 7],Dmd对于T4噬菌体发育晚期稳定mRNA至关重要[6]。
DarTG TA是最近被鉴定的具有抗噬菌体功能的TA,DarTG可以赋予大肠杆菌抵抗T5和RB69噬菌体的能力[45],毒素DarT是一个具有ADP-核糖转移酶功能的酶,能利用NAD将单链DNA的胸腺嘧啶上的碱基进行ADP-核糖基化修饰,抑制DNA的合成,而抗毒素DarG具有ADP-水解酶功能,可以逆转毒素DarT对底物的修饰。在噬菌体感染过程中,毒素DarT可以将噬菌体DNA进行ADP-核糖基化修饰,导致噬菌体DNA合成被抑制,阻止噬菌体产生子代[45]。
1.2.3 促进持留菌的形成 持留菌(persister)是微生物群体在抗生素或者其他环境条件胁迫下,进入“停止生长但保留一定代谢活性”的极小部分成员。这些细胞处于休眠状态,能够帮助微生物群体度过极端环境,是临床上一些由致病菌感染所导致的疾病反复发作的重要原因[47]。越来越多的研究发现,TA系统与持留菌的形成密切相关,其中大肠杆菌HipBA是最早发现与促进持留菌形成的TA系统。在应激环境中,抗毒素HipB被活化的Lon蛋白酶降解,HipA毒素从HipB-HipA复合物中释放出来,游离在细胞内。游离的HipA磷酸化谷氨酰-tRNA合成酶(GltX),导致无电荷的tRNAGlu累积,从而抑制蛋白质翻译过程,最终抑制细菌生长并形成持留菌[48, 49]。除了HipBA,Ccd、PasTI和RelBE等TA也被认为与持留菌形成相关[50]。
2 非经典的毒素-抗毒素系统
经典的TA系统通常只包含一个毒素和对应的抗毒素,随着研究的深入,越来越多的非经典TA系统被鉴定出来,主要包括单顺反子TA系统和3组分TA系统(Table 1)。
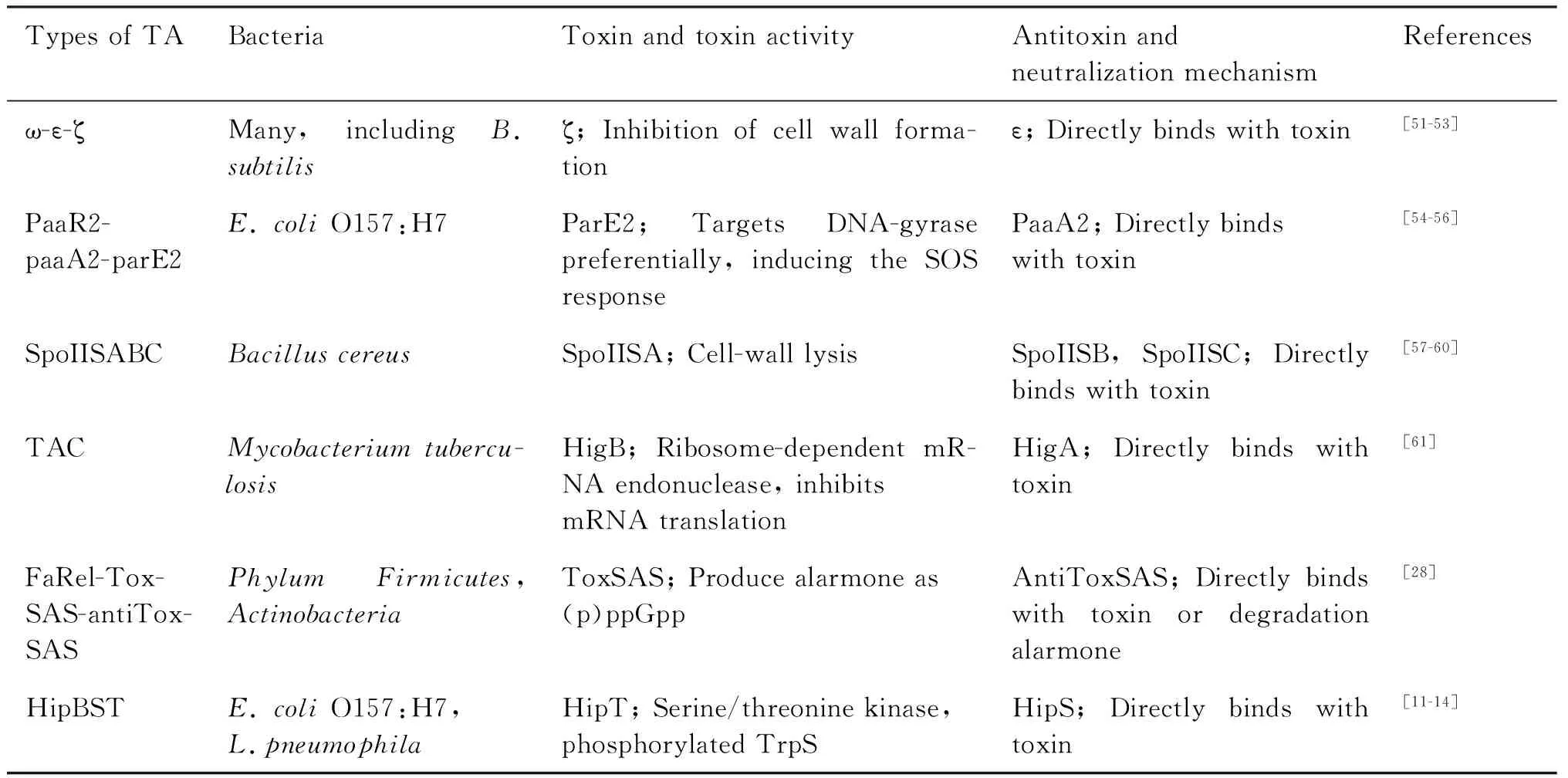
Table 1 Types of TA with three components
2.1 单顺反子TA系统
有些TA的毒素和抗毒素融合在一起,被称为单顺反子TA系统[9, 35, 36],例如最近研究发现的CapRelSJ46TA[10]。CapRelSJ46是N端与细菌信号素分子(alarmone)合成酶同源,可以合成腺苷四磷酸(ppApp),累积的ppApp以及细胞内三磷酸腺苷(ATP)和三磷酸鸟苷(GTP)的消耗会导致蛋白质合成的抑制和细菌生长的停滞;其C端的结构域充当抗毒素的功能,对N端的毒素发挥调控作用[9]。此外,其他类型的单顺反子TA系统也有报道,例如MNT-HEPN TA中抗毒素和毒素融合在一起[35, 36, 62],但其如何发挥功能还不清楚。
2.2 3组分TA及作用机制
2.2.1 ω-ε-ζTA ω-ε-ζ 是在pSM19035质粒上发现的一种3组分TA,在枯草芽孢杆菌(B.subtilis)、粪肠球菌(Enterococcusfaecalis)、以及酿脓链球菌(Streptococcuspyogenes)中都有被发现[51-53]。其中,ε-ζ是一个典型的Ⅱ型TA,毒素ζ为激酶,在结构上与单核苷酸或多核苷酸酶相似度较高[63]。尿苷二磷酸N-乙酰基-D-葡糖胺(UDP-N-acetylglucosamine, UNAG)为细胞壁合成的前体,毒素ζ特异性磷酸化UNAG,生成UNAG-3P,作为肽聚糖前体关键合成酶MurA的竞争性抑制剂,从而干扰肽聚糖的生物合成[64, 65]。此外,UNAG同样是革兰氏阳性菌中磷壁酸合成的重要前体,所以毒素ζ也能够抑制磷壁酸的生成[64]。抗毒素ε可以将氨酸和苯丙氨酸的侧链伸入毒素ζ的ATP/GTP结合口袋,通过阻止ATP的结合抑制ζ活性[63]。而ω并不直接参与对细胞毒性与毒性中和作用过程,而是对ω -ε-ζ操纵子整体的调节[51]。
2.2.2 大肠杆菌paaR2-paaA2-parE2TA 在大肠杆菌O157:H7中发现,由PaaR2-PaaA2-ParE2组成的3组分TA[54-56],毒素ParE2定位在拟核上,与CcdA/CcdBTA相似,能够与DNA促旋酶结合产生毒性,而PaaA2则作为抗毒素直接与毒素ParE2结合形成PaaA2-ParE2异二聚的八聚体,使得ParE2远离作用底物[54]。第3个组分PaaR2能够抑制paaR2-paaA2-parE2操纵子的转录,对整个TA系统至关重要[55, 56]。
2.2.3 TA-chaperone(TAC)系统 TAC包含一个II型TA和SecB样分子伴侣(SecB-like chaperone),3个组分处于同一操纵子。TAC能够帮助维持抗毒素的稳定性从而阻止抗毒素的降解,协助抗毒素中和毒素的毒性[61, 66-68]。迄今为止,人们对于人类病原菌结核分枝杆菌(Mycobacteriumtuberculosis)的TAC理解最为清楚,它由3个基因Rv1955-Rv1956-Rv1957组成,分别编码1个抗毒素HigA和毒素HigB以及分子伴侣MtbSecB[61]。MtbSecB专一性地调控HigBA TA,研究发现,抗毒素C-端具有1个额外的羧基端,延伸区域富含芳香族氨基酸和碱性氨基酸,它们在一级序列是高度可变的,分子伴侣特异性地结合在抗毒素的C端,稳定抗毒素从而阻止其被降解,进而抑制毒素的毒性[61]。
2.2.4 FaRel-ToxSAS-antiToxSASTA Jimmy等人发现,在厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的多个物种中发现一个含有信号素分子合成酶的3组分TA。该系统中的毒素单结构域蛋白质(single-domain small alarmonesynthetases, SASs)通过消耗ATP和GTP,产生ppApp和pppGpp之类的信号素分子[28],导致细胞活性降低甚至死亡。在FaRel-ToxSAS-antiToxSAS TA中,毒素toxSAS周围有2个具有抗毒素功能的蛋白质,有趣的是它们分别以II型 TA 和IV 型TA的机制发挥中和toxSAS毒性的功能,一个可以通过直接与ToxSAS相互作用,抑制信号素分子的产生,另一个则直接将信号素分子降解[28]。
3 HipBST是一类广泛存在的新型3组分毒素-抗毒素
关于II型TA HipBA的研究比较清楚,人们发现,很多微生物中存在编码大肠杆菌毒素HipA_C端结构域蛋白质的基因hipA_C[69],但是缺乏对它们的深入研究。最近发现,hipA_C、hipA_N和hipB共同组成1个3组分TA-HipBST[11, 14],并且它们在细菌的底物以及毒素被中和的方式与大肠杆菌的HipBA明显不同。
3.1 HipBA的组成及中和机制
经典的II型TA HipBA广泛存在于细菌中,由毒素HipA和抗毒素HipB组成,2个基因处于同一个操纵子并可以共转录[48, 49, 70, 71]。大肠杆菌中HipA是一种由440个氨基酸组成的丝氨酸/苏氨酸激酶,具有保守的负责结合ATP的P-环(P-loop)和对催化发挥关键作用的天冬氨酸[48, 72]。HipA通过磷酸化谷氨酰-tRNA合成酶(GltX)第239位的丝氨酸,阻止GltX结合ATP,导致无电荷tRNAGlu的累积,从而抑制蛋白质翻译[39, 73, 74]。除了磷酸化GltX,在新月柄杆菌(Caulobactercrescentus)编码的3个HipBA中,HipA1和HipA2可以分别磷酸化赖氨酰tRNA合成酶LysS和色氨酰tRNA合成酶TrpS[71]。HipA对蛋白质翻译的抑制可以被抗毒素HipB中和,HipB是一个具有典型螺旋-转角-螺旋 (helix-turn-helix,HTH)结构域的转录因子,它可以结合在hipBA操纵子上游的TATCCN8GGATA基序,HipB与HipA形成HipBA复合物后也可以结合在hipBA操纵子的启动子区,通过抑制hipBA的转录从而中和HipA的毒性[75]。目前,关于HipB中和HipA的分子机制仍不清楚,根据已经解析的HipB-HipA复合体的结构,HipB和HipA形成(HipA)2-(HipB)2异源四聚体,HipB二聚体被2个HipA夹在中央,通过与HipA的N-端特异性结合,形成一个三明治样结构[39, 49, 76]。与其他II型TA不同的是,抗毒素直接和毒素的酶活中心结合,抑制毒素的毒性;而HipB远离HipA的激酶活性中心,推测HipB的C端结合在HipA的一个口袋,可以调控它的激酶活性[76]。此外,HipA毒性的调节也受其P-环自磷酸化的影响,位于P-环中保守的S150的磷酸化,使P-环处于向外状态,阻止ATP的结合,导致其激酶活性的丧失[48, 72]。
3.2 HipBST组成一个3组分TA
最近,研究人员通过在微生物基因组中用大肠杆菌HipA进行相似性搜索,意外发现了广泛存在于微生物中的短的HipA样蛋白质(HipA-like protein)HipT[12, 13],长度约310个氨基酸,与大肠杆菌HipA相比,HipT缺乏HipA_N端的大约100个氨基酸,这些大量存在的高度保守的HipA样蛋白质在NCBI数据库中被标注为包含HipA_C蛋白质家族[12, 13],它们都具有HipA保守的P-环以及对激酶活性关键的天冬氨酸[11, 13, 77]。有趣的是在这些短的HipA样蛋白质家族中,其上游开放阅读框编码一个100个氨基酸左右的小蛋白质HipS,巧合的是,HipS与大肠杆菌HipA的N端具有20%的相似性,从一级序列看,HipT和HipS就像HipA断裂产生的,而HipS的上游基因编码一个与HipB具有同源性的HTH型DNA结合转录因子[11-13]。在大肠杆菌中过表达具有激酶结构域的HipT对细菌的生长表现出严重的毒性,HipT可以磷酸化色氨酰tRNA合成酶TrpS197位保守的色氨酸,而HipT和HipS的共表达则可完全缓解HipT对细菌的生长抑制,而共表达HipT和HipB则不能缓解HipT对大肠杆菌的毒性,这说明由HipA“断裂”而来的HipT和HipS分别作为毒素和抗毒素(Fig.2)[11-13]。随后,研究人员在细菌和古菌中进行hip基因的进化分析,发现了10种新的不同于HipBA的TA,例如单顺反子编码的HipL具有一个激酶核心、HipS结合于和一个结合单链DNA的HIRAN结构域,这说明了hip相关基因在微生物基因组中分布的广泛性和多样性(Fig.3)[12]。
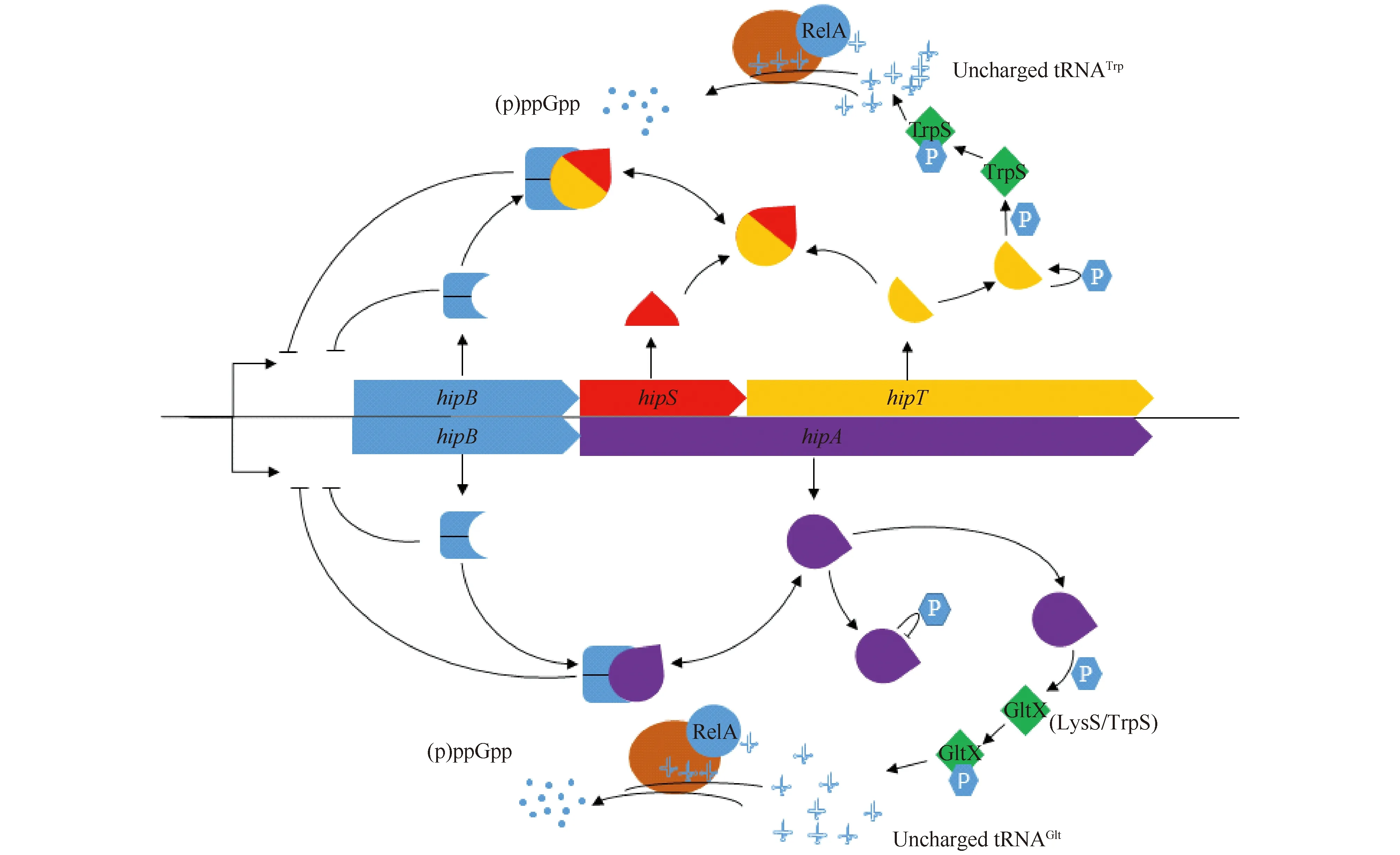
Fig.2 Comparative schematic diagram of the action mechanism of HipBST and HipBA HipT inactivates TrpS by phosphorylation, and the inactivation of TrpS increases the level of uncharged tRNATrp, which binds to RelA and enters the ribosomal A site. Binding to RelA-tRNATrp complex at site A can activate RelA synthesis of (p) ppGpp. The function of HipT autophosphorylation is unclear. In addition, HipBST proteins form one or more complexes, and HipT is inactivated by HipS. HipB contains a HTHDNA binding motif and may automatically adjust the hipBST operon; HipA inactivates GltX(LysS/TrpS) by phosphorylation, and the inactivation of GltX increases the level of uncharged tRNAGlt, which binds to RelA and enters the ribosomal A site. Binding to RelA-tRNAGlt complex at site A can activate RelA synthesis of (p) ppGpp. Autophosphorylation of HipA inhibits its self-activity. In addition, HipBA protein forms a complex and HipA is inactivated by HipB. HipB contains a HTHDNA binding motif and may automatically adjust the hipBA operon (modified from reference[13])
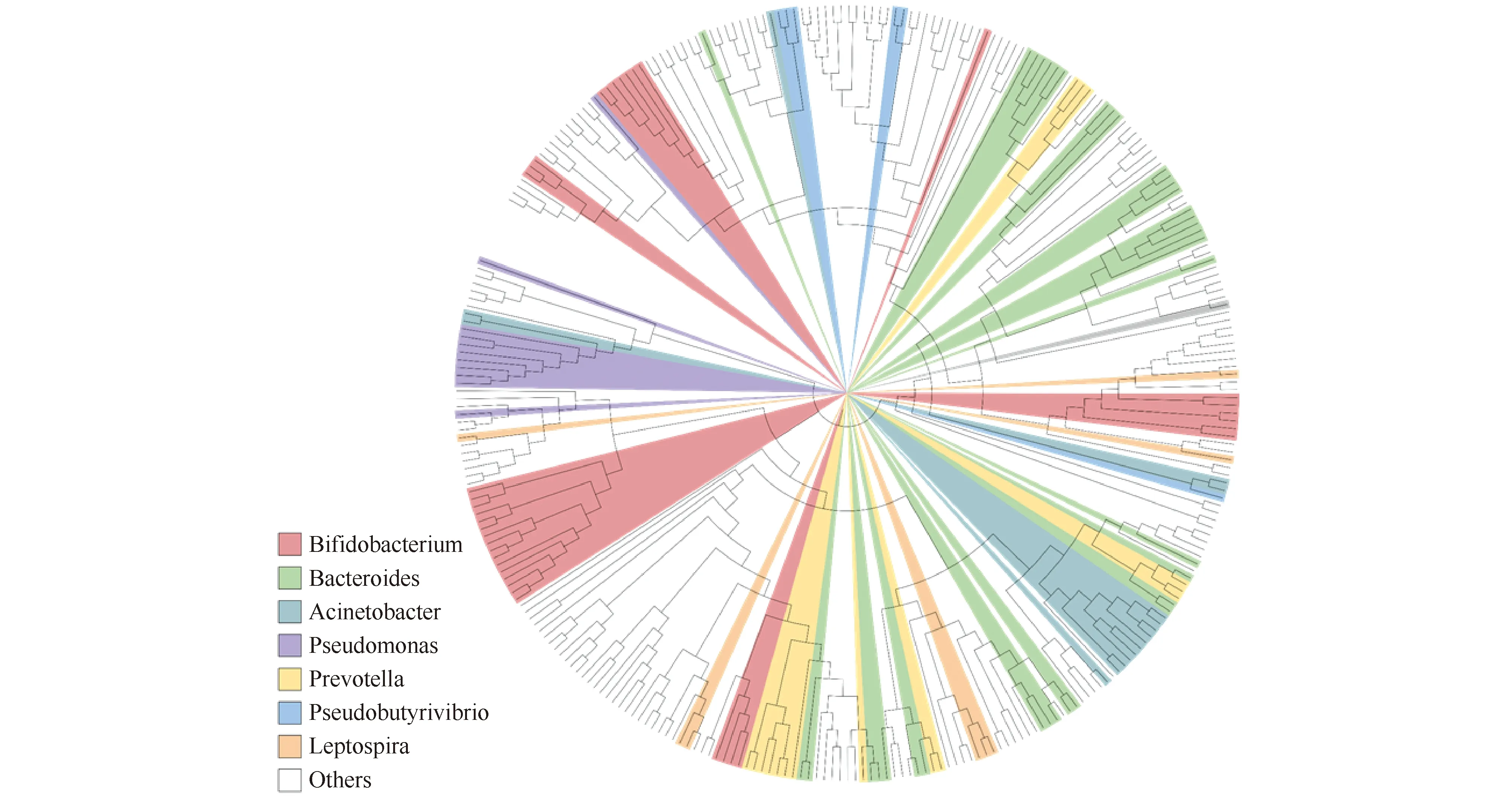
Fig.3 Distribution of HipA_C-terminal domain like proteins in bacteria HipA_C-terminal domain like proteins were widespread in bacteria, the phylogenetic tree of these proteins was drawn according to maximum likelihood and stained according to the classification in the lower left corner
近期,我们实验室在研究嗜肺军团菌(Legionellapneumophila)效应蛋白质时发现,最初被鉴定为RING型泛素连接酶的效应蛋白Lpg2370与大肠杆菌HipA具有约20%同源性,特别是具有HipA保守的丝氨酸-苏氨酸的P-环以及激酶催化活性依赖的天冬氨酸,并且通过质谱分析发现,Lpg2370 P-环上第54位保守的Ser存在自磷酸化,表明Lpg2370可能是一个丝/苏氨酸激酶[14]。随后,通过X-射线晶体学解析了Lpg2370的结构,发现Lpg2370的确具有一个典型的激酶结构域,并且其P-环以及被磷酸化的Ser54上的磷酸基团清晰可见,而并未发现Lpg2370与经典的E3泛素连接酶结构有任何形似性[14]。通过Dali search分析发现,Lpg2370确实与大肠杆菌的HipA结构最为相似[14, 78]。分析Lpg2370在基因组中的位置,发现与Lpg2370处于相同操纵子编码的Lpg2368和Lpg2369分别与HipB以及HipA的N端具有约20%的同源性,这表明Lpg2368~2370可能是嗜肺军团菌中潜在的HipBST。进一步的研究表明,在嗜肺军团菌中过表达Lpg2370可以显著抑制嗜肺军团菌的生长,并且Lpg2370对嗜肺军团菌生长的抑制依赖于其激酶活性,这说明Lpg2370对嗜肺军团菌具有毒性,并且其底物具有种属特异性[14, 78]。与E.coliHipBST类似,Lpg2370对嗜肺军团菌的菌毒性可以直接被Lpg2369完全中和,而Lpg2368对Lpg2370的毒性无显著直接影响,体外生物化学研究证据表明,Lpg2370可以与Lpg2369形成2元复合物,并能进一步与Lpg2368形成3元复合物,这与之前在大肠杆菌E.coliO127的HipBST现象一致[11-14]。
3.3 HipBST中和机制
HipBST中的毒素和抗毒素分别与大肠杆菌毒素HipA的激酶结构域和N端有同源性,而不直接依赖于HipB,这说明HipBST的中和机制完全不同于HipBA[78];此外,自磷酸化的HipT的P-环的构象与HipA未被磷酸化的构象一样,说明磷酸化的HipT处于一个激活状态[11-13]。等温滴定量热法证实,HipT磷酸化后仍可结合ATP,这进一步被HipT-AMP-PNP的结构证实,发现ATP结合在HipT被P-环包裹的一个腔中(Fig. 4C)[11-14, 78]。为了阐明HipBST的中和机制,研究人员又进一步解析了嗜肺军团菌HipBST中毒素HipT与抗毒素HipS的复合物。HipT-HipS的整体结构与HipA结构较为相似,抗毒素HipS结合的位置基本在HipA缺失的N端[11-14]。为了解释HipS的结合如何导致HipT毒性的丧失,通过比较解析HipBST的一系列结构,发现HipS的结合导致了HipT的P-环的构象发生了构象变化,由环变成了一个短的α螺旋(Fig.4A、B)[14, 78]。进一步比较HipT与HipT-AMP-PNP的结构,证实HipT P-环的别构效应产生的螺旋,与ATP之间存在空间位阻,阻止了HipT与ATP的结合(Fig.4A、B、C)[14, 78]。
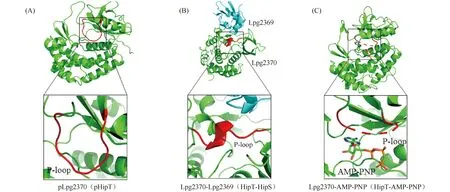
Fig.4 The toxicity neutralization mechanism of the HipBST TA The structures of apoHipT (PDB: 7VKC), HipT-HipS (PDB: 7VKB) and HipT-AMP-PNP(PDB: 7WCF), the conformation change of the p-Loop of the toxin induced by the binding of antitoxin are highlighted in figure A (bottom panel) and figure B (bottom panel), which prevents the ATP binding when compared to the structure of HipT-AMP-PNP (Fig. 4C)pLpg2370(pHipT)Lpg2370-Lpg2369(HipT-HipS) Lpg2370-AMP-PNP(HipT-AMP-PNP)
大肠杆菌HipBST的三元复合物结构最近也被解析[11]。结果显示,该复合体是形成由二聚化HipB介导的异源6聚体,并且HipB只与HipT存在相互作用,而不与HipS结合。与军团菌HipBST不同的是,E.coliHipBST的HipT的P-环存在2个丝氨酸,这2个丝氨酸S57和S59都被磷酸化,然而S57和S59的磷酸化有不同的功能,这说明HipT存在复杂的自我调控能力[11, 14]。
HipBST中HipB虽然不能直接中和HipT的毒性,却是HipBST不可缺少的,作为具有结合DNA能力的转录因子,HipB可以结合在hipBST操纵子的启动子区,能够有效的抑制hipBST的转录[11-13],因此,不同于II型TA中抗毒素具有中和毒素和对TA发挥转录调控的功能,而HipBST中这一功能由HipS和HipB分别执行[11, 14]。然而,关于HipB的具体功能,仍然需要进一步研究。
4 问题与展望
虽然TA广泛存在于原核生物基因组,然而目前对于TA的生物学功能知道的非常有限。HipBA作为一个研究相对较为清楚的II型TA,最近HipA同源蛋白质被发现大量存在于微生物基因组中[12, 13],这说明了HipBA的多样性,然而仅有HipBST已被研究证实,其他HipBA样的TA有待进一步深入研究。虽然目前HipBST的中和机制被揭示,但是HipBST的生物学功能仍不清楚,仍需要继续研究,特别是嗜肺军团菌HipBST中的毒素兼具效应蛋白质功能,除了在细菌体内会发毒素功能外,它也可以通过VI型分泌系统转运到宿主胞内,然而对于它在宿主内的功能也需要进一步研究。除了毒素HipT(Lpg2370),水稻条斑病毒(Xanthomonasoryzaepv.oryzicola)II型TAAvrRxo1ORF1-ORF2中,毒素AvrRxo1也被证实是一个III型效应蛋白质[14, 79, 80]。总之,这些发现为效应蛋白质和TA中的毒素在进化上提供了线索。
药物耐受性是临床上治疗致病菌感染要面对的主要难题之一,而细菌的耐药性主要依赖于持留态细菌的形成,TA系统被认为与持留菌的形成有关[66, 81, 82],例如Shaleen B Korch等人发现,大肠杆菌中的hipA7能够使菌种对抗生素的耐受性提高100倍以上[83]。同时发现,带有hipA7的菌种对多种药物的耐受性提高,例如,氟喹诺酮类药物、β-内酰胺类抗菌剂和氨基糖苷类抗生素[84],这为以TA为靶标的微生物感染治疗提供了理论基础。噬菌体治疗是解决耐药微生物问题的一个重要替代策略[85],而HipBST经常与其它具有抗噬菌体功能的基因出现在细菌的防御岛,暗示着HipBST可能也具有抵御噬菌体侵染的功能[86]。因此,对于HipBST是否具有抗噬菌体的功能的研究,可能为噬菌体治疗在相关病原菌的防控提供理论基础。