乌头汤对白细胞介素-1β诱导的退变软骨细胞外基质稳态的影响
邱志伟,付长龙,李宇涛,金灵璐,涂海水,仲卫红
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.福建中医药大学中医学院,福建 福州 350122;4.福建中医药大学附属康复医院,福建 福州 350003;5.福建省康复技术重点实验室,福建 福州 350003)
骨关节炎(osteoarthritis,OA)是目前最常见的慢性退行性关节疾病,是由各种因素导致的软骨退变、软骨下骨硬化和骨赘形成[1]。OA 患者常伴有关节疼痛、肿胀、畸形、活动受限和关节功能丧失,严重影响患者生活。目前临床多采用物理治疗、康复训练、药物及手术治疗等方式延缓OA 疾病进程,但治疗周期较长,费用较高,治疗效果仍有待提高,因此寻找治疗OA 的有效方法,并探讨其发病机制是目前医疗界亟需解决的问题之一[2]。关节软骨主要由软骨细胞和软骨细胞外基质(extracellular matrix,ECM)组成。ECM 可以为关节提供加压能力,使关节具有强大的承重能力,防止软骨受到机械应力的破坏,因此ECM 是影响关节稳定性和关节软骨结构完整性的重要因素[3]。前期临床研究发现,乌头汤可有效改善骨关节炎患者关节功能障碍,提高关节活动度[4],但其具体作用机制尚不明确。本研究选用乌头汤作为干预媒介,以白细胞介素-1β(interleukin-1β,IL-1β)诱导的退变软骨细胞作为研究载体,观察乌头汤对退变软骨细胞ECM 稳态的影响,为其临床应用提供理论依据。
1 实验材料
1.1 实验动物 4 周龄SPF 级SD 雄性大鼠10 只,体质量(90±10)g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2017-0005。饲养于福建中医药大学实验动物中心,恒温恒湿,常规饲养7 d,许可证号:SYXK(闽)2019-0007。所有实验程序均经福建中医药大学动物实验伦理委员会批准(2019122)。
1.2 实验药物 乌头汤药物组成:制川乌6 g,麻黄9 g,黄芪9 g,炙甘草9 g,芍药9 g,由福建中医药大学第三人民医院提供。乌头汤水提物制备:制川乌先煎1 h,随后再依次加入其余4 味药材煎煮1 h;用滤网过滤乌头汤药液,除去残渣,将药液放入旋转蒸发仪中制备成浸膏,随后通过水浴装置60 ℃条件下将其蒸干;蒸干后转移至低温冰上将其缓慢研磨至粉末状。将乌头汤浸膏粉末和含5 %胎牛血清(FBS)的DMEM 培养基在超声波下进行充分混匀,最终配制浓度为10 mg/mL 乌头汤水提物,0.22 μm无菌滤膜过滤后于4 °C 冰箱存放待用。
1.3 实验试剂 Ⅱ型胶原酶、IL-1β 试剂盒购自美国Sigma 公司(批号:MKCL5731、12393);GAPDH 抗体、基质金属蛋白酶(matrix metalloproteinase,MMP)-13 抗体和山羊抗兔二抗均购自美国Proteintech 公司(批号:10494-1-AP、18165-1-AP、SA00001-2);MMP-3、含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(a disintesrin and metalloprotease with thrombospondin type Ⅰ motifs,ADAMTS)-4 抗 体、ADAMTS-5 均购自北京博奥森生物技术有限公司(货号:bs-0413R、bs-4191R、bs-3573R);RNA 提取试剂、逆转录试剂盒均购自南京诺唯赞生物技术有限公司(货号:R401-01、R211-02)。
1.4 实验仪器 ELx800 全自动酶标仪(美国Bio-Tek 公司);CFX96 Touch 实时定量PCR 仪(美国Bio-Rad 公司)。
2 方 法
2.1 大鼠原代软骨细胞培养 使用面罩在2 L/min气体流量中用5%异氟醚麻醉SD 大鼠,并采用人工脱颈法处死。大鼠双膝及周围部位用75%乙醇消毒,双膝关节分离后带入超净台内操作。PBS 缓冲液清洗分离的大鼠膝关节,将透明软骨小心剃取,置于无菌培养皿内,并切碎至约1 mm3大小。再次使用PBS 缓冲液清洗切碎的软骨,加入0.2%的Ⅱ型胶原酶后置入37 ℃、5% CO2的培养箱中消化。约4~6 h 后可消化完全,转移至无菌离心管中于1 000 r/min 下离心3 min。结束后去除上层上清液,往下层沉淀组织中加入含有10% FBS 的DMEM 培养基终止消化,并将其转移到培养瓶中培养,每2 d换1 次液。镜下观察并拍照记录软骨细胞的生长速度及形态,在其占满培养瓶的80%时及时进行传代培养。观察到软骨细胞传代到第3 和第4 代时容易产生大量的去分化软骨细胞,软骨细胞的表型就会丢失,因此我们选择第2 代软骨细胞进行后续实验。
2.2 分组和干预 将第2 代软骨细胞悬液以1×105/mL 密度移至6 孔板,随机将软骨细胞分为空白组、模型组和乌头汤组。空白组使用含10%FBS 的DMEM 培养基进行培养;模型组采用10 ng/mL IL-1β 干 预24 h 复 制 退 变 软 骨 细 胞 模型[5];乌头汤组采用10 ng/mL IL-1β 干预24 h 后使用150 μg/mL乌头汤水提物干预24 h[6]。
2.3 qPCR 检 测软 骨细 胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 mRNA 相对表达水平 根据Trizol 试剂说明书提取软骨细胞总RNA,检测RNA浓度。对qPCR 扩增曲线和溶出曲线进行确认,采用2-△△Ct方法比较目的基因与内参基因平均CT 值差异,并对结果进行定量。PCR 引物由福州尚亚生物有限公司设计,引物序列见表1。
2.4 Western blot检测软骨细胞中MMP-3、MMP-13、ADAMTS-4和ADAMTS-5蛋白表达量 提取各组软骨细胞总蛋白,BCA 定量后高温变性处理,进行电泳、转膜、封闭,4 ℃条件下置于GAPDH(1∶10 000)、MMP-3(1∶1 000)、MMP-13(1∶1 000)、ADAMTS-4(1∶1 000)、ADAMTS-5(1∶1 000)一抗孵育过夜。隔天置于山羊抗兔二抗(1∶5 000)室温孵育1 h,清洗后于PVDF 膜上滴加ECL 发光液进行显像处理。使用Image Lab 图像处理软件,比较显影条带中各指标的灰度值与内参灰度值并分析储存。
2.5 统计学方法 采用SPSS 26.0 软件进行统计分析。计量资料符合正态分布以(±s)表示,多组间比较采用单因素方差分析,方差齐时采用LSD-t法,方差不齐时采用Game's-Howell 法。P<0.05 为差异有统计学意义。
3 结 果
3.1 软骨细胞形态观察 大鼠原代软骨细胞在第6 天呈现不规则多边形附着于培养瓶上,见图1A;在第8 天以具有清晰细胞核的长纺锤线分布在培养瓶中,见图1B。传代后的第1 代软骨细胞在培养第5 天均匀分布在培养瓶上,杂质减少,贴壁时间缩短,见图1C。第2 代软骨细胞在第10 天占据培养瓶的80%以上面积,细胞形态良好,细胞核清晰,胞浆丰富,见图1D。
3.2 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5的mRNA 相对表达水平比较 与空白组比较,模型组MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 mRNA 相对表达水平明显提高(P<0.05);与模型组比较,乌头汤组MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 mRNA 相对表达水平明显降低(P<0.05)。见表2。
表2 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 mRNA 相对表达水平比较(±s)
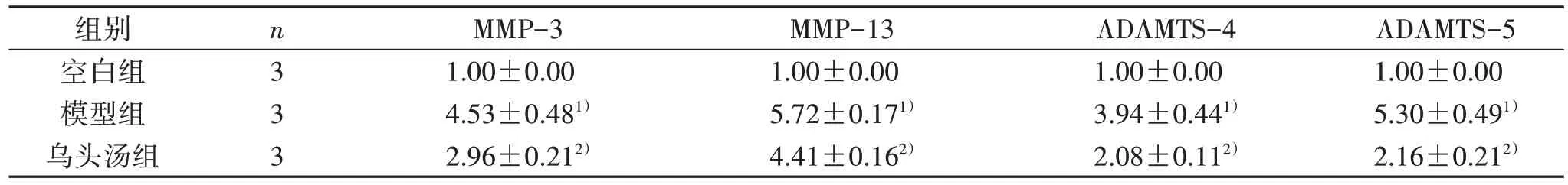
表2 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 mRNA 相对表达水平比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05。
ADAMTS-5 1.00±0.00 5.30±0.491)2.16±0.212)组别空白组模型组乌头汤组n3 3 3 MMP-3 1.00±0.00 4.53±0.481)2.96±0.212)MMP-13 1.00±0.00 5.72±0.171)4.41±0.162)ADAMTS-4 1.00±0.00 3.94±0.441)2.08±0.112)
3.3 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 蛋白表达量比较 与空白组比较,模型组MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 蛋白表达量明显提高(P<0.05);与模型组比较,乌头汤组MMP-3、MMP-13、ADAMTS-4和ADAMTS-5蛋白表达量明显降低(P<0.05)。见表3、图2。
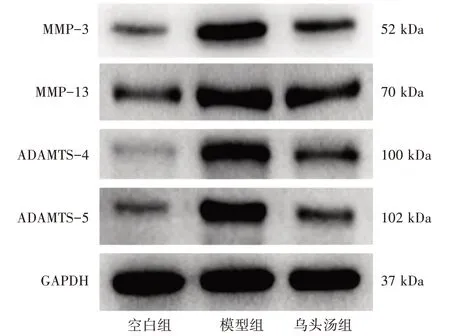
图2 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 蛋白条带图
表3 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 蛋白表达量比较(±s)
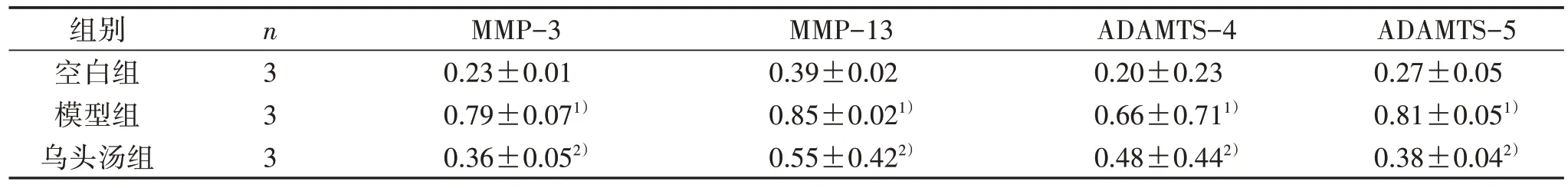
表3 3 组软骨细胞MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05。
ADAMTS-5 0.27±0.05 0.81±0.051)0.38±0.042)组别空白组模型组乌头汤组n3 3 3 MMP-3 0.23±0.01 0.79±0.071)0.36±0.052)MMP-13 0.39±0.02 0.85±0.021)0.55±0.422)ADAMTS-4 0.20±0.23 0.66±0.711)0.48±0.442)
4 讨 论
OA 作为一种疼痛性关节疾病,其特征包括关节软骨退行性改变和周围组织的病理变化。由于关节中ECM 的存在,机体在正常情况下可以承受数倍于体质量的压力,而关节软骨内却不产生摩擦[7]。这是由于ECM 通过蛋白聚糖和基质细胞蛋白等非纤维状分子相互连接,形成复杂的网络,该网络为关节提供结构完整性和组织功能所必需的机械特性[8]。在OA 患者中ECM 降解加剧并作为最主要的组织病理学特征。乌头汤出自《金匮要略》:“病历节不可屈伸,疼痛,乌头汤主之”“乌头汤方,治脚气,不可屈伸”,是临床治疗OA 的经方之一,功擅散寒除湿、温经通络[9]。方中以制川乌为君,主行温阳散寒除湿,止关节痹痛、屈伸不利;佐以麻黄为臣,重在祛风散寒、温通经络;黄芪益气补血;甘草缓急止痛、调和诸药;芍药缓解关节痹痛。五味药相辅相成,共奏温阳散寒、祛湿止痛、通利关节之功效[10]。乌头汤具有抗炎镇痛及改善微循环等作用[11],可改善关节机械性痛阈及局部皮温[12],恢复OA 患者膝关节活动,有效缓解关节疼痛,提高活动度。
MMP-3 和MMP-13 分别属于MMPs 中的间质溶解素和胶原酶,与OA 发展密切相关,它们可通过降解蛋白多糖和变性胶原进而促进OA 发展[13-14]。MMP-13 作为胶原酶通过切割Ⅱ型胶原参与软骨降解[15],而MMP-3 作为间质溶解素可以通过降解ECM 片段从而加剧软骨降解[16]。在OA 疾病中ECM合成和降解失衡,MMP-3 和MMP-13 表达升高加剧了OA 进展。本研究选用10 ng/mL IL-1β 溶液干预第2 代软骨细胞24 h,复制退变软骨细胞[17]。与空白组相比,模型组软骨细胞中MMP-3 和MMP-13的mRNA 相对表达水平和蛋白表达量明显提高,加速ECM 降解,研究结果与文献相符[18]。
ADAMTS 的分泌异常是导致ECM 中蛋白多糖降解的主要因素[19]。ADAMTS 是由19 种金属蛋白酶组成的家族,其中ADAMTS-4 和ADAMTS-5 是在人类OA 关节软骨中发现的主要聚集蛋白聚糖酶,它们在IGD 区域的Glu373-Ala374 位点处切割聚集蛋白聚糖,促进蛋白多糖的降解[20]。本研究结果显示,与空白组比较,模型组ADAMTS-4 和ADAMTS-5 mRNA 相对表达水平和蛋白表达量明显提高。ADAMTS-4 和ADAMTS-5 分泌异常导致蛋白多糖被水解,破坏软骨稳态,加剧ECM 降解,影响关节组织抗压能力,进一步诱导关节软骨退化。本研究结果表明,经过乌头汤干预后,软骨细胞中MMP-3、MMP-13、ADAMTS-4、ADAMTS-5 的异常表达得到改善,防止ECM 中Ⅱ型胶原降解以及蛋白多糖的水解,抑制ECM 降解。
综上所述,乌头汤通过抑制MMP-3、MMP-13、ADAMTS-4 和ADAMTS-5 表达来维持软骨细胞外基质稳态,延缓OA 软骨退变。但是本研究仍存在部分不足之处,例如只进行了体外细胞实验,以及尚未对乌头汤和痹症相关证型之间的关系进行深入分析。因此,后续会考虑纳入寒湿痹症OA 大鼠模型,观察乌头汤对寒湿痹症OA 大鼠的治疗效果。

