芪灵扶正清解方对Huh-7细胞能量代谢及糖酵解相关蛋白的影响
颜 硕,刘海琴,郭康悦,何家珺,曹治云,章尤权,林明和,陈旭征*
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.福建中医药大学中西医结合学院,福建 福州 350122;4.福建中医药大学药学院,福建 福州 350122;5.福建中医药大学附属第二人民医院,福建 福州 350003)
肝细胞性肝癌是临床上常见的消化系统恶性肿瘤之一。据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020 年全球最新癌症负担数据显示,在全球发病率与病死率中肝细胞性肝癌分别居第6 位与第3 位[1],肝细胞性肝癌已成为我国高发疾病之一。该病起病隐匿、肿瘤生长迅速、高复发转移率与多药耐药是肝癌患者生存率较低的主要因素,目前仍无理想的治疗药物。芪灵扶正清解方(Qiling Fuzheng Qingjie formula,QFQ)为福建中医药大学附属第二人民医院杜建教授经验方和院内制剂,是消化道肿瘤患者围手术期和围放化疗期的辅助用药,能多方面调理患者基础治疗后导致的体质虚弱,提升抗御外邪之力,具有抑制肝癌细胞生长的作用[2],然而其抑制肝癌细胞生长的作用机制仍未明确。近年研究发现,肝癌细胞不管是否处于缺氧环境,其细胞内高活性的糖酵解是肝癌细胞增殖期间所需能量的主要来源[3],抑制肝癌细胞糖酵解成为筛选抗癌药物的新途径。因此,本研究基于与肝癌细胞密切相关的糖酵解途径,探讨QFQ 对肝癌细胞能量代谢及糖酵解相关蛋白的影响,进一步阐明QFQ抑制肿瘤细胞生长的机制。
1 实验材料
1.1 实验细胞 Huh-7 细胞购自中科院上海细胞库。
1.2 实验试剂 Seahorse XF 细胞糖酵解速率测定试剂盒、实时ATP 速率试剂盒均购自中国安捷伦科技有限公司(货号:103344-100、103592-100);缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)、己糖激酶(hexokinase,HK)、葡萄糖转运蛋白(glucose transporter,Glut)1、Glut3、GAPDH 等一抗及二抗均购自武汉三鹰生物技术有限公司(货号:66730-1-Ig、15656-1-AP、21829-1-AP、20403-1-AP、60004-1-Ig);CCK8 试剂(大连美仑生物技术有限公司,货号:MA0218);胎牛血清、高糖DMEM 培养基和胰蛋白酶均购自美国Gibco 公司(货号:10100147、11965092);青-链霉素(美国Hyclone 公司,货号:SV30010)。
1.3 实验仪器 Seahorse XFe 96 细胞能量代谢分析仪(中国安捷伦科技有限公司);CO2培养箱、多功能酶标仪均购自美国Thermo 公司;化学成像分析系统(广州博鹭腾生物科技有限公司);电泳仪和电泳槽(美国Bio-Rad 公司)。
2 实验方法
2.1 QFQ 醇提取物制备 QFQ 由黄芪30 g,女贞子15 g,灵芝30 g,山药15 g,白花蛇舌草30 g,夏枯草15 g 组成。准备15 剂QFQ,粉碎后称重,置于75%乙醇中浸泡2 h。第1 次在1∶3 料液比下置于85 ℃水浴锅回流提取1 h,收集滤液;第2 次在1∶2 药液比下以相同方法进行提取并收集滤液。合并2 次滤液,置于旋转蒸发仪上,于60 ℃、30 r/min 下旋蒸除去多余溶剂,挥干,置于-20 ℃冰箱储存备用。
2.2 细胞培养 将Huh-7 细胞培养于DMEM 高糖培养基中,置于37 ℃、含5 % CO2培养箱,待细胞长至对数期,开展后续实验。
2.3 CCK8 法检测细胞活力 将细胞接种于96 孔板,加入0、62.5、125、250、500 μg/mL QFQ 醇提物,分别干预24、48、72 h 后,每孔中加入10 μL CCK8溶液继续在培养箱孵育2 h,在多功能酶标仪490 nm波长处测量各孔吸光度(A值),计算细胞活力。
2.4 细胞能量代谢相关指标检测 将Huh-7 细胞悬液以5 000个/孔接种在XF96细胞培养板中,背景校正孔不接种细胞,静置1 h 后放入37 ℃的CO2培养箱中过夜培养,分别给予0、62.5、125、250 μg/mL QFQ 醇提物干预24 h,同时水化探针板,配置Seahorse 海马检测液,应用细胞能量代谢分析仪,根据实时ATP 速率试剂盒说明书检测线粒体ATP 产生速率、糖酵解ATP 产生速率、实时耗氧率、胞外酸化率,根据细胞糖酵解速率测定试剂盒说明书检测糖酵解速率、质子流出速率,采用Wave 2.6.1 软件分析数据。
2.5 Western blot 检 测Huh-7 细 胞HIF-1α、HK、Glut1 和Glut3 蛋白表达量 按1×105个/mL 密度将Huh-7 细胞接种于10 cm 培养皿中,当细胞培养生长至60%~70%时,将Huh-7 细胞分为0、62.5、125、250、500 μg/mL 组,分别予相应浓度的QFQ 醇提物干预24 h。裂解细胞后提取总蛋白,经过蛋白变性、电泳、转膜后,5 %脱脂奶粉室温摇床封闭1 h,TBST洗涤后置于HIF-1α(1∶2 000)、HK(1∶1 000)、Glut1(1∶1 000)、Glut3(1∶1 000)、GAPDH(1∶1 000)一抗中4 ℃孵育过夜,经TBST 洗涤后置于二抗溶液(1∶10 000)中,室温下摇床孵育1 h,TBST 洗涤3 遍(每遍10 min),ECL 显影观察并进行条带的检测和分析,以目的蛋白条带与内参条带灰度值比值作为目的蛋白表达量。
2.6 统计学方法 采用SPSS 22.0 软件进行统计分析。计量资料符合正态分布以(±s)表示,多组间采用单因素方差分析,两两比较采用LSD-t检验;重复测量资料采用单因素重复测量方差分析。P<0.05 表示差异有统计学意义。
3 结 果
3.1 5组Huh-7细胞活力比较 125、250、500 μg/mL QFQ 醇提物分别干预Huh-7 细胞24、48 和72 h 之后,Huh-7细胞活力被明显抑制(P<0.01)。见图1。
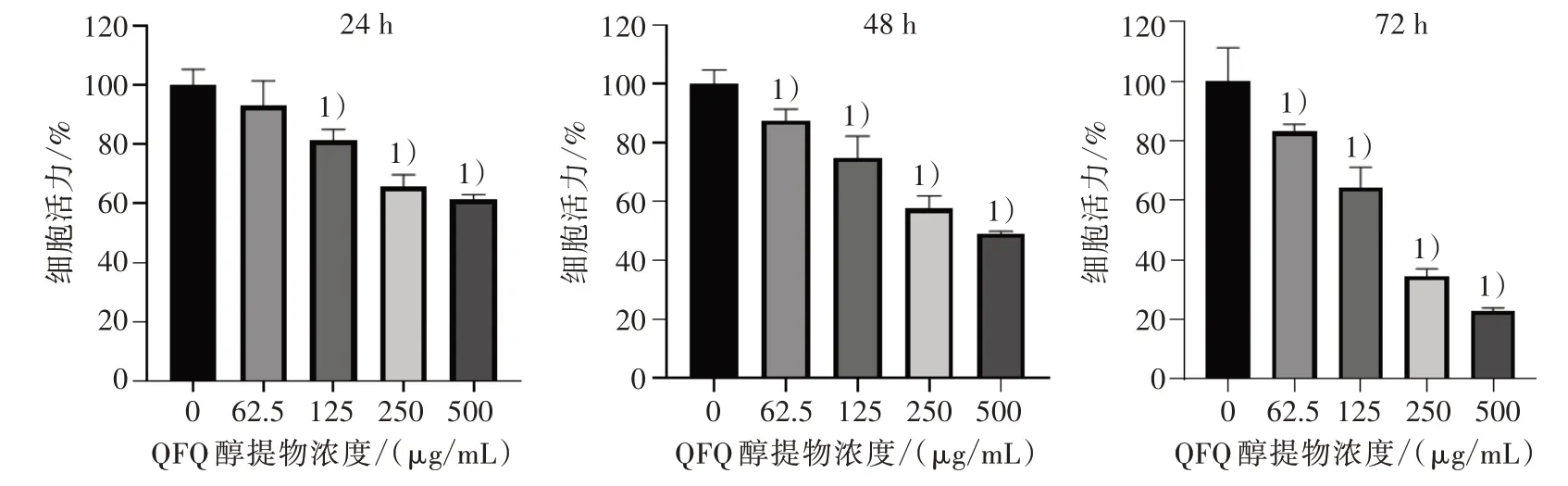
图1 5 组Huh-7 细胞活力比较
3.2 4 组Huh-7 细胞ATP 产生速率比值比较 与0 μg/mL 组比较,62.5、125、250 μg/mL 组Huh-7 细胞线粒体和糖酵解ATP 产生速率比值明显提高(P<0.05)。见图2。

图2 4 组Huh-7 细胞ATP 产生速率比值比较
3.3 4 组Huh-7 细胞实时耗氧率比较 与0 μg/mL组比较,随着检测时间延长,62.5 μg/mL 组Huh-7细胞实时耗氧率呈升高趋势(P<0.05)。见图3。
3.4 4 组Huh-7 细胞胞外酸化率比较 与0 μg/mL组比较,随着检测时间延长,250 μg/mL 组Huh-7细胞胞外酸化率呈降低趋势(P<0.05)。见图4。

图4 4 组Huh-7 细胞胞外酸化率比较
3.5 4 组Huh-7 细胞糖酵解速率比较 与0 μg/mL组比较,125、250 μg/mL 组Huh-7 细胞糖酵解速率明显降低(P<0.05 或P<0.01)。见图5。
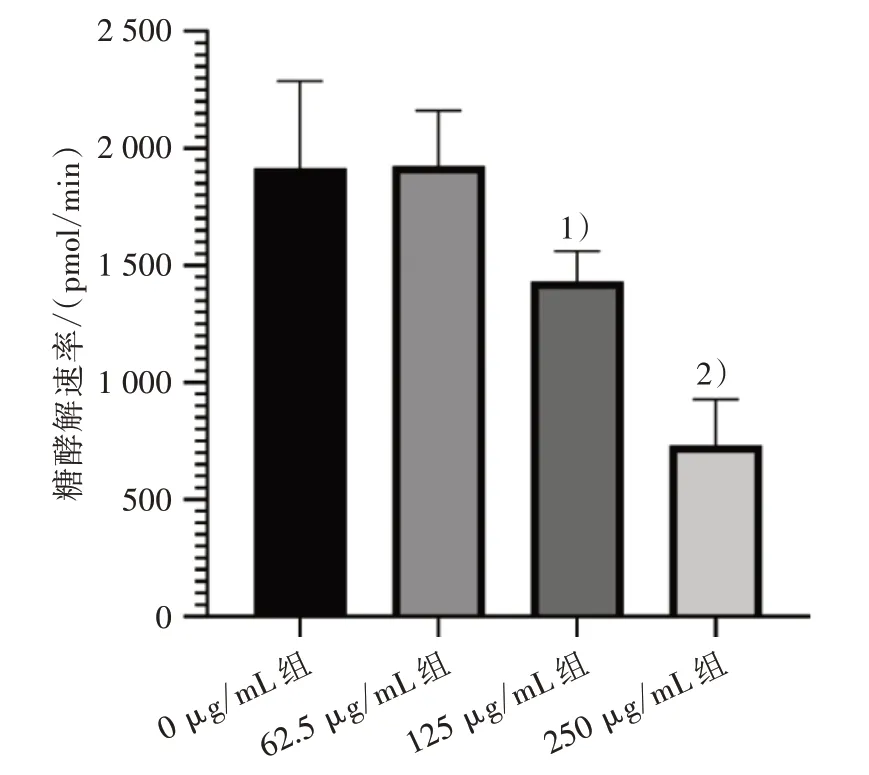
图5 4 组Huh-7 细胞糖酵解速率比较
3.6 4组Huh-7细胞质子流出速率比较 与0 μg/mL组比较,随着检测时间变化,250 μg/mL 组的质子流出速率呈降低趋势(P<0.05)。见图6。

图6 4 组Huh-7 细胞质子流出速率比较
3.7 5 组Huh-7 细胞Glut1、Glut3、HK 和HIF-1α 蛋白表达量比较 与0 μg/mL 组比较,62.5、125、250、500 μg/mL 组Huh-7 细 胞 的HIF-1α、HK、Glut1、Glut3 蛋白表达量均明显降低(P<0.01 或P<0.05)。见图7、图8。
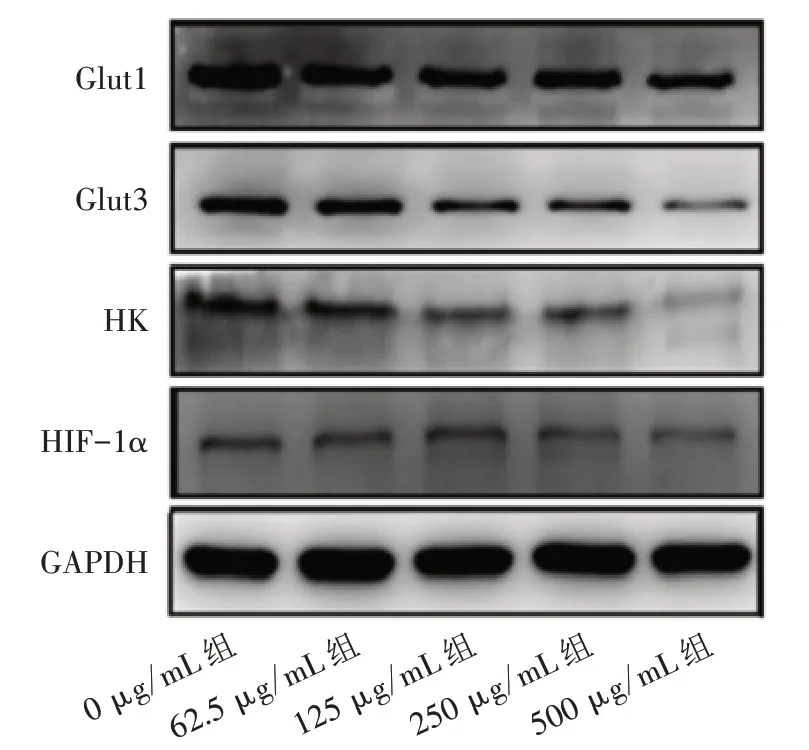
图7 5组Huh-7细胞Glut1、Glut3、HK和HIF-1α蛋白条带图

图8 5 组Huh-7 细胞Glut1、Glut3、HK和HIF-1α 蛋白表达量比较
4 讨 论
中医学认为肝癌的病因可分为内因、外因,内因主要为正气不足,外因则是邪毒(多为疫疠之毒、酒毒、药毒、食毒等)内侵,病机主要责之于气阴两虚、热毒内盛[4]。QFQ 中黄芪、女贞子为君药,益气养阴;灵芝、山药为臣药,扶正培本;白花蛇舌草、夏枯草合为佐使,清热解毒、消痈散结。诸药共奏清热解毒、益气养阴之功,标本兼顾,攻补兼施。前期研究显示,QFQ 可通过线粒体凋亡通路抑制肿瘤细胞增殖,诱导细胞凋亡,增强细胞免疫功能[2],对辅助抗癌具有深远的价值。
低氧是肿瘤组织环境中一个主要特征,低氧调节着肿瘤的发生与发展[5]。肿瘤细胞为了抵抗低氧,代谢途径由氧化磷酸化转变成无氧糖酵解途径,导致线粒体ATP 产生速率降低,糖酵解ATP 产生速率提高,符合肿瘤细胞供能特性[6]。通过无氧糖酵解的能量代谢形式,肿瘤细胞可以增强对缺血、缺氧的耐受性,促进肿瘤细胞的增殖、浸润、转移。如今,抗肿瘤中的糖酵解途径成为抗癌研究的关注点之一[7]。本研究结果显示,QFQ 醇提物可以提高肝癌细胞的实时耗氧率,降低肝癌细胞胞外酸化率和质子流出速率,抑制肝癌细胞糖酵解能力,促进肝癌细胞有氧呼吸,细胞供能方式由无氧糖酵解逐渐转变成氧化磷酸化,从而抑制肝癌细胞生长。
通过Warburg 效应可知,大多数肿瘤细胞即便处于氧气充足的环境,也会选择产能效率相对低的糖酵解途径,以此完成自身供能[8]。首先葡萄糖从血浆转送至肿瘤细胞胞质主要通过肿瘤细胞膜上高表达的跨膜蛋白Glut1 和Glut3 来完成[9];待葡萄糖进入细胞后,经HK 等相关酶转化成丙酮酸,因此HK 也被认为是最重要的糖酵解效应因子之一,它是糖代谢过程中第1 个限速步骤[3];而后,丙酮酸进入线粒体通过三羧酸循环产生乙酰辅酶A,同时释放相对多的ATP[10]。此时HIF-1α 能抑制三羧酸循环,同时促进糖酵解途径,由此提高肿瘤细胞对缺氧环境的耐受性[7]。因此,HIF-1α 是糖酵解途径中的重要调节因子,可同时调控Gluts 的表达和HK 的活性。可见,Glut1、Glut3、HK、HIF-1α 都是糖酵解途径的重要蛋白[11]。本研究结果显示,各浓度QFQ 醇提物均能明显下调Huh-7 细胞Glut1、Glut3、HK 和HIF-1α 蛋白表达,提示QFQ 可通过抑制糖酵解途径相关蛋白来抑制肝癌细胞的糖酵解能力。
综上所述,QFQ 能够调控Huh-7 细胞能量代谢和糖酵解途径相关蛋白,抑制细胞糖酵解能力,促进细胞的有氧呼吸,从而达到抑制Huh-7 细胞生长的目的。

