比较初乳乳房拭子与仔猪睾丸处理液对6种猪繁殖障碍相关病毒的监测效果
祁松,张哲玮,朱晶,罗宇山,董德文,贝为成,3,4*
(1. 华中农业大学动物医学院,农业微生物学国家重点实验室,湖北 武汉 430070;2. 广西翔仪生物工程有限公司,广西 南宁 530000;3. 湖北洪山实验室,湖北 武汉 430070;4. 生猪健康养殖协同创新中心,湖北 武汉 430070)
猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV-2)、猪细小病毒(PPV)和猪圆环病毒3型(PCV-3)是猪场常见与猪繁殖障碍有关的6种病毒,常导致感染母猪流产,高返情率,产死胎、木乃伊胎、弱仔和引起哺乳仔猪及保育猪发病和死亡,给猪场带来巨大的经济损失[1]。因此,有效监测猪群中相关病原的感染状况对疫病的防控意义重大。当前,猪场一线兽医对疫病监测所采集的样品主要以血清、扁桃体拭子、口腔液、环境样品和仔猪睾丸处理液为主。扁桃体是非洲猪瘟(ASFV)、PRRSV、CSFV、PRV及胸膜肺炎放线杆菌等病原复制和定居的重要场所,利用扁桃体拭子可准确地诊断猪群感染疫病病原[2]。而所谓口腔液,是指口腔中的唾液和血清渗出液的混合液体,其中血清渗出液是通过口腔黏膜以及口腔黏膜上的齿龈沟和毛细血管进入口腔,其既可用于抗体检测也可用于PCR检测抗原,是多种传染病高效监测技术手段的样品来源[3]。近年来,仔猪睾丸处理液成为规模猪场监控PRRSV高效且更为便利的样品来源,其敏感度要高于血清[4],但关于睾丸处理液对猪其他繁殖障碍相关病毒,如PCV-3、PPV等的检测报道较少。Dvorak等[5]报道了PCV-2在母猪口腔液、初乳和仔猪血清三者之间的病毒载量差异,初乳的检测敏感度要高于仔猪血清,提示初乳也可作为高效的样品来源,且能反映病原经乳汁垂直传播的情况。Voicu 等[6]也报道了PRRSV能通过母猪初乳和常乳进行传播,进而作为地方流行的一种传播途径。其次,初乳拭子样品不仅能为猪场兽医提供预警信息,而且能为其针对疫病防控来优化生产管理方案提供一定的参考信息,如当在初乳拭子中检测到某种病原时,猪场管理者可以通过减少弱仔寄养、加强生物安全和免疫保健等措施来降低病原的水平传播程度以及后续危害等。
为了评估母猪初乳乳房拭子对猪多种繁殖障碍性病毒的检测敏感性,同时比较其和睾丸处理液对不同的病毒检出率差异,本文以河南某规模猪场猪为研究对象,使用实时荧光定量PCR(qPCR)的方法,对随机不分胎次采集的113份(452头母猪的4混1样)母猪初乳乳房拭子和171份(684窝仔猪的4混1样)仔猪睾丸处理液进行PRRSV、CSFV、PRV、PPV、PCV2和PCV3的病原学检测,另外再单独采集38头1胎母猪的初乳乳房拭子及其所产3~5日龄仔猪的睾丸处理液进行病原学检测,旨在为规模猪场对疫病监测采集合适的样品提供一定的理论参考。
1 材料与方法
1.1 样品来源
河南某5 000头规模母猪场,年窝均出生总仔为15.3头,其中1胎母猪的年平均死胎率为10.6%,2胎及以上母猪的年平均死胎率为3.2%~5.3%,1胎母猪的年平均死胎率要显著高于其他胎次。其他生产情况均较为正常,近2年来未出现重大生产问题。样品采集于2022年8月至9月死胎率较高的阶段。
1.2 主要试剂
PRRSV/CSFV/PRV/PCV-2四重荧光定量PCR试剂盒,购自湖南国策生物技术有限公司,生产批号:382021006。PCV-3荧光定量PCR试剂盒,生产批号20220425;PPV荧光定量PCR试剂盒,生产批号:20220327;DNA/RNA总核酸提取试剂盒,生产批号:2022060201A,以上购自百狮园动物保健科技有限公司。
1.3 样品采集
1.3.1 初乳乳房拭子
根据猪场的生产操作流程要求,母猪分娩前,使用1∶400的卫可溶液,对母猪乳房进行擦拭消毒。乳房拭子的采集于母猪分娩结束时,使用一次性灭菌棉签,对母猪的乳房、乳头进行擦拭,并通过使用棉签按压母猪乳头,尽可能沾取到初乳乳汁,以4窝母猪初乳乳房拭子为1个混样组,然后装入到灭菌离心管中。标号做好记录,放入带冰块的泡沫箱中,低温配送至实验室。在采集的每一份乳房拭子中加入3 mL PBS,涡旋震荡30 s后,使用冷冻离心机于4 ℃条件下,6 000 r/min离心1 min,然后取上清液(注意避免收集到最上层的脂质层)分装到2 mL灭菌离心管中,置于-20 ℃冰箱保存备用,或当天检测。
1.3.2 睾丸处理液
根据猪场的生产操作流程,对3~5日龄的哺乳仔猪进行阉割。操作人员每阉割完1窝仔猪需要换刀片和手套,防止样品间的交叉污染。将睾丸收纳桶内套入灭菌处理过的一次性塑料袋,然后再使用一次性灭菌纱布套在塑料袋内,并用橡胶圈在桶口处勒紧,收集的睾丸组织放入纱布中,让液体通过过滤纱布流入塑料袋内。以4窝仔猪睾丸为1个混样组,收集完毕后可以稍微挤压纱布,让处理液充分过滤到塑料袋内。最后将塑料袋中的处理液转移到灭菌离心管中,标号做好记录,放入带冰块的泡沫箱中,配送至实验室于-20 ℃冰箱保存或直接检测。
1.4 DNA/RNA总核酸提取
分别取前期预处理好的乳房拭子样品和睾丸处理液样品各200 μL,各加入20 μL蛋白酶K混匀静置60 s后,再加入到全自动DNA/RNA总核酸提取试剂盒指定的样品孔中,放入全自动核酸提取仪器中,按照试剂盒说明书所示的步骤设置核酸提取程序,进行DNA/RNA总核酸提取,提取好的核酸置于-20 ℃冰箱,用作后续的qPCR检测。
1.5 病原检测
1.5.1 PRRSV/CSFV/PRV/PCV-2四重荧光定量PCR检测
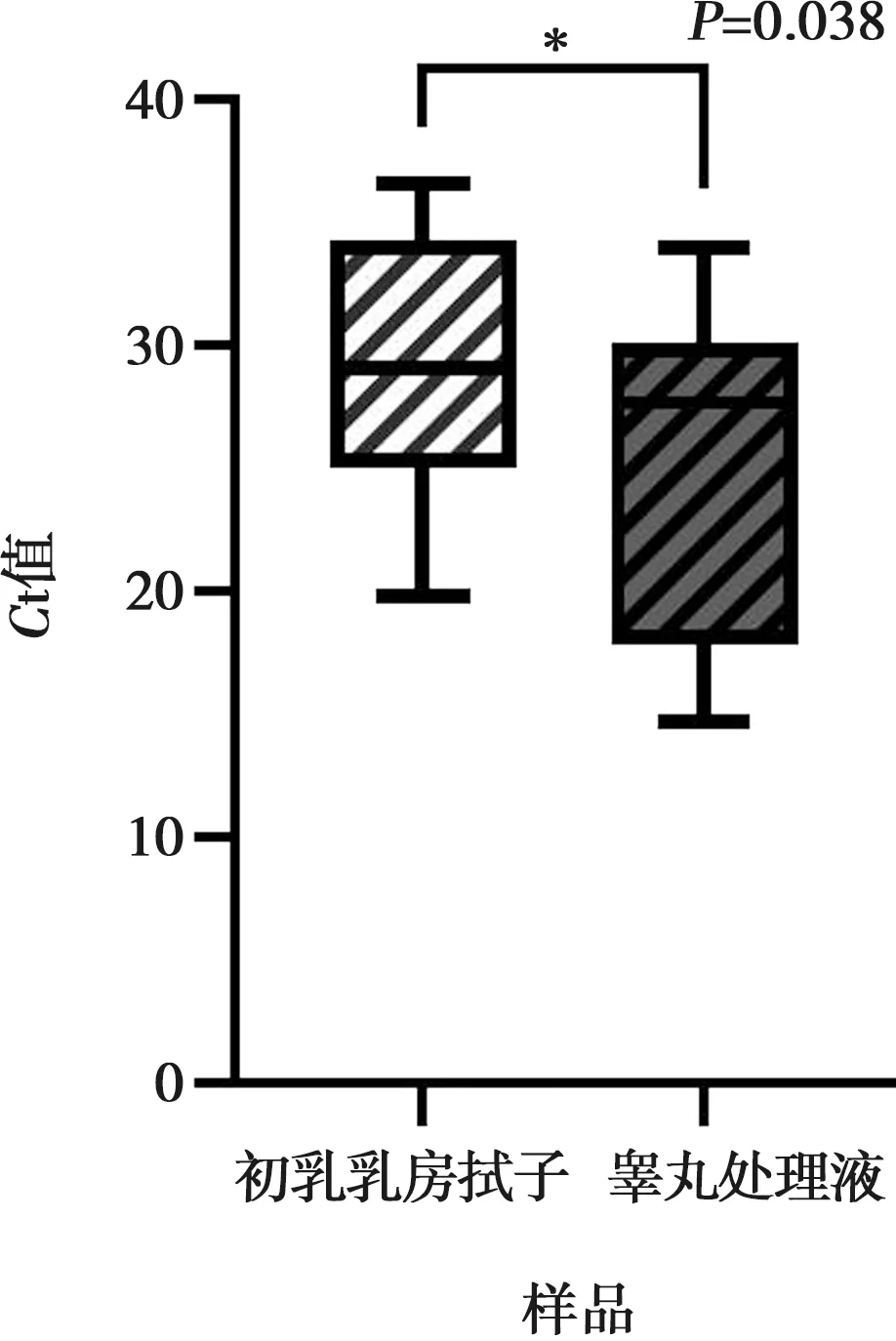
按照试剂盒说明书配置反应体系:PCR反应液43 μL,酶混合液2 μL,样品核酸模板5 μL,合计50 μL进行qPCR扩增。选择FAM通道检测PRRSV核酸,HEX通道检测PRV核酸,ROX通道检测CSFV核酸,CY5通道检测PCV-2核酸。反应程序:50 ℃ 30 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,共40个循环。结果判定标准:Ct值>40为阴性,Ct值≤35为阳性,35 1.5.2 PCV-3荧光定量PCR检测 分别按照试剂盒的说明书配置反应体系:PCR反应液19 μL,酶混合液1 μL,样品核酸模板5 μL,合计25 μL进行qPCR扩增。选择FAM通道检测PCV-3基因,选择HEX通道为内参基因。反应程序:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 30 s,共40个循环。结果判定标准:Ct值>40为阴性,Ct值≤37为阳性,37 1.5.3 PPV荧光定量PCR检测 按照试剂盒的说明书配置反应体系:PCR反应液19 μL,酶混合液1 μL,样品核酸模板5 μL,合计25 μL进行qPCR扩增。选择FAM通道检测PPV基因,选择HEX通道为内参基因。反应程序:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 30 s,共40个循环。结果判定标准:Ct值>40为阴性,Ct值≤37为阳性,37 对本次初乳乳房拭子与仔猪睾丸处理液中6种猪繁殖障碍相关病毒的抗原检出率,使用卡方检验进行显著性分析。对qPCR检测初乳乳房拭子和睾丸处理液阳性样本的Ct值,用IBM SPSS Statistics 21.0软件独立样本t检验进行差异分析。P<0.05判为显著差异,P<0.01判为差异极显著。 使用四重qPCR对113份混合初乳乳房拭子和171份混合睾丸处理液样本进行检测,结果显示:PRRSV、CSFV、PRV和PCV-2在113份混合初乳乳房拭子和171份混合睾丸处理液样本中的检出率为0,与该场的历史检测监测记录相吻合。PCV-3在113份混合初乳乳房拭子的检出阳性数为30份,阳性率为26.55%;在171份混合睾丸处理液样品检出的阳性数为10份,阳性率为5.85%。PPV在113份混合初乳乳房拭子的检出阳性数为5份,阳性率为4.42%;在171份混合睾丸处理液样品检出的阳性数为2份,阳性率为1.17%。初乳乳房拭子对PCV-3和PPV分别在检出率分别比睾丸处理液高20.70个百分点(P<0.01)和3.26个百分点(P<0.05),说明初乳乳房拭子对PCV-3和PPV检出率要显著高于睾丸处理液,详见表1。 表1 6种猪繁殖障碍性相关病毒在随机采样的初乳乳房拭子和睾丸处理液中的检测结果 qPCR检测结果显示:PRRSV、CSFV和PRV在38头母猪的初乳乳房拭子和对应仔猪睾丸处理液中检出率均为0;PCV-2在初乳乳房拭子中的检出率为2.63%(1/38),在仔猪睾丸处理液中未检出。PCV-3在初乳乳房拭子和对应仔猪睾丸处理液的检出率分别为55.26%(21/38)和44.74%(17/38),即PCV-3在初乳乳房拭子中的检出率比仔猪睾丸处理液高10.52个百分点(P<0.01)。其中在21头初乳乳房拭子为PCV3阳性母猪中,有16头对应的仔猪睾丸处理液也为阳性,其余5头对应的仔猪睾丸处理液样品检测为阴性,皮尔逊相关性检验结果为相关性显著(r=0.618,P<0.01);有1份PCV-3阳性仔猪睾丸处理液样品未在其对应的初乳乳房拭子样品中检测到PCV-3,占比2.63%(1/38)。PPV在38份初乳乳房拭子样品中检出1份,阳性率为2.63%(1/38),在仔猪睾丸处理液样品中未检出。PCV-2+PCV-3和PPV+PCV-3混合感染在初乳乳房拭子样品中的检出率均为2.63%(1/38),在睾丸处理液样品中均未检测到任何形式的混合感染。详见表2和图1。 注:*表示P<0.05,**表示P<0.01。下同。 表2 38头1胎母猪初乳乳房拭子及睾丸处理液样品检测数据(Ct值)比较 PCV-3的qPCR检测结果显示(图2),睾丸处理液阳性样品的平均Ct值为25.36,初乳乳房拭子阳性样品的平均Ct值为29.54,即睾丸处理液样品的平均Ct值要显著低于初乳乳房拭子样品(P<0.05)。 图2 PCV-3 阳性样本qPCR的Ct值 ASFV、PRRSV、PRV、CSFV、PCV-2、PCV-3和PPV等是引起猪繁殖障碍性疾病的重要病原,给养猪业带来巨大的经济损失[7-9]。ASFV在中国暴发后,不少规模猪场自建检测实验室[10],使得这些猪场重点关注疾病的检测监测变得更加便捷。然而随着猪繁殖障碍性疾病在临床上的感染类型逐渐变得复杂多样化,除急性和慢性发病外,隐性感染、亚临床感染和间歇性排毒呈逐步上升趋势,使得临床监测的敏感性和准确性受到巨大的挑战。如Batista 等[11]报道了PRRSV血清样本抗原抗体检测均为阴性的猪,仍然能在其内脏器官和组织检测到病原。 当前,对猪群重点防控疫病监测的主要样品类型是血清、扁桃体拭子、脐带血、口腔液和环境样。对于血清样本,在低感染率下对大多数疾病的检测敏感性低[12],且血清的采集需要多人配合绑定猪只,样品采集效率低。同样,扁桃体拭子的采集也需要多人配合,且使用专用工具对猪进行绑定,才能高效准确地采集到扁桃体拭子样品[2],高人力成本导致其很难规模化用于疫病的长期监测。脐带血样本近年来也在猪场广泛应用于多种垂直传播疾病的监测[13-14],但多种垂直传播性病原,如PRRSV,经垂直传播感染胎儿是随机的[15],导致即使存在垂直传播,也并非在所有仔猪脐带血都能检测到病毒,所以临床上需要尽可能采集到窝内所有仔猪的脐带血才可提高结果可信度,由于母猪的产程分布较长,特别是晚上在无人接产的情况下,并不能采集到窝内所有初生仔猪的脐带血。口腔液样品在临床上用于病原的抗原诊断和监测时,对大栏群体饲养的猪群采样效果较好,但也会出现猪不来咀嚼咬绳的情况,导致检测结果的敏感性受到限制[16];其次对于限位栏饲养的母猪,特别是产房母猪,猪不咀嚼咬绳的概率较高,因此在某些临床情景下,采集口腔液的效率和便利性甚至不如扁桃体拭子。而对于环境样品,样品中杂质,如饲料残渣、粪尿、强酸强碱等环境消毒剂残留,均会影响核酸提取的效果和抑制PCR反应,导致检出率大大下降[17]。综上所述,以上样品并不适合作为长期疫病监测的高敏和高效样品来源。 猪场兽医和管理者一直在不断摸索更为敏感、便捷的样品采集方法。近年来出现一种新的样品采集方法,即睾丸处理液。睾丸液是在仔猪阉割或断尾时采集的组织渗出液的混合样品,又被称为“处理液”,可作为PRRSV的高敏感样品[18],且其采样便捷能满足猪场一线工作者的需求,但目前关于睾丸处理液对PCV-3、PPV等病毒的检测报道较少。另外对于母猪初乳乳房拭子,有研究显示在没有PCV-3病毒血症的分娩母猪中,也能在初乳中检测到高病毒载量的PCV-3[19];Ha等[20]同样报道了初乳和乳汁中的PCV-2和PPV具备传染性。初乳具备这一特点的原因是在初乳期,母猪乳腺腺泡周围的上皮细胞之间连接不再紧密,引起渗出物从血浆渗出至乳汁,且在此阶段大量淋巴细胞归巢至乳腺,使母猪初乳中含有高含量的白细胞[21]。这些白细胞通过“木马机制”进行相关病原的垂直传播,以ASFV为例,靶细胞表明因具有抗体(IgG)的Fc受体而具有调理吞噬作用,从而给藏匿于病毒-抗体复合物中的病毒以可乘之机,进入靶细胞,登革热病毒也有类似的病毒传播机制[22-23],提示初乳样品具备对某些病原的高效监测能力,且母猪初乳乳房拭子的采集方便性极高,能大大减少工作人员的工作量。 本研究结果显示,在对随机不分胎次采集的113份混合初乳乳房拭子和171份混合仔猪睾丸处理液样本的6种垂直传播性疾病的病原检测中,初乳乳房拭子样本中PCV-3和PPV的检出率比仔猪睾丸处理液样本分别显著高出20.7个百分点和3.25个百分点。由于本次试验所研究的猪场1胎母猪的年平均死胎率显著高于其他胎次,结合猪场实际生产情况,遂额外再单独采集38份1胎母猪初乳乳房拭子样本和对应的仔猪睾丸处理液样本进行6种垂直传播性疾病的病原检测分析。结果显示,初乳乳房拭子样本中PCV-2、PCV-3和PPV的检出率分别比仔猪睾丸处理液样本分别高出2.63个百分点、10.52个百分点和2.63个百分点。有1份仔猪睾丸处理液样品检出PCV-3,但未在其对应的初乳乳房拭子中检测到PCV-3,占比2.63%,可能是仔猪出生后的自然感染导致,后续可通过ELISA等方法来进一步研究。其次,基于这一差异,提示猪场兽医可以通过比较初乳乳房拭子和睾丸处理液样本中的检测差异,来评估病毒垂直传播和水平传播的程度和差异。PCV-2+PCV-3和PPV+PCV-3的双重感染在初乳乳房拭子样本中的检出率均为2.63%,但在仔猪睾丸处理液中未见任何形式的混合感染。以上数据显示,初乳乳房拭子样本比仔猪睾丸处理液样本对PCV-2、PCV-3和PPV具备更高的检测敏感性。在qPCR检测PCV-3阳性的21份初乳乳房拭子中和17份睾丸处理液中,仔猪睾丸处理液样品的平均Ct值要显著低于初乳乳房拭子,其可能的原因是病毒经母猪初乳传播给仔猪,并在仔猪体内进行复制和增殖,即导致仔猪血液和睾丸处理液中呈现更高的病毒载量。 单独检测的38头1胎母猪的初乳乳房拭子和对应仔猪睾丸处理液样本中PCV-3检出率均要远高于各胎次母猪的随机混合样品,Kedkovid等[19]也报道了PCV-3在1胎母猪初乳中检出率要显著高于其他胎次。有文献报道[24-25],PCV-3在死胎有较高的检出率,而本场1胎母猪的死胎率显著高于其他胎次母猪,是否与PCV-3的感染有直接关系值得更进一步研究。 PRRSV、CSFV和PRV在本次研究中在初乳乳房拭子和睾丸处理液中的检出率均为0,结合本场的历史检测监测记录及猪群的临床表现,较为吻合。本次研究并未能比较出初乳乳房拭子和仔猪睾丸处理液对PRRSV、CSFV和PRV的检测敏感性,其次所采集的113份初乳乳房拭子混合样品与171份仔猪睾丸液混合样品并不对应匹配,即在临床对多种猪繁殖障碍相关病毒的监测中,初乳乳房拭子是否能完全取代睾丸处理液,后续需要通过对不同胎次母猪的初乳乳房拭子和对应的仔猪睾丸处理液进行更进一步研究。 以上结果表明,母猪初乳乳房拭子样品对PCV-2、PCV-3和PPV具备较高的监测能力,且检出率要高仔猪睾丸处理液样本,但两者对PRRSV、CSFV和PRV的检测敏感性差异未能比较。临床上,母猪初乳乳房拭子的预警时间要早于仔猪睾丸处理液,通过初乳乳房拭子监测到相关疫病后,可以通过减少仔猪的寄养来降低病毒的水平传播程度;其次,也能提示猪场兽医及时采取生物安全和免疫保健方案来降低病原的危害,对猪场疫病防控起到极大的预警作用。综上,母猪初乳乳房拭子样品作为PCV-2、PCV-3和PPV的监测样本,具备高检测敏感性、采样便利性和风险预警性,能准确地反映产房内母猪和仔猪病原流行情况及风险,以便猪场制定和采取更为准确的免疫保健和生物安全等综合防控措施。1.6 数据统计与分析
2 结果
2.1 对随机采样的初乳乳房拭子和睾丸处理液的检测

2.2 对38头1胎母猪的初乳乳房拭子和对应仔猪睾丸处理液的检测


3 讨论

