二重荧光RT-LAMP鉴别检测禽呼肠孤病毒和鸡滑液囊支原体
曾婷婷,谢芝勋,谢丽基,王盛,谢志勤,黄娇玲,万丽军,任红玉,张艳芳,张民秀,范晴,邓显文
(广西壮族自治区兽医研究所,广西 南宁 530001)
禽呼肠孤病毒(avian orthoreovirus,ARV)和鸡滑液囊支原体(Mycoplasmasynoviae,MS)是导致鸡关节炎、滑液囊炎和腱鞘炎等腿病的2种主要病原体[1-2]。鸡群感染这2种病原体可引发鸡跛行、免疫抑制、生长迟缓、胴体降级等,给养禽业带来经济损失。李彬等[3]2020—2021年在我国6个省份采集了253份有关节炎病鸡关节样品,采用RT-PCR方法检出ARV阳性157份,总阳性率为62.1%。王晨燕等[4]用qPCR方法检测2018—2020年福建省非免疫鸡群中的MS,非免疫肉鸡群病原总阳性率为49.62%。随朝鸽[5]2019—2021年从安徽、河南、湖北三省的237份样品中,分离鉴定出了96株MS,总阳性率为40.5%左右。近年来对ARV和MS这2种病原的流行病学调查表明,在鸡群尤其是肉鸡群中,存在较严重的流行分布。由于这2种病原引起的症状和剖检病变极其相似,凭肉眼观察病变难以区分,混合感染也常在临床可见[6-7],但未见有大规模地对于混合感染的调查报道。另外,由于MS病原分离难度较大,一般实验室难以实行。
应用分子生物学手段进行早期鉴别诊断成为防控ARV和MS这2种病原的有效手段,包括常规的PCR[8-9]、荧光定量PCR[10]、环介导等温扩增(LAMP)[11]检测方法等。这些方法均能特异、快速检测特定病原体,但相对于PCR和荧光定量PCR需要特定的仪器,对实验室的设备配置和操作人员技术需求较高,LAMP检测方法由于扩增过程仅需要水浴锅就可以实现,操作更为简便,更适用于基层实验室或养殖单位进行早期筛查诊断。
为了建立一套可适用于基层实验室或养殖单位的快速鉴别诊断ARV和MS的检测方法,本研究在LAMP反应体系中,加入1条荧光探针FD[12],通过标记不同荧光基团,反应后在成像仪下可观察到不同荧光,以此达到鉴别检测ARV和MS的目的,为不同条件的实验室提供新的病原检测思路。
1 材料与方法
1.1 病原毒株
本研究使用的病原均为本实验室保存,包括ARV的疫苗株和临床分离株,新城疫病毒(NDV)、传染性支气管炎病毒(IBV)、马立克氏病病毒(MDV)为疫苗株,其余毒株均为临床分离株(表1)。
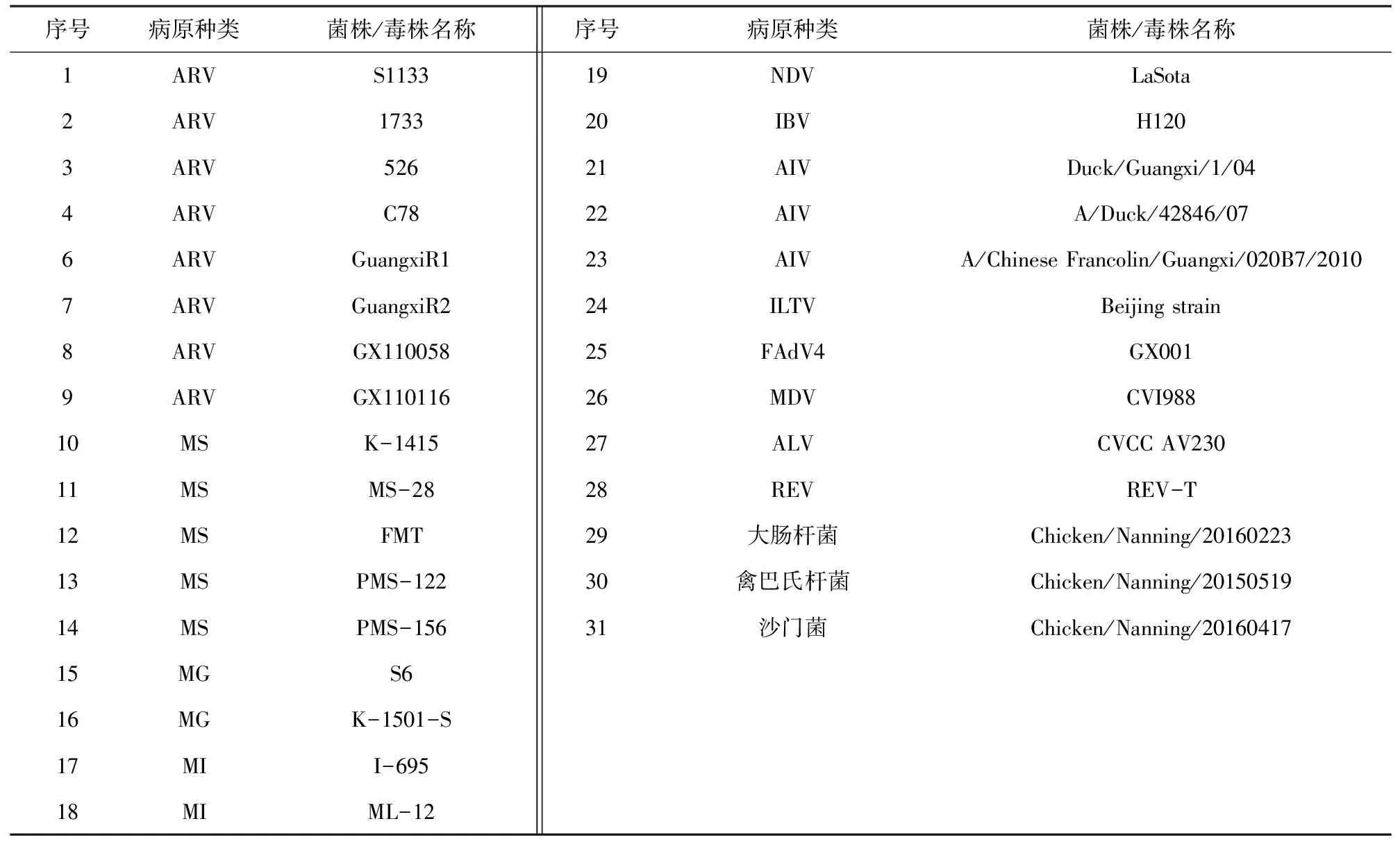
表1 毒株信息
1.2 主要试剂和仪器
核酸抽提试剂盒EasyPure®Viral DNA/ RNA Kit,一步法RT-PCR试剂盒TransScript®One-Step RT-PCR SuperMix,胶回收试剂盒EasyPure®Quick Gel Extraction Kit,载体pEASY®-Blunt Cloning Kit和感受态细胞DH5α,购自北京全式金生物技术有限公司;RT-LAMP试剂盒WarmStart®2.0 LAMP Kit (DNA &RNA),购自美国New England Biolabs(NEB)公司;体外转录试剂盒RiboMAX Large Scale RNA Production Systems SP6/T7 Kit,购自美国 Promega公司;LA-320c环介导等温扩增实时浊度仪,购自北京蓝谱生物科技有限公司;超微量分光光度计NanoDrop 2000,购自美国Thermo Fisher Scientific公司;多通道荧光成像仪ChemiDoc XRS+,购自美国Bio-Rad公司。
1.3 引物设计
根据文献[13-14]中保守和特异的基因片段MS:VY93_RS02300和ARV:M1,使用MEGA X软件比对这些片段不同年份地域分离株的序列,使用LAMP在线引物设计网站http://primerexplorer.jp/lampv5e/index.html 设计2套LAMP引物(表2)。每套引物分别设计1条探针FD,与引物F1c反向互补,在FD 3′端标记荧光基团,在F1c 5′端标记淬灭基团,反应前FD与F1c反向互补,荧光被淬灭,在反应中不断地通过链置换反应,FD被置换出来,发出荧光。

表2 引物序列
1.4 加入荧光探针FD的RT-LAMP反应条件摸索
将LAMP引物稀释再合并为引物组合,将200 μmol/L FIP 50 μL和200 μmol/L FD 50 μL混合,加热到98 ℃再缓慢冷却到室温。引物组合的配制浓度见表3。单重RT-LAMP反应体系为25 μL:2×RT-LAMP mix 12.5 μL,引物组合1 μL,模板2 μL,ddH2O补足至25 μL。反应于浊度仪中68 ℃反应80 min,85 ℃ 5 min结束反应。反应结束后,于成像仪相应的荧光通道观察荧光,并合并2种荧光图像。

表3 引物配制比例
设置含有不同FD探针比例的单重ARV RT-LAMP反应组合,摸索FD的最佳浓度:1)不含FD;2)引物组合ARV-A∶ARV-B或ARV-A∶ARV-C为9∶1,即FD相对于FIP,含量为10%,依次类推设置FD含量为0~100%共11个浓度梯度反应体系,每个梯度FD含量升高10%。设置含有不同FD探针比例的单重MS LAMP反应组合,摸索FD的最佳浓度,分组同ARV。
1.5 二重RT-LAMP反应温度梯度摸索
将ARV和MS含FD最佳浓度的2组引物1∶1混合,进行二重RT-LAMP反应的温度梯度摸索。RT-LAMP反应体系为25 μL:2×RT-LAMP mix 12.5 μL,引物组合1 μL,模板1 μL,ddH2O补足至25 μL。根据试剂盒说明,BST酶的作用温度范围为60~70 ℃,因此在体系中加入MS或ARV单一模板,从60 ℃开始每升高1 ℃进行3个重复试验,摸索二重体系的最佳反应温度。
1.6 二重RT-LAMP的特异性试验
分别使用表1的毒株保存于-80 ℃的培养物抽提核酸,作为模板在反应体系中加入1 μL,进行二重RT-LAMP反应,验证该反应体系的特异性。
1.7 二重RT-LAMP的敏感性试验
为构建敏感性试验所需质粒标准品,分别使用ARV和MS 的外引物F3和B3作为PCR引物进行RT-PCR,回收PCR产物,连接pMD18T载体后转化感受态细胞。挑取并增殖阳性克隆后抽提质粒,制备成质粒标准品。ARV质粒标准品经过体外转录为ssRNA,测量标准品的核酸浓度备用。将上述标准品10倍梯度稀释,进行二重RT-LAMP单重模板和双重模板反应,测试该反应体系的敏感性。单重模板敏感性试验时,加入单重模板1 μL,双重模板敏感性试验时,2种模板各加入1 μL,其余体积用ddH2O补足。
1.8 二重RT-LAMP的干扰性试验
保持其中一种病原标准品的浓度不变,另一种病原标准品10倍梯度稀释,进行二重RT-LAMP双重模板反应,测试该反应体系在2种模板浓度不一的条件下,浓度高的模板是否干扰浓度低的模板的扩增。进行干扰性试验时,2种模板各加入1 μL,其余体积用ddH2O补足。
1.9 临床样品检测
使用实验室保存的40份广西各养殖场送检的病料,包括病鸡跗关节、跟腱、关节液、脾脏和肺脏等,抽提核酸后进行二重RT-LAMP检测,并与之前本实验室建立并推广应用的二重qRT-PCR检测结果对比检出率。前期二重qRT-PCR的检测结果已经与病原分离等经典方法比较验证其准确性[11],因此本研究仅与二重qRT-PCR比较待检样品的检出率。
2 结果
2.1 加入荧光探针FD的LAMP反应条件摸索
ARV FD-1为F1c反向互补引物,FD2为FD1 的5′端减少数个碱基后序列。使用含ARV-B的引物组合,不管ARV-B的比例多少,均在80 min反应时间内完全抑制RT-LAMP反应(图1A、C);含MS-B的引物组合也出现同样结果(图1B、D)。使用含ARV-C的引物组合,虽然也出现了抑制反应,但抑制反应大大减少,RT-LAMP反应起始时间随着ARV-C的比例提高而逐渐延长(图2A、C)。含MS-C的引物组合结果类似(图2B、D)。在成像仪下,ARV RT-LAMP阳性反应管为红色荧光,随着ARV-C的比例提高,亮度逐渐提高,ARV-C大于50%后亮度提高不明显;阴性反应管的荧光也随着ARV-C的比例提高,亮度逐渐提高,在ARV-C占 50%时阴阳性对比明显,可达到判断阴阳性目的(图2E)。MS LAMP的反应也与ARV RT-LAMP反应结果类似,为绿色荧光(图2F),因此,选用ARV-A∶ARV-C为5∶5,MS-A∶MS-C为5∶5(即ARV FD含量为ARV FIP的50%,MS FD含量为MS FIP的50%),2组引物等量混合后取1 μL引物混合物作为最佳引物浓度组合进行后续试验。
A. ARV RT-LAMP浊度仪观测阳性对照;B. MS LAMP 浊度仪观测阳性对照;C. ARV RT-LAMP 浊度仪观测阴性对照;D. MS LAMP浊度仪观测阴性对照;1. 不含FD1;2. 含20%FD1;3. 含40%FD1;4. 含50%FD1;5. 含60%FD1;6. 含80%FD1;7. 含100%FD1。
2.2 二重RT-LAMP反应的温度梯度摸索
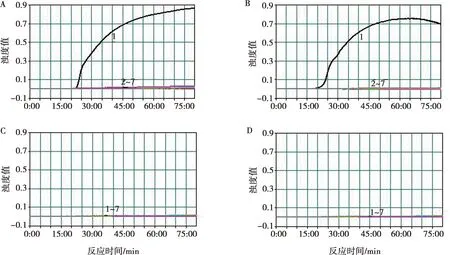
将ARV和MS含FD的最佳浓度的2组引物1∶1混合,进行二重RT-LAMP反应的温度梯度摸索。浊度仪扩增结果显示,同一模板浓度下,ARV RT-LAMP反应70 ℃时起始反应时间最短,MS LAMP反应66 ℃时起始反应时间最短,因此ARV RT-LAMP的最佳反应温度为70 ℃(图3A~G),MS LAMP的为66 ℃(图3H~N),二重RT-LAMP选择2个最佳反应温度的中间值68 ℃作为后续试验的反应温度。
2.3 二重RT-LA MP的特异性试验
使用表1中的病原体进行二重RT-LAMP反应,每个反应体系加入其他病原的核酸1 μL,仅ARV和MS毒株有扩增反应(图4A)。成像仪下ARV为红色荧光,MS为绿色荧光,同时含有2种模板时,合成2个荧光图像得到黄色荧光(图4B)。其他病原和纯水作为模板无扩增反应和荧光。
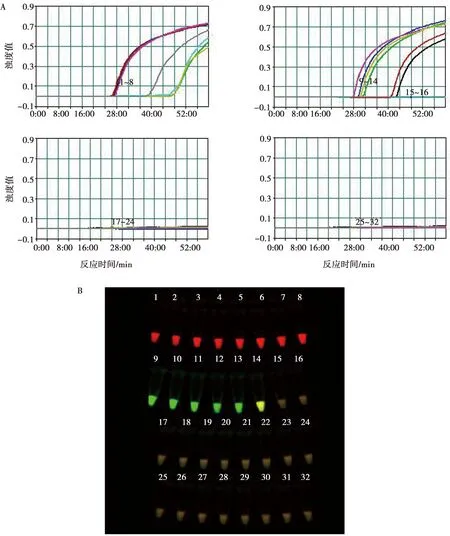
A. 浊度仪观测特异性试验结果;B. 成像仪观测特异性试验结果;1. ARV(S1133);2. ARV(1733);3. ARV(526);4. ARV(C78);5. ARV(GuangxiR1);6. ARV(GuangxiR2);7. ARV(GX110058);8. ARV(GX110116);9. MS(K-1415);10. MS(MS-28);11. MS(FMT);12. MS(PMS-122);13. MS(PMS-156);14. GuangxiR1和MS-28;15. MG(S6);16. MG(K-1501-S);17. MI(I-695);18. MI(ML-12);19. NDV(LaSota);20. IBV(H120);21.AIV(Duck/Guangxi/1/04);22. AIV(A/Duck/42846/07);23. AIV(A/Chinese Francolin/Guangxi/020B7/2010);24. ILTV(Beijing strain);25. FAdV4(GX001);26. MDV(CVI988);27. ALV(CVCC AV230);28. REV(REV-T);29. 大肠杆菌(Chicken/Nanning/20160223);30. 禽巴氏杆菌(Chicken/Nanning/20150519);31. 沙门菌(Chicken/Nanning/20160417);32. 阴性对照。
2.4 二重RT-LAMP的敏感性试验
ARV标准品经过体外转录后,RNA的浓度换算为1.7×108copies/μL,MS标准品浓度换算为1.9×108copies/μL。10倍梯度稀释后进行二重RT-LAMP反应,单重模板ARV的最低检测限是1.7×102copies,MS的最低检测限是1.9×102copies,双重模板的最低检测限与单重模板相同(图5)。

A. ARV浊度仪观测二重RT-LAMP敏感性试验,其中:1~7. 1.7×107 ~1.7×101 copies,8. 阴性对照;
2.5 二重RT-LAMP的干扰性试验
使用ARV标准品浓度为1.7×106copies/μL不变,MS标准品浓度为1.9×107~1.9×101copies/μL时,MS的最低检测限度为1.9×102copies;使用MS标准品浓度为1.9×106copies/μL不变,ARV标准品浓度为1.7×107~1.7×101copies/μL时,MS的最低检测限度为1.7×102copies,说明该二重RT-LAMP反应体系对不同浓度的模板的扩增效应良好(图6)。

1~7. ARV均为1.7×106copies,MS分别为 1.9×107~1.9×101 copies;8. 阴性对照;9~15. MS均为1.9×106 copies,ARV分别为1.7×107~1.7×101 copies;16. 阴性对照。
2.6 临床样品检测
使用本实验室保存的40份临床样品进行检测,有3份ARV阳性,2份MS阳性,未发现混合感染情况,与之前本实验室建立的二重qRT-PCR的检测结果相同(图7)。
3 讨论
LAMP检测技术自2000年被发明以来[15],大量应用于病原体的检测[16-18],一开始该检测方法需要借助浊度仪观测扩增反应或者反应后离心观察是否产生沉淀来判断是否有扩增反应,之后开发出多种可视化LAMP检测方法,如加入SYBR GREEN染料[19],加入钙黄绿素[20],后期通过加入TaqMan探针,达到多重检验的目的[21]。本研究参考Tanner等[12]的方法,引入1条探针FD,与F1c反向互补,FD的3′端标记荧光基团,F1c的5′端标记淬灭基团。配制引物时,先将FD和FIP等量混合加入到98 ℃,再缓慢降温到室温,使FD的荧光被淬灭基团淬灭。LAMP反应过程中,随着扩增反应的进行,链置换反应使FD从FIP上解离下来,发出荧光。二重RT-LAMP反应,在不同的FD上标记不同的荧光基团,即可在反应后在成像仪下观测到不同荧光。与Tanner等[12]使用荧光定量PCR仪收集荧光信号的产生不同,本实验室尝试直接在成像仪下直接观测荧光,在反应结束后直接读取结果。在不具备成像仪的实验室,市面上的手持式多通道荧光检测器也可以达到观测结果的目的。另外,添加FD探针的优势在于,由于FD是与F1c反向互补的,不需要额外设计探针,既可以达到直接观测荧光的效果,又避免了需要额外设计1条探针或分子信标,额外设计探针或分子信标在一些单核苷酸变异比较大的病原体上比较难以实现。
本研究在摸索反应条件时,发现当使用全长FD时(即F1c的反向互补序列全长),对RT-LAMP产生了极为严重的抑制反应,即使降低FD在反应体系中的比例,仍然全部抑制RT-LAMP反应。这与Tanner等[12]的报道中描述的降低FD比例可减少抑制效应不同,于是尝试通过缩短FD长度,降低FD的Tm值来寻求解决方案。结果发现,在缩短FD长度,将FD的Tm值降低到56~58 ℃时,虽然仍存在抑制效应,但抑制效应大大降低,并且时间延长程度与FD的比例正相关。说明抑制效应不仅与FD的比例相关,与FD的长度及Tm值也相关,因此在建立反应体系时应注意。反应受到抑制的原因,Tanner等[12]推测是FD与F1c的结合,减慢了FIP与模板结合并生成扩增子的速度,而恰恰内引物对整个扩增反应的效率影响最大。本研究观察到的现象,推测是由于FD与F1c的结合过于牢靠,反应温度不足以使FD与F1c解离,使得扩增效率大大降低,在有限的扩增时间内观察不到扩增反应。在缩短FD长度之后,Tm值也随之下降,使得在反应温度下扩增反应得以进行。尽管仍然存在抑制效应,但在经过一系列反应条件摸索后,选取了FD含量为50%为最佳反应体系,抑制效应在可接受范围内,扩增起始时间比不添加FD延长5~8 min左右,且在成像仪下阴阳性结果对比明显。
本研究建立的二重RT-LAMP反应体系,特异性试验显示与ARV、MS之外的常见禽类病原无交叉反应,敏感性试验显示,对ARV和MS的最低检测限均为102copies数量级,与本实验室前期建立的二重qRT-PCR检测ARV和MS的反应体系(101copies)的敏感性低1个数量级,但从临床样品的检测结果来看,可以基本满足基层实验室和养殖单位的临床鉴别检测需求。
综上所述,本研究通过引入1条与F1c引物反向互补的探针FD,建立了1套二重RT-LAMP检测方法,可特异、敏感地鉴别检测ARV和MS,为不同实验条件下的实验室或养殖单位提供新的检测手段。

