miR-138-5p通过调控自噬影响乳腺癌细胞他莫昔芬耐药性的体外研究
姚浩明, 李 英
乳腺癌是影响妇女生命健康的最常见癌症之一,在世界范围内其发病率和病死率日益升高[1]。随着医学的发展,乳腺癌治疗已取得较大进步,临床对乳腺癌通常采用手术切除、放疗、化疗及药物辅助治疗等方法[2-3]。他莫昔芬(tamoxifen,TAM)是临床治疗乳腺癌的常用化疗药物,但多数患者在化疗几周后即出现耐药,成为乳腺癌治疗的主要障碍。因此,了解乳腺癌细胞对TAM耐药的机制,探索降低机体耐药性的方法是目前治疗乳腺癌亟需解决的问题之一。微小RNA(micro ribonucleic acids,miRNAs)是动植物中广泛存在的一类非编码RNA,通过靶向mRNA降解或翻译抑制调控基因表达[4]。有研究发现,miR-138-5p对肿瘤细胞增殖、凋亡、侵袭、自噬等具有抑制作用[5]。然而,目前关于miR-138-5p对乳腺癌细胞TAM耐药性影响的研究较少。本研究旨在探讨miR-138-5p对乳腺癌细胞TAM耐药性的影响及其机制,为改善乳腺癌患者治疗预后提供参考。
1 材料与方法
1.1实验细胞和主要试剂 乳腺癌细胞株MCF-7购自上海信裕生物科技有限公司。TAM耐药MCF-7细胞株MCF-7/TAM由美国弗吉尼亚大学医学院内科岳微教授惠赠,已用1×10-7mol/L TAM维持耐药1年。Trizol购自美国Sigma公司;反转录试剂盒购自美国Fermentas公司;细胞自噬染色检测试剂盒(MDC法)购自上海源叶生物科技有限公司。miR-138-5p mimics慢病毒、miR-138-5p NC慢病毒空载体由上海吉凯基因有限公司设计并合成。聚凝胺(polybrene)慢病毒转染试剂购自上海碧云天生物科技有限公司;兔抗人Beclin-1多克隆抗体、兔抗人LC3Ⅱ多克隆抗体、兔抗人Bcl-2单克隆抗体购自美国Abcam公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG二抗购自北京中杉金桥生物技术有限公司。
1.2主要仪器 7500型实时荧光定量PCR仪(美国ABI公司);128C酶标仪(奥地利CliniBio公司);PowerPac Universal通用型电泳仪(美国Bio-Rad公司);Cytomics FC 500流式细胞仪(美国Beckman公司);DM4B荧光显微镜(德国徕卡公司)。
1.3实验方法
1.3.1 细胞培养 MCF-7和MCF-7/TAM细胞分别接种于无菌细胞培养瓶(含非必需氨基酸、10 μg/ml胰岛素、10%胎牛血清、1%青/链霉素)中,培养箱条件设置为37 ℃、5% CO2,每3 d换液,并观察细胞形态,待细胞融合率达80%~90%时,收集细胞备用。
1.3.2 分组及转染 取对数生长期MCF-7、MCF-7/TAM细胞,调整细胞密度为1×106cells/ml,以200 μl/孔接种于24孔板。设置正常对照组(MCF-7细胞)、耐药对照组(MCF-7/TAM细胞)、LV-NC组(MCF-7/TAM细胞+miR-138-5p NC慢病毒空载体)和LV-miR-138-5p mimics组(MCF-7/TAM细胞+miR-138-5p mimics慢病毒)。慢病毒感染复数=30,培养12 h后更换完全培养基,培养72 h后向细胞中加入终浓度为2 μg/ml的嘌呤霉素筛选48 h。收集细胞进行后续实验。
1.3.3 MTT法检测细胞增殖 取方法1.3.2中获取的细胞,每组均给予100 μl/孔终浓度为1×10-7mol/L的TAM进行处理,在孵育24 h、48 h、72 h后分别加入MTT溶液20 μl,孵育4 h后依次加入DMSO 150 μl,10 min后使用酶标仪检测570 nm处各孔的OD值,计算增殖抑制率。增殖抑制率=(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%。
1.3.4 实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)法检测miR-138-5p相对表达水平 采用Trizol法提取各组细胞总RNA,应用反转录试剂盒合成cDNA。应用荧光定量PCR试剂盒及PCR仪进行qRT-PCR。反应体系:10 μl SYBR® Premix Ex TaqTM(2×)、0.8 μl正向引物、0.8 μl反向引物、2 μl cDNA(200 ng/μl)和6.4 μl ddH2O。所用引物序列见表1。反应条件:95 ℃,30 s(预变性);95 ℃,5 s(变性),55 ℃,10 s(退火),72 ℃,15 s(延伸),共计40个循环。以U6为内参,通过2-△△Ct法计算miR-138-5p的相对表达量。

表1 引物序列
1.3.5 MDC染色法检测各组细胞自噬小体数量 取各组细胞用0.25%胰蛋白酶消化1 min,然后接种至6孔板(1×106cells/ml)中。24 h后,弃去培养液,用1×Wash Buffer洗涤细胞2次,加入MDC染色液(100 μl/孔)室温避光染色40 min,弃去染色液,用1×Wash Buffer洗涤细胞3次,加入封片剂以防荧光淬灭,最后在荧光显微镜下观察并记录自噬小体数量。
1.3.6 流式细胞术检测细胞凋亡情况 收集各组细胞用HEPES缓冲盐溶液(pH=7.5)洗涤2次,然后用70%冰冷乙醇在4 ℃下固定细胞30 min。将细胞重新悬浮在结合缓冲液中,向细胞中加入5 μl Annexin V-FITC染色15 min,然后在室温下避光,用5 μl PI(50 μg/ml)染色10 min,每管加入400 μl结合缓冲液。使用流式细胞仪检测细胞凋亡情况。
1.3.7 Western blot法检测细胞自噬相关蛋白的相对表达水平 收集各组细胞采用RIPA裂解液(含PMSF)提取总蛋白,采用BCA法测定蛋白浓度后,取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后将蛋白转移至聚偏二氟乙烯膜上。将膜置于5%脱脂牛奶中封闭1 h后,用相应的一抗Beclin-1(1∶500)、LC3Ⅱ(1∶500)、Bcl-2(1∶500)、β-actin(1∶1 000)4 ℃孵育过夜。次日,洗去一抗,用HRP标记的二抗(1∶2 000)再孵育1 h,然后使用ECL发光液进行显影。应用Image J软件分析条带灰度值,以β-actin为内参计算各目标蛋白的相对表达量。
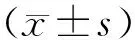
2 结果
2.1四组细胞miR-138-5p表达水平比较 耐药对照组、LV-NC组miR-138-5p表达水平低于正常对照组,LV-miR-138-5p mimics组miR-138-5p表达水平高于正常对照组,差异有统计学意义(P<0.05)。见图1。

注:F=37.753,P<0.001;与正常对照组比较,*P<0.05;与耐药对照组比较,#P<0.05;与LV-NC组比较,△P<0.05图1 四组细胞miR-138-5p表达水平比较图
2.2四组细胞增殖抑制率比较 耐药对照组和LV-NC组增殖抑制率较正常对照组降低,LV-miR-138-5p mimics组抑制率较耐药对照组、LV-NC组升高,差异有统计学意义(P<0.05);LV-miR-138-5p mimics组抑制率与正常对照组相比,差异无统计学意义(P>0.05)。见图2。

注:各时间点增殖抑制率比较:24 h:F=81.647,P<0.001;48 h:F=50.181,P<0.001;72 h:F=45.523,P<0.001;与正常对照组比较,*P<0.05;与耐药对照组比较,#P<0.05;与LV-NC组比较,△P<0.05图2 四组细胞增殖抑制率比较图
2.3四组细胞凋亡率比较 与正常对照组相比,耐药对照组、LV-NC组细胞凋亡率降低,LV-miR-138-5p mimics组细胞凋亡率高于耐药对照组、LV-NC组,差异有统计学意义(P<0.05);LV-miR-138-5p mimics组细胞凋亡率与正常对照组相比,差异无统计学意义(P>0.05)。见图3。

注:F=124.702,P<0.001;与正常对照组比较,*P<0.05;与耐药对照组比较,#P<0.05;与LV-NC组比较,△P<0.05图3 四组细胞凋亡率比较图
2.4四组细胞自噬小体数目比较 与正常对照组相比,耐药对照组、LV-NC组、LV-miR-138-5p mimics组细胞中自噬小体数目显著增多(P<0.05);LV-miR-138-5p mimics组自噬小体数目少于耐药对照组、LV-NC组,差异有统计学意义(P<0.05)。见图4。
注:F=245.336,P<0.001;与正常对照组比较,*P<0.05;与耐药对照组比较,#P<0.05;与LV-NC组比较,△P<0.05图4 四组细胞自噬小体数目比较图
2.5四组细胞Beclin-1、LC3Ⅱ、Bcl-2蛋白表达水平比较 与正常对照组相比,耐药对照组、LV-NC组、LV-miR-138-5p mimics组LC3Ⅱ、Beclin-1表达水平升高,Bcl-2蛋白表达水平降低,差异有统计学意义(P<0.05)。LV-miR-138-5p mimics组LC3Ⅱ、Beclin-1表达水平低于耐药对照组和LV-NC组,Bcl-2表达水平高于耐药对照组和LV-NC组,差异有统计学意义(P<0.05)。见图5。
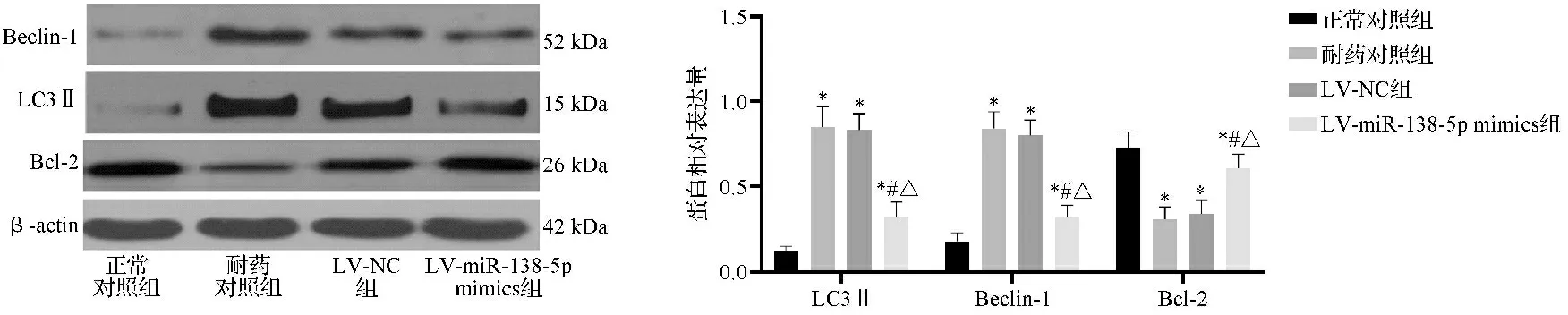
注:四组LC3Ⅱ蛋白相对表达量比较,F=129.214,P<0.001;四组Beclin-1蛋白相对表达量比较,F=140.340,P<0.001;四组Bcl-2蛋白相对表达量比较,F=23.346,P<0.001;与正常对照组比较,*P<0.05;与耐药对照组比较,#P<0.05;与LV-NC组比较,△P<0.05图5 四组细胞Beclin-1、LC3Ⅱ、Bcl-2蛋白表达水平比较图
3 讨论
3.1乳腺癌细胞耐药性是影响治疗效果的主要因素,也是乳腺癌治疗过程中有待解决的难题[6]。TAM是临床常用化疗药,在治疗乳腺癌中具有较好的疗效,且副作用相对较少。然而,乳腺癌细胞对TAM易产生耐药性,严重影响疗效。因此,研究乳腺癌细胞对TAM耐药机制对提高疗效具有重要意义。
3.2miRNAs可通过与互补的靶基因mRNAs结合,导致mRNAs翻译抑制或降解,在细胞分化、增殖和存活中发挥重要作用[7]。有不少研究表明,miRNAs功能失调与肺癌[8]、结肠癌[9]等疾病发生、发展密切相关。miR-138-5p可通过抑制肺癌中Smad核相互作用蛋白1(Smad nuclear interacting protein 1,SNIP1)的表达,抑制细胞增殖与迁移[10]。在结直肠癌中,miR-138-5p呈低表达,过表达miR-138-5p可抑制结直肠癌细胞增殖、迁移和侵袭,提示其具有应用于结直肠癌诊断的前景[11-12]。此外,miR-138-5p在乳腺癌组织和细胞中表达降低,上调miR-138-5p表达可抑制细胞迁移和侵袭能力[5]。本研究结果显示,耐药对照组细胞miR-138-5p相对表达水平显著降低。Yu等[13]研究表明,miR-138-5p可抑制胰腺癌恶性进展,并增加其化疗敏感性。Tang等[14]研究表明,miR-138在吉非替尼耐药肺癌细胞中表达水平显著降低,上调miR-138表达可增加肺癌细胞对吉非替尼敏感性,显著抑制肺癌细胞增殖。本研究结果显示,过表达miR-138-5p能提高耐药细胞的增殖抑制率和凋亡率,提示过表达miR-138-5p可增加MCF-7/TAM细胞对TAM敏感性。
3.3自噬是指在饥饿、缺氧及能量应激状态下,细胞通过膜结构降解胞质细胞器和生物大分子的动态过程,可清除已受损或功能异常的细胞器,对机体稳态进行调控,在营养和能量缺乏、细胞衰老、蛋白质变性等多种病理、生理过程中发挥重要作用[15]。自噬对肿瘤细胞的作用具有两面性:在肿瘤发生早期,自噬可通过清除线粒体中活性氧产生非正常折叠蛋白,发挥抗肿瘤作用[16];对于成熟肿瘤细胞,自噬可对受损蛋白降解重新利用,为肿瘤细胞提供营养和能量,促进肿瘤细胞生长,同时,抗肿瘤药会引起细胞损伤,而自噬可清除损伤的细胞器,从而降低肿瘤细胞对药物的敏感性,增强肿瘤耐药[17]。自噬泡膜的延伸由LC3-Ⅰ介导,正常状态下,LC3-Ⅰ存在细胞质中表达,当发生自噬时,LC3-Ⅰ经过泛素样蛋白系统加工修饰,与磷脂酰乙醇胺结合,形成LC3-Ⅱ,参与自噬体形成,LC3-Ⅱ蛋白为自噬体形成的标志性蛋白[18]。Beclin-1在多数肿瘤细胞中低表达,其不仅是一种抑癌基因,而且还是自噬相关基因。Beclin-1通过与不同的分子结合,介导自噬与凋亡途径发生[19]。Bcl-2在细胞凋亡过程中具有重要作用,是一种抑制凋亡蛋白,可与Beclin-1结合,抑制Beclin-1介导的细胞自噬功能[20]。研究发现,miR-138-5p过表达可通过靶向沉默信息调节因子1(silent information regulator 1,SIRT1)抑制胰腺癌细胞自噬作用[21]。本研究结果显示,过表达miR-138-5p能够明显减少自噬小体数目,降低LC3-Ⅱ、Beclin-1蛋白表达水平,提高Bcl-2蛋白表达水平,抑制MCF-7/TAM细胞中自噬作用。
综上所述,过表达miR-138-5p可抑制MCF-7/TAM细胞自噬作用,提高细胞对TAM敏感性,降低耐药性,可能为临床改善乳腺癌TAM耐药性提供新思路。但本研究未能对miR-138-5p抑制自噬的具体机制进行验证。后期将对miR-138-5p的靶基因进行筛选、验证,以明确其调控MCF-7/TAM细胞自噬作用的具体机制。

