以腹股沟疝为主要表现的腹膜假性黏液瘤一例
范仕嘉, 万宇智, 李成龙, 卢太亮, 彭 微, 陈超武
作者单位:410005 长沙,湖南师范大学附属第一医院胃肠外科
1 病例介绍
患者,男,61岁,主因“发现右侧腹股沟包块1年”于2021年11月24日入院。查体:站立位右侧腹股沟区可扪及一约3 cm×4 cm大小包块,未坠入阴囊,肿物光滑,质软,平卧后肿物可部分回纳。血常规、肝肾功能、电解质常规、心电图、腹部超声检查无明显异常。浅表器官超声检查示:双侧腹股沟区可探及疝囊样结构向腹腔外凸出,疝口前后径分别约为12 mm(右侧)、6.6 mm(左侧),疝囊大小分别约为102 mm×36 mm(右侧)、36 mm×12 mm(左侧),瓦氏动作可见增大,加压可部分纳入腹腔,疝内容物为网膜、腹腔积液(见图1)。根据患者右侧腹股沟区可复性包块症状及浅表器官超声,初步诊断为双侧腹股沟疝,于2021年11月26日行右半结肠切除术。术中探查见:双侧腹股沟区可见疝囊,腹腔内可见较多胶冻样腹水,腹壁及肠系膜上可见胶冻样结节种植;阑尾处可见灰白色肿块并破溃胶冻样液体流出,肿块大小约为5 cm×4 cm×4 cm,已侵出浆膜;相应结肠系膜淋巴结可见肿大,未融合成团,质中;末端回肠肠管及盲肠部分受侵犯。结合术中情况,考虑为阑尾黏液性肿瘤并破溃、腹腔种植可能。拟行腹腔镜双侧腹股沟疝修补术调整为右半结肠切除术+腹腔热灌注术。完整切除肿物后送快速病理检查,结果回报为低级别黏液性肿瘤。使用生理盐水冲洗腹腔,分别留置左侧脾窝、右侧肝肾隐窝、盆腔(2根)引流管备术后热灌注化疗。病理检查结果示:(1)阑尾低级别黏液性肿瘤(low-grade appendiceal mucinous neoplasm,LAMN)伴腹膜假性黏液瘤(pseudomyxoma peritonei,PMP)形成,肿瘤大小7 cm×4.5 cm×4 cm,侵及浅肌层,阑尾肌层及阑尾浆膜面可见无细胞黏液湖伴肉芽肿反应,回肠、结肠切缘及系膜血管切缘未见肿瘤细胞及黏液。(2)回肠旁淋巴结反应性增生(0/5),结肠旁淋巴结反应性增生(0/11)。(3)网膜组织显充血,未见肿瘤细胞及黏液(见图2)。免疫组化:CK7(-)、CK20(+)、CDX-2(+)、ER(-)、PR(-)、MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)。分别于2021年11月30日(奥沙利铂200 mg)、12月2日(5-氟尿嘧啶1 000 mg)、12月4日(5-氟尿嘧啶1 000 mg)行腹腔热灌注化疗后康复出院。分别于2022年3月21日、2022年7月17日、2022年10月22日,3次随访复查胸腹部CT均示:腹腔未见明显新增异常密度灶及异常强化灶,盆腔及腹膜后未见明显肿大淋巴结,腹腔及盆腔未见积液。未见肿瘤复发迹象。
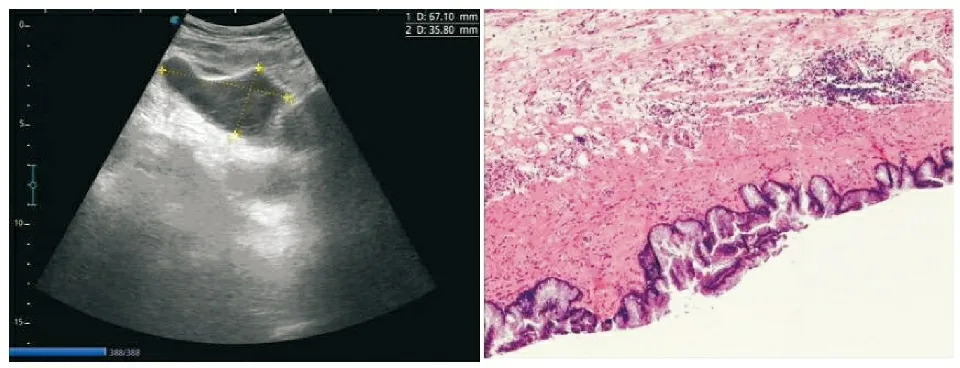
图1 浅表器官超声所见 图2 病理检查所见(HE×10)
2 讨论
2.1PMP是一种以腹腔内大量胶冻样黏液聚集并在腹膜、网膜及腹盆腔脏器上广泛种植的恶性疾病[1]。由于PMP进展缓慢,常通过种植转移而较少经血行或淋巴结转移,PMP通常局限于腹腔内,致使患者早期缺乏特异性临床表现,极易误诊为其他消化道疾病或漏诊。随着疾病的进展,大多数PMP患者出现一些消化道不典型症状如腹胀、腹痛、腹腔积液、腹部包块及肠梗阻等,极少数患者会表现为腹股沟疝[2]。
2.2PMP早期诊断较为困难,常在开腹或腹腔镜手术中偶然发现,术前可通过超声、CT、MRI等进行辅助诊断,但需术后病理才能明确诊断。超声具有简单便捷、无创等优点,过去常作为PMP的首要检查方法,表现特点:盆腔、腹腔内可见大量透声较差的液性暗区,内部回声不均,可见多条高回声分隔带,呈多房样、网隔状,隔上有时见乳头状回声[3]。但PMP的超声特征缺乏特异性,其诊断准确性不高。CT是诊断PMP的首选检查方式,其可显示原发性PMP病变的分布和浸润范围,能发现腹水密度异常及其他特征(包括肝脾周围贝壳状压迹、网膜增厚、腹膜浸润等)[4]。MRI征象与CT所见一致,但在区分黏液和普通腹腔积液时较超声及CT更为敏感。
2.3PMP不同于其他肿瘤,通常根据腹膜疾病的组织学而不是原发性肿瘤进行分类。有专家小组发表了分类建议,将PMP分为无细胞PMP、低级别PMP、高级别PMP和带印戒细胞的高级别PMP[5]。而对于PMP原发肿瘤的起源部位,目前认为PMP多起源于阑尾黏液性肿瘤,尤其是LAMN,部分起源于腹腔内其他器官如卵巢、胰腺、输卵管、尿管、结直肠等[6]。可进一步通过免疫组织化学标志物来确定PMP的原发肿瘤部位。阑尾来源的PMP通常表达为:CK7(-)、CEA(+)、CK20(+)、CDX2(+)、MUC2(+)、MUC5AC(+)、CA125(-)、ER(-)和PR(-)[7]。本例患者术后病检及免疫组化结果均支持PMP来源于阑尾,与文献报道[6]一致。
2.4手术是PMP的主要治疗方式。一般首次手术应切除原发病灶(如阑尾、卵巢)、网膜及黏液病变累及的脏器,但由于确诊PMP时常已发生腹腔种植性转移,难以达到彻底清除而容易复发,需要多次手术。因此肿瘤细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)是目前国际上公认治疗PMP的有效方式[8]。HIPEC通过将含化疗药物的灌注液加热到治疗温度后灌注到肿瘤患者的腹腔内,维持一定的时间,从而达到治疗及改善预后的效果。传统HIPEC存在控温不精准、灌注液不能充盈腹腔达不到安全有效最大化的缺点。国内学者研发了具有高精度、大容量、持续循环、恒温灌注优点的中国腹腔热灌注化疗(China hyperthermic intraperitoneal chemotherapy,C-HIPEC)技术,即将目前常用的灌注化疗药物如丝裂霉素、顺铂、奥沙利铂、5-氟尿嘧啶等加热至(43±0.1)℃后,控制循环速度在400~600 ml/min,治疗60~90 min。通过CRS+HIPEC,即C-HIPEC治疗的患者中,部分患者甚至可能达到临床治愈[9]。在实施C-HIPEC过程中,既可选择单一给药,也可联合序贯给药的方式进行治疗。本例患者采用了联合序贯给药的方式,于2021年11月30日选用了奥沙利铂(200 mg),2021年12月2日、12月4日选用了5-氟尿嘧啶(1 000 mg)进行上述腹腔热灌注治疗,治疗过程前后均未出现不良反应。
2.5PMP作为一种低度恶性肿瘤,一般预后较好。病理学类型、手术减瘤程度及HIPEC是影响患者预后的主要因素。Yan等[10]对接受C-HIPEC治疗的PMP患者进行了多因素分析,结果表明病理学类型是一个独立的预后因素,且高级别PMP或带印戒细胞的高级别PMP病死率远高于低级别PMP。Zhou等[11]对接受去瘤治疗但未能达到完全CRS的PMP患者进行了荟萃分析,结果表明低级别PMP的预后优于高级别PMP。本例患者经右半结肠切除术+HIPEC术后随访10个月未见肿瘤复发,主要原因可能与肿瘤病理学类型及选择了C-HIPEC方案治疗有关,但仍需密切随访观察。
综上所述,PMP是一种临床罕见的腹膜恶性疾病,其临床常表现为消化道不典型症状,缺乏特异性,极易误诊。术前可通过超声、CT、MRI等进行辅助诊断,但确诊需要术后常规病理及免疫组化检查。早诊断、早治疗对于PMP患者尤为重要。建议明确PMP诊断后早期以C-HIPEC方案治疗,改善患者的预后及提高生活质量。

