经食管超声心动图检查指标及纤维蛋白原、红细胞分布宽度对非瓣膜性心房颤动患者血栓形成的预测价值研究
王俊伟,杜利军,王旭,曾玲,申钊,侯博
心房颤动属于心律失常的一种,其发病率约为0.77%,其导致的心源性脑卒中具有较高的致残率和致死率[1]。心房颤动会对心房肌细胞的正常舒张和收缩产生影响,使心房肌细胞失去有效的收缩,导致心房血液瘀滞,血流缓慢,易形成血栓。数据资料显示,伴有血栓形成的心房颤动患者中约有90%的血栓来源于左心耳(left atrial appendage,LAA)[2]。而经食管超声心动图(transesophageal echocardiography,TEE)检查能够清晰显示心耳及心房的结构,评估患者血流状态,其观察指标中的峰值排空流速(peak emptying velocity,PEV)可反映心房重构情况及心房功能,三维射血分数(three dimensionl ejection fraction,3D-EF)可反映心室的射血功能[3]。研究显示,纤维蛋白原(fibrinogen,FIB)可反映机体的微血栓形成和降解情况[4],红细胞分布宽度(red blood cell distribution width,RDW)与外周血管栓塞性疾病、脑卒中、急性心肌梗死等的发生有关[5]。目前少有TEE检查指标及FIB、RDW预测非瓣膜性心房颤动(non valvular atrial fibrillation,NVAF)患者血栓形成的相关研究。基于此,本文旨在分析TEE检查指标(PEV、3D-EF)及FIB、RDW对NVAF患者血栓形成的预测价值,以期为预防NVAF患者形成血栓提供依据。
1 对象与方法
1.1 研究对象 选取2020年1月至2022年1月河北省邯郸市第一医院收治的NVAF患者80例为研究对象。纳入标准:(1)经24 h动态心电图、相关病史确诊为NVAF,且符合心房颤动的诊断标准[6];(2)接受TEE检查。排除标准:(1)近2周内使用过抗凝药物或抗血小板药物者;(2)存在TEE检查禁忌证者;(3)有食管手术史者;(4)患有先天性心脏病、心脏瓣膜病、严重心律失常、严重心力衰竭者;(5)急性期心肌梗死者;(6)伴有上消化道活动性出血者;(7)伴有剧烈咳嗽、胸闷和胸痛等且无法缓解者;(8)患有食管癌或食管炎症、狭窄及静脉曲张者;(9)凝血功能异常者;(10)伴有严重肝肾功能障碍者。本研究经河北省邯郸市第一医院医学伦理委员会批准(2022-L-001)。
1.2 研究方法
1.2.1 基线资料收集 收集患者基线资料,包括年龄、性别、BMI、糖尿病发生情况、高血压发生情况。
1.2.2 TEE检查 采用美国GE公司生产的Vivid E9彩色多普勒超声诊断仪进行TEE检查,探头为GE 6VT-D,频率为3~8 MHz。患者检查前6~8 h禁食,同时进行心电图检查以确定心动周期时相。进行二维TEE检查,在口咽部采用盐酸达克罗宁胶浆进行局部麻醉,通过撑口器将探头送入到食管,插入的深度为距离门齿30~40 cm,在左心室双腔中,将脉冲多普勒取样容积放置在LAA颈部以获取LAA的排空充盈频谱,记录PEV。当左房耳与二维图像互相垂直时,启动3D ZOOM以获取LAA的三维动态图像。采用EchoPAC软件打开LAA的三维动态图像,并测量舒张末期容积(end-diastolic volume,EDV)、收缩末期容积(end-systolic volume,ESV):对于有窦性心律的患者,在心电图P波的起始处测量EDV,在QRS波的末端测量ESV,测量3次取平均值;对于有心房颤动的患者,逐帧观察其LAA长轴面积(红色平面)的变化情况,分别在LAA长轴面积最小、最大时测量ESV、EDV,测量3次取平均值。计算3DEF,3D-EF=(EDV-ESV)/EDV×100%。血栓形成的判定标准:超声回声只有极少量,且只有在增加增益时左心房充盈,则为轻度血栓形成;在心动周期能够看到密集的回声,并且呈现为涡流,则为中度血栓形成;在心动周期能够看到浓稠的超声回声,并且呈现为慢涡流血流,则为重度血栓形成。根据患者血栓形成情况,将其分为血栓形成组31例和非血栓形成组49例。
1.2.3 FIB、RDW检测 患者入院当天清晨抽取静脉血5 ml,3 500 r/min离心10 min(离心半径10 cm),取上清液,采用美国沃芬公司生产的ACL TOP750全自动血凝仪检测FIB,采用美国BD公司生产的Calibur流式细胞仪检测RDW。
1.3 统计学方法 采用SPSS 22.0软件分析数据。计数资料以相对数表示,组间比较采用χ2检验;计量资料以(±s)表示,组间比较采用两独立样本t检验;NVAF患者血栓形成影响因素分析采用多因素Logistic回归分析;采用ROC曲线分析PEV、3D-EF、FIB、RDW及其联合对NVAF患者血栓形成的预测价值,AUC为0.5~0.7说明预测价值低、>0.7~0.9说明有一定预测价值、>0.9说明预测价值较高[7]。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 两组年龄、性别、BMI、糖尿病发生率、高血压发生率比较,差异无统计学意义(P>0.05),见表1。
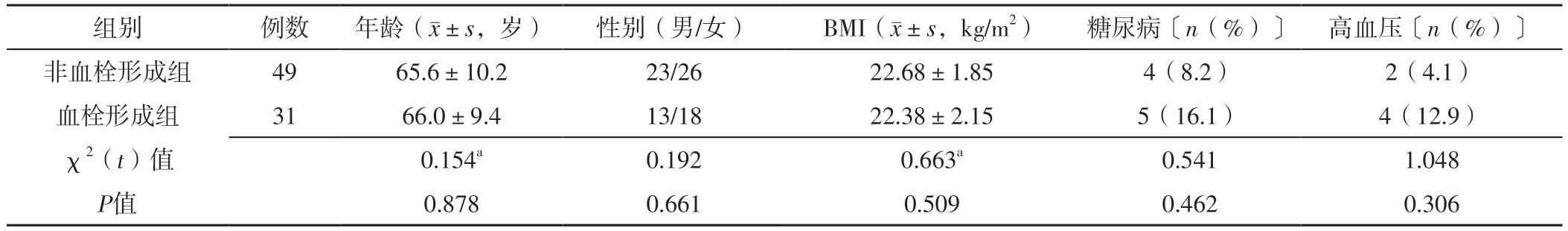
表1 两组基线资料比较Table 1 Comparison of baseline data between the two groups
2.2 两组PEV、3D-EF、FIB、RDW比较 血栓形成组PEV慢于非血栓形成组,3D-EF低于非血栓形成组,FIB、RDW高于非血栓形成组,差异有统计学意义(P<0.05),见表2。
表2 两组PEV、3D-EF、FIB、RDW比较(±s)Table 2 Comparison of PEV,3D-EF,FIB,RDW between the two groups
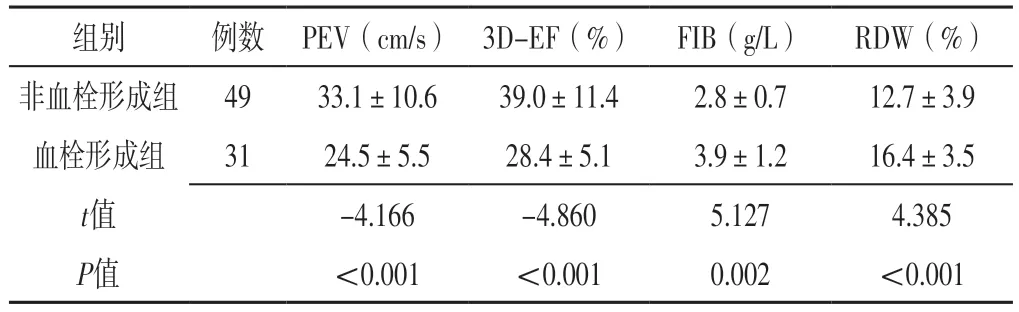
表2 两组PEV、3D-EF、FIB、RDW比较(±s)Table 2 Comparison of PEV,3D-EF,FIB,RDW between the two groups
注:PEV=峰值排空流速,3D-EF=三维排空分数,FIB=纤维蛋白原,RDW=红细胞分布宽度
组别例数 PEV(cm/s) 3D-EF(%) FIB(g/L)RDW(%)非血栓形成组4933.1±10.639.0±11.42.8±0.712.7±3.9血栓形成组3124.5±5.528.4±5.13.9±1.216.4±3.5 t值-4.166-4.8605.1274.385 P值<0.001<0.0010.002<0.001
2.3 NVAF患者血栓形成影响因素的多因素Logistic回归分析 以PEV、3D-EF、FIB、RDW为自变量(实测值),NVAF患者血栓形成情况为因变量(赋值:血栓形成=1,非血栓形成=0),进行多因素Logistic回归分析,结果显示,PEV、3D-EF、FIB、RDW是NVAF患者血栓形成的影响因素(P<0.05),见表3。
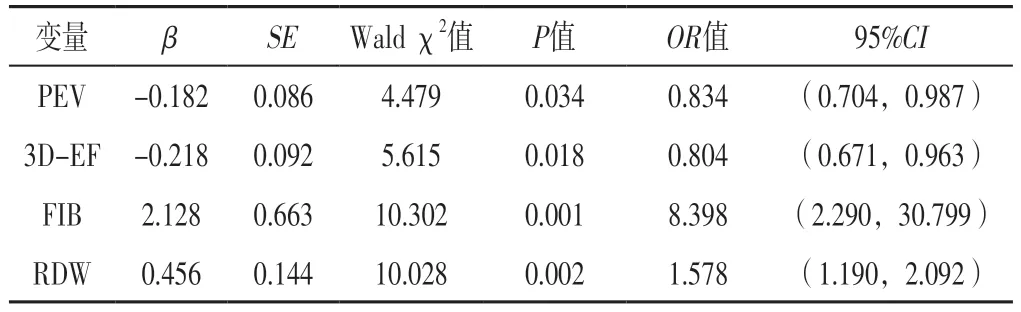
表3 NVAF患者血栓形成影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of the influencing factors of thrombosis in NVAF patients
2.4 PEV、3D-EF、FIB、RDW及其联合预测NVAF患者血栓形成的价值 ROC曲线分析结果显示,PEV、3D-EF、FIB、RDW及其联合预测NVAF患者血栓形成的AUC分别为0.707〔95%CI(0.592,0.822)〕、0.737〔95%CI(0.628,0.846)〕、0.738〔95%CI(0.622,0.854)〕、0.736〔95%CI(0.623,0.849)〕、0.972〔95%CI(0.942,1.000)〕,最佳临界值分别为37.7 cm/s、40.3%、4.1 g/L、10.2%、-14.4,灵敏度分别为100.0%、100.0%、51.6%、100.0%、90.3%,特异度分别为49.0%、51.0%、100.0%、46.9%、95.9%,见图1。
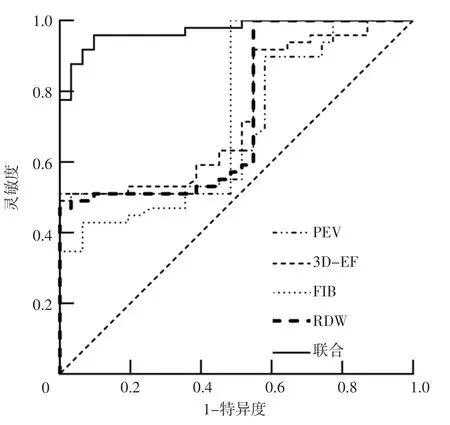
图1 PEV、3D-EF、FIB、RDW及其联合预测NVAF患者血栓形成的ROC曲线Figure 1 ROC curve of PEV,3D-EF,FIB,RDW and their combination in predicting thrombosis in patients with NVAF
3 讨论
心房颤动患者的LAA极易形成血栓,主要是因为心房扩大及血流瘀滞导致心房内形成涡流,增加血液黏度,致使心房内皮受到损伤,促使血小板增多,触动机体的凝血机制,最终形成血栓[8-9]。同时,心房颤动患者心动不规则且速度过快、神经体液被激活以及心肌纤维化等均会导致左心功能不全,增加左心室充盈压,导致左心房血液排出受阻,从而形成血栓[10-11]。研究表明,和非心房颤动患者相比,NAVF患者发生缺血性脑卒中的风险增加4~5倍[12]。因此,筛查NAVF患者血栓形成风险具有重要意义。
PEV较易被检测出,其在临床中被广泛应用于LAA血栓的筛查,但采用3D-EF筛查LAA血栓的相关研究较少。相较于TEE检查中的二维面积法,三维容积法用于筛查LAA血栓形成的效果更佳,主要在于心脏是螺旋运动,会导致LAA长轴的最大面和超声扫查切面脱离。本研究结果显示,血栓形成组PEV慢于非血栓形成组,3D-EF低于非血栓形成组;且多因素Logistic回归分析结果显示,PEV、3D-EF是NVAF患者血栓形成的影响因素,提示PEV减慢、3D-EF降低可增加NVAF患者血栓形成风险。分析原因为心房颤动发病时会导致左心耳壁不协调运动,导致LAA排空困难,血流瘀滞在LAA且血流速度减慢,继而导致PEV减慢,从而形成血栓[13]。本研究ROC曲线分析结果显示,PEV、3D-EF预测NVAF患者血栓形成的AUC分别为0.707、0.737,提示PEV、3D-EF对NVAF患者血栓形成有一定预测价值。
FIB参与机体的血小板聚集、凝血等过程,其水平升高会导致凝血和纤溶系统失去平衡,增加血液黏度及血小板、红细胞的聚集性,从而增加血栓形成风险[14]。研究表明,FIB升高与心房颤动患者发生血栓栓塞及其严重程度有关,且与心房颤动患者预后不良有关[15-17]。本研究结果显示,血栓形成组FIB高于非血栓形成组,且多因素Logistic回归分析结果显示,FIB是NVAF患者血栓形成的影响因素,提示FIB升高可增加NVAF患者血栓形成风险。分析原因为FIB会增加血液黏度,促进红细胞聚集,同时其升高表明炎症反应加重,会导致内皮损伤、血小板活化,致使机体处于高凝状态,从而导致血栓形成[18]。本研究ROC曲线分析结果显示,FIB预测NVAF患者血栓形成的AUC为0.738,提示FIB对NVAF患者血栓形成有一定预测价值。
RDW在临床上被用于评估红细胞大小以及数量的变化,当RDW降低时,红细胞体积异质性变小,没有临床意义,但当RDW升高时,红细胞大小不均匀,因而其主要被应用于鉴别诊断血液系统疾病[19]。研究表明,RDW和心血管疾病的发生及其预后均有关系[20]。已有研究证实,RDW在发生心脏不良事件的急性心肌梗死、缺血性脑卒中患者中均呈高表达,且与患者预后有关[21-22]。石树青等[23]研究表明,RDW升高与心房颤动有关。本研究结果显示,血栓形成组RDW高于非血栓形成组,且多因素Logistic回归分析结果显示,RDW是NVAF患者血栓形成的影响因素,提示RDW升高可增加NVAF患者血栓形成风险。分析原因为机体内氧化应激反应或炎症反应会损伤红细胞成熟因子,导致红细胞生成素的生成减少,致使红细胞异质性升高,最终导致RDW升高;而氧化应激或炎症反应还会导致心房细胞内皮损伤,从而导致血栓形成。本研究ROC曲线分析结果显示,RDW预测NVAF患者血栓形成的AUC为0.736,提示RDW对NVAF患者血栓形成有一定预测价值。
此外,本研究ROC曲线分析结果还显示,PEV、3D-EF、FIB、RDW联合预测NVAF患者血栓形成的AUC为0.972,提示PEV、3D-EF、FIB、RDW联合对NVAF患者血栓形成有较高的预测价值。因此,临床可对NVAF患者进行TEE检查以测定PEV、3D-EF,同时联合血清FIB、RDW检测,以预测其血栓形成风险。
综上所述,PEV、3D-EF、FIB、RDW均对NVAF患者血栓形成有一定预测价值,而其联合对NVAF患者血栓形成有较高预测价值。但本研究样本量较小,今后仍有待大样本量研究进一步验证本研究结论。
作者贡献:王俊伟进行文章的构思与设计、结果的分析与解释、论文撰写与修订,对文章整体负责、监督管理;王俊伟、杜利军进行研究的实施与可行性分析;王旭、曾玲进行数据收集;王旭、申钊进行统计学处理;王俊伟、侯博负责文章的质量控制及审校。
本文无利益冲突。

