阿尔茨海默病的影响因素及其预测模型构建
吴天晨,杨卉,梁艳
阿尔茨海默病(Alzheimer disease,AD)是最常见的神经退行性疾病之一,也是痴呆最常见的病因,目前全球约有痴呆患者5 000万例,且预计到2050年将上升到1.52亿;其以散发型病例为主,病因多样,与环境和遗传因素密切相关[1]。由于AD起病隐匿且缺乏治疗方法和早期诊断工具,故早期确诊AD较为困难。AD是一个连续的病理生理学过程,其临床前期阶段长达数十年,且检测脑脊液相关生物学标志物或脑组织病理学检查均为有创检查,故对于大多数进行健康筛查的人群而言,较难接受[2]。对于轻度认知障碍患者,延迟确诊可导致治疗的滞后,进而直接影响患者预后。因此,构建AD预测模型能在患者出现明显认知障碍前预测AD的发生风险,可对该病起到预警作用且能指导高危患者进行早期防治,具有较大的临床意义。基于此,本研究旨在探讨AD的影响因素并构建其预测模型。
1 对象与方法
1.1 研究对象 选取2019年1月至2021年1月就诊于南京市中医院的61例AD患者作为AD组,另选取同期于该院体检中心进行体检的健康者122例作为健康组。AD组纳入标准:符合美国国家衰老研究院-阿尔茨海默病协会制定的AD诊断标准[3],即简易精神状态检查量表〔文盲≤17分,小学≤20分,中学(包括中专)≤22分〕、Blessed痴呆评定量表(>10分可认为有痴呆)或类似检查诊断为痴呆;认知缺陷至少累积2个认知领域,无意识障碍。AD组排除标准:(1)严重脑血管病造成的认知障碍或痴呆、意识障碍、谵妄、短暂性意识障碍及药物、毒物引起的认知障碍;(2)入院72 h内血生化指标不完整者。健康组纳入标准:年龄>45岁。本研究免除伦理审查。
1.2 观察指标 通过南京市中医院临床大数据平台收集所有研究对象的基线资料,包括性别、年龄、高血压史、糖尿病史、冠心病史、载脂蛋白E(apolipoprotein E,ApoE)基因分型、实验室检查指标〔TG、TC、LDL-C、HDL-C、脂蛋白a、载脂蛋白A1、载脂蛋白B、促甲状腺激素(thyroid-stimulating hormone,TSH)、游离甲状腺素(free thyroxine,FT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、总三碘甲状腺原氨酸(total triiodothyronine,TT3)、总甲状腺素(total thyroxine,TT4)〕。
1.3 统计学方法 采用R 4.2.1统计学软件进行数据分析。计数资料以相对数表示,组间比较采用χ2检验;偏态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon非参数检验;采用mice包进行缺失值分析及多重插补;采用LASSO回归[4]进行自变量的筛选,调整惩罚系数,以lambda.1se为截断点筛选自变量[5-6];采用多因素Logistic回归分析探讨AD的影响因素,自变量的选择方法为逐步向后回归法,并根据AD的影响因素构建预测模型;绘制ROC曲线以探讨预测模型对AD的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 两组TG、LDL-C、HDL-C、脂蛋白a、载脂蛋白A1、TSH、FT4、TT3比较,差异无统计学意义(P>0.05)。两组性别、年龄、ApoE基因分型、TC、载脂蛋白B、FT3、TT4比较,差异有统计学意义(P<0.05),见表1。
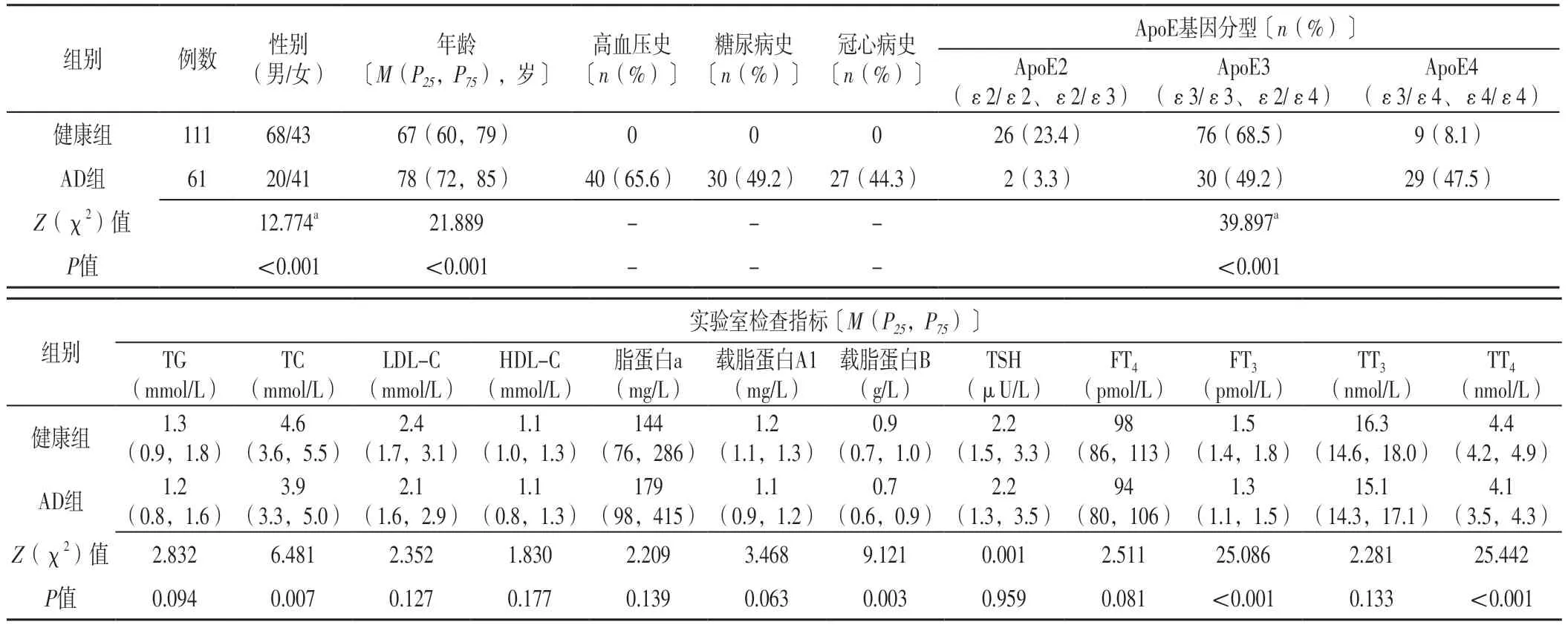
表1 两组基线资料比较Table 1 Comparison of baseline data between the two groups
2.2 LASSO回归 将基线资料的18个变量纳入LASSO回归模型,计量资料为实测值,分类变量进行赋值,即性别:男=1,女=0;高血压史:有=1,无=0;糖尿病史:有=1,无=0;冠心病史:有=1,无=0;ApoE基因分型:ApoE2(ε2/ε2、ε2/ε3)=2、ApoE3(ε3/ε3、ε2/ε4)=3、ApoE4(ε3/ε4、ε4/ε4)=4,构建LASSO交叉验证图及回归路径图。通过调整惩罚系数,以lambda.1se为截断点筛选出性别、年龄、ApoE基因分型、FT3、TT35个系数不为零的因子,见图1~2。
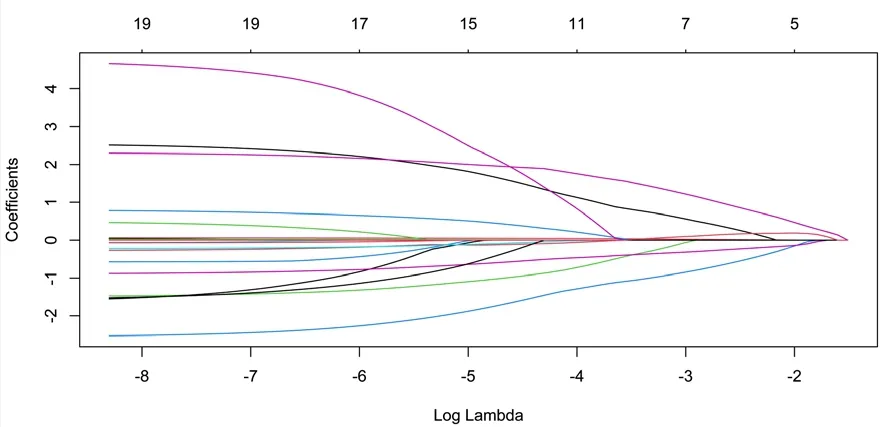
图2 LASSO回归路径图Figure 2 LASSO regression path diagram
2.3 AD影响因素的多因素Logistic回归分析及其预测模型的构建 以LASSO回归筛选出的4个变量为自变量(赋值不变,由于FT3与TT3存在共线性,将其剔除),以研究对象是否患有AD为因变量(赋值:是=1,否=0),进行多因素Logistic回归分析,结果显示,性别、年龄、ApoE基因分型、TT3是AD的独立影响因素(P<0.05),见表2。基于上述影响因素构建预测模型:P=ex/(1+ex),其中x=-5.170+1.267×男性+0.058×年龄+2.389×ApoE3(ε3/ε3、ε2/ε4)+4.572×ApoE4(ε3/ε4、ε4/ε4)-2.059×TT3。
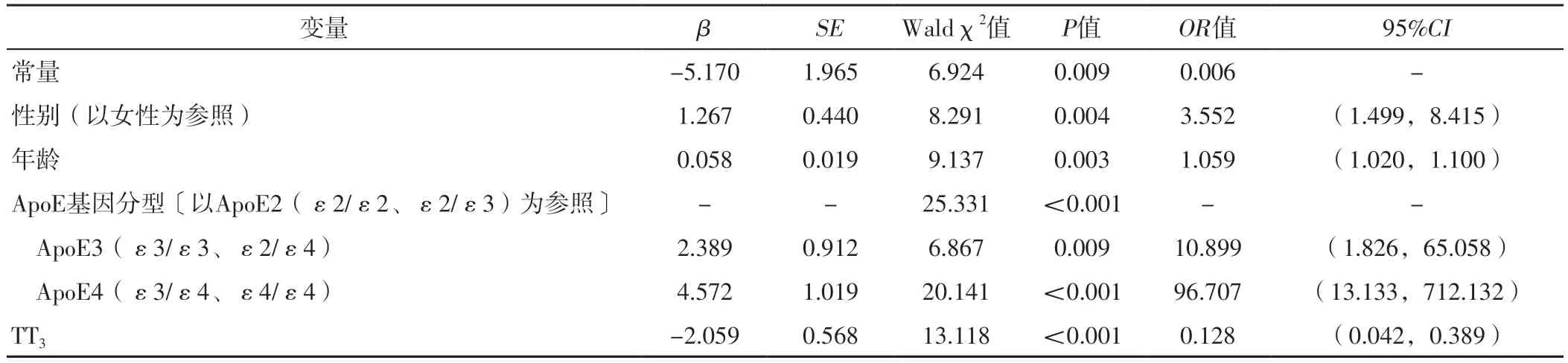
表2 AD影响因素的多因素Logistic回归分析Table 2 Multivariate Logistic regression analysis of the influencing factors of AD
2.4 ROC曲线分析 ROC曲线分析结果显示,预测模型预测AD的AUC为0.885〔95%CI(0.832,0.938)〕,见图3。
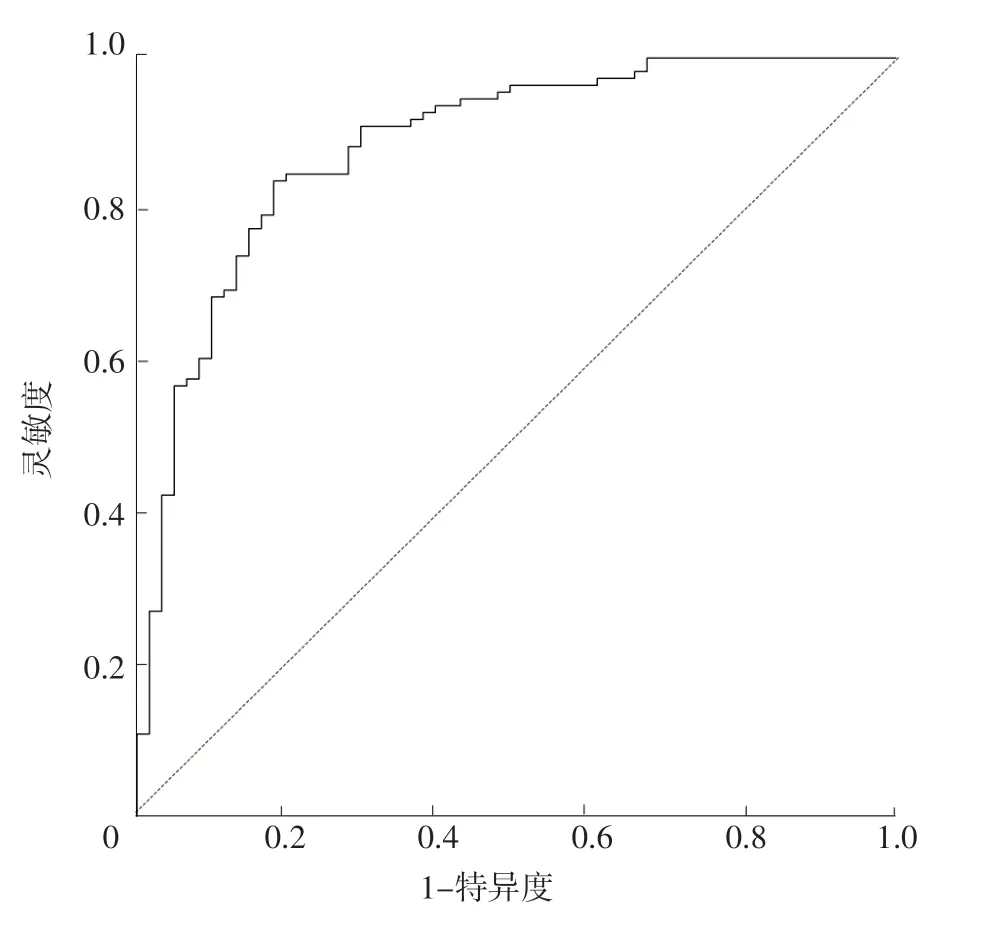
图3 预测模型预测AD的ROC曲线Figure 3 ROC curve of prediction model for predicting AD
3 讨论
AD是一种渐进的、不可逆转的神经退行性疾病,其发病隐匿,会导致神经元的退变和凋亡,迄今为止尚无有效的治疗策略。而尽早筛查临床前期AD并进行早期干预,对降低AD发生风险及改善AD患者预后具有重要意义[7]。既往研究显示,血管危险因素与AD患者脑内病理改变无明显相关性[8-10]。干预LIVINGSTON等[11]荟萃分析结果显示的9个痴呆影响因素(受教育程度低、高血压、听力障碍、吸烟、肥胖、抑郁、缺乏运动、糖尿病和低社会接触)及近年来新发现的3个痴呆影响因素(过量饮酒、脑外伤和空气污染),理论上可以预防或延缓痴呆,但上述影响因素一般是针对非AD患者,且大部分AD患者通过生活方式干预收效甚微。因为这些针对血管损伤的二级预防措施可能无法有效预防AD的发生及脑内β淀粉样蛋白(β-amyloid,Aβ)的异常沉积,故需要从其他角度寻找AD的预防措施,如构建早期AD的预测模型,然后可以针对AD发病风险高的人群采取针对性的预防措施。本研究LASSO回归及多因素Logistic回归分析结果显示,性别、年龄、ApoE基因分型、TT3是AD的影响因素,并据此构建了AD的预测模型。
有研究者认为,性别与AD的发病密切相关,女性比男性更容易罹患AD,尽管男性和女性的Aβ负荷相似,但女性可能具有更高的Tau蛋白负荷[12]。且目前的流行病学数据显示,AD患者中约2/3是女性[13]。但LIESINGER等[14]研究指出,在神经病理学诊断的AD患者中,男性与女性的AD发病率比较,差异无统计学意义,且男性AD患者发生认知障碍的时间早于女性,其特点为病程短、死亡率高、非典型临床症状隐匿,考虑男性AD发病率低可能与其临床症状隐匿性高、报道较少有关。但本研究结果显示,男性是AD的危险因素,考虑与以下因素有关:(1)既往研究显示,雌激素为AD的保护因素[15],虽然绝经期妇女认知功能下降较男性更为明显,但绝经前女性AD发病风险可能低于男性;(2)此外,还可能与男性吸烟、饮酒者占比更高有关。在人口学资料中,AD与年龄的关系密切,随着年龄增长,AD患者记忆力和认知能力均会出现进行性下降,分析原因可能与脑神经元的自由基积累、脂代谢紊乱、不可逆转的神经变性及脑萎缩有关[16]。AD最强的危险因素是高龄[17]。
ApoE是大脑中的主要胆固醇载体,可参与神经元生长、细胞膜修复和重塑、清除和降解Aβ以及减轻神经炎症[18]。ApoE2(ε2/ε2、ε2/ε3)、ApoE3(ε3/ε3、ε2/ε4)、ApoE4(ε3/ε4、ε4/ε4)是ApoE的3个等位基因。研究表明,与携带ApoE3 ε3/ε3的患者相比,携带ApoE3 ε2/ε4的患者罹患AD的风险升高1.64倍,携带ApoE 4 ε3/ε4的患者罹患AD的风险升高2.63倍,而携带ApoE4 ε4/ε4的患者罹患AD的风险升高近14.00倍[19]。近年研究认为,ApoE4(ε3/ε4、ε4/ε4)是导致迟发型AD最强的遗传风险因素,ApoE4可诱导神经元产生淀粉样蛋白斑块和神经原纤维缠结,而ApoE2可以预防或逆转上述过程的发生,进而发挥神经保护作用[20]。相关研究表明,相对于ApoE2和ApoE3,ApoE4在促进Aβ肽异常聚集而形成Aβ寡聚体和原纤维的同时也抑制Aβ从大脑清除,延长了其消除t1/2,并且在神经元间质液中抑制降解酶对其进行降解[21]。相较于其他ApoE亚型,ApoE2具有较明显的神经保护作用;而与ApoE2相对应的ApoE4对AD的发生发展起到推动作用,并且随着年龄增长,其影响逐渐增强。KIM等[22]将研究对象按照年龄分为三组(<65岁、65~74岁和≥75岁),通过比较各年龄组ApoE4携带者与未携带ApoE4者的脑皮质厚度和认知功能发现,随着年龄增长,ApoE4携带者首先于额叶和外侧裂出现萎缩,进而于内侧颞叶出现萎缩,导致语言、视觉空间和额叶功能出现进展性的减退;而未携带ApoE4者上述现象的出现时间延迟,且相应的症状出现更晚或几乎不出现。
由自身甲状腺合成的三碘甲状腺原氨酸占体内TT3的10%~20%,由TT4脱碘转化成的三碘甲状腺原氨酸占TT3的80%~90%。血清中绝大多数三碘甲状腺原氨酸与血浆中的特异蛋白结合,仅极少数处于游离状态。FT3能透过细胞膜进入组织细胞,进而发挥生理效应,其浓度与组织中的三碘甲状腺原氨酸浓度一致。研究表明,低三碘甲状腺原氨酸或者低FT3会导致情绪障碍及抑郁症的发生[23],老年人出现重度抑郁是其罹患AD的危险因素。抑郁状态及抑郁症和长期低落的情绪会造成痴呆的提前出现[24]。FT3的下降可能是造成痴呆发生的一个重要因素[25],但在本研究中,考虑FT3是TT3的一部分,且其含量低,二者存在共线性[26],故未将FT3纳入多因素Logistic回归分析。血清三碘甲状腺原氨酸在组织中主要与血浆中的特异蛋白结合,基本很少发挥作用。所以FT3可能是真正对痴呆起作用的因素。GE等[27]一项前瞻性横断面研究发现,FT3水平可影响脑脊液Aβ水平和Aβ42/Aβ40比值,是AD的重要预测因子,在甲状腺功能正常的情况下,血清低水平FT3会导致AD的发生风险增加。CHANG等[28]研究显示,AD患者的皮质醇水平较高,且三碘甲状腺原氨酸及FT3水平低于正常水平,考虑下丘脑-垂体-甲状腺轴与AD的发生相关。18F-FDG PET/CT扫描对神经退行性疾病具有诊断价值。CHIARAVALLOTI等[29]通过18F-FDG PET/CT扫描检测AD患者颅内葡萄糖消耗水平,结果显示,AD患者TSH、FT3与颅内葡萄糖消耗之间存在相关关系,AD患者表现出下丘脑-垂体-甲状腺轴的异常生物反馈调节,并且在前扣带皮质和内侧额叶回的葡萄糖消耗水平与体内游离三碘甲状腺素呈现同步关系,提示前扣带和额叶的皮质功能障碍可能会影响AD患者血清TSH水平。上述研究提示,血清甲状腺功能指标可能与AD发病相关,故本研究建模时纳入了血清甲状腺功能相关指标。本研究结果显示,TT3是AD的影响因素,但FT3与TT3为从属关系,故本研究与上述研究结论并不相悖。而甲状腺激素是否会对Aβ的生成起到抑制作用,需要进一步研究论证。本研究ROC曲线分析结果显示,预测模型预测AD的AUC为0.885〔95%CI(0.832,0.938)〕,提示本研究构建的预测模型对AD具有一定预测价值。
综上所述,性别、年龄、ApoE基因分型、TT3是AD的影响因素,而根据上述影响因素构建的预测模型对AD发生具有一定预测价值。但本研究为小样本量、单中心研究,根据10倍EPV原则[30],AD相关临床指标的纳入受到限制,未来可通过扩大样本量,增加AD发病风险因素如受教育程度、焦虑抑郁等,以构建更加稳健的预测模型,且后期应对构建的预测模型进行验证。
作者贡献:吴天晨、杨卉进行文章的构思与设计,撰写、修订论文,负责文章的质量控制及审校;杨卉进行研究的实施与可行性分析,对文章整体负责,监督管理;吴天晨、梁艳进行资料收集;梁艳进行资料整理;吴天晨进行统计学处理。
本文无利益冲突。

