特发性癫痫患者外周血差异表达miRNA 分析
仲婷,景燕,陆明佳,党辉,李红燕
癫痫是大脑神经元突发性异常放电,造成大脑功能短暂性障碍的一种慢性病。流行病学调查显示,全球约有5 000万癫痫患者,其中我国癫痫患者约占18%,且新发患者数量正以每年40万~60万的速度增长[1]。研究证实,癫痫长期反复发作可改变脑白质结构,造成不同类型及程度的认知功能损伤,尤其在记忆、语言、执行、情绪等方面,而上述任何一种认知功能损伤均可对机体造成不可逆的影响[2]。目前,常规抗癫痫药物只可控制2/3患者的病情,尚不能从根本上改变患者的病理生理状态[3]。此外,虽然分子生物学及基因测序技术不断进步,但特发性癫痫的致病基因尚未被明确[4]。miRNA是一种小型类似siRNA的分子,由高等真核生物基因组编码,其可通过与靶基因mRNA碱基配对并引导沉默复合体降解mRNA或阻碍mRNA翻译而发挥基因调控作用[5]。而通过分析特发性癫痫患者外周血中差异表达miRNA来寻找其生物标志物,对早期诊断和治疗特发性癫痫十分重要。本研究旨在分析特发性癫痫患者外周血差异表达miRNA,以期为特发性癫痫治疗靶点的选择提供理论基础。
1 对象与方法
1.1 研究对象 选取2019年1月至2020年1月在新疆维吾尔自治区人民医院神经内科治疗的特发性癫痫患者12例为病例组。纳入标准:(1)符合特发性癫痫的诊断标准[6]:发作期间脑电波显示全身性棘波活动,并伴有失神、肌肉震颤、阵发性强直等表现;(2)年龄18~36岁;(3)对本研究知情同意。排除标准:(1)颅脑MRI检查显示存在脑器质性、结构性病变者;(2)存在脑血管疾病、头部创伤或颅脑手术史者;(3)合并其他神经类、精神类疾病者;(4)合并其他内、外科疾病者。选取同期于新疆维吾尔自治区人民医院门诊进行体检的健康者12例为对照组。纳入标准:(1)体检结果无明显异常;(2)年龄18~36岁;(3)无癫痫家族史。两组性别、年龄、受教育时间比较,差异无统计学意义(P>0.05),见表1。本研究已通过新疆维吾尔自治区人民医院伦理委员会审核批准(KY2019051562),所有受试者对本研究知情同意。
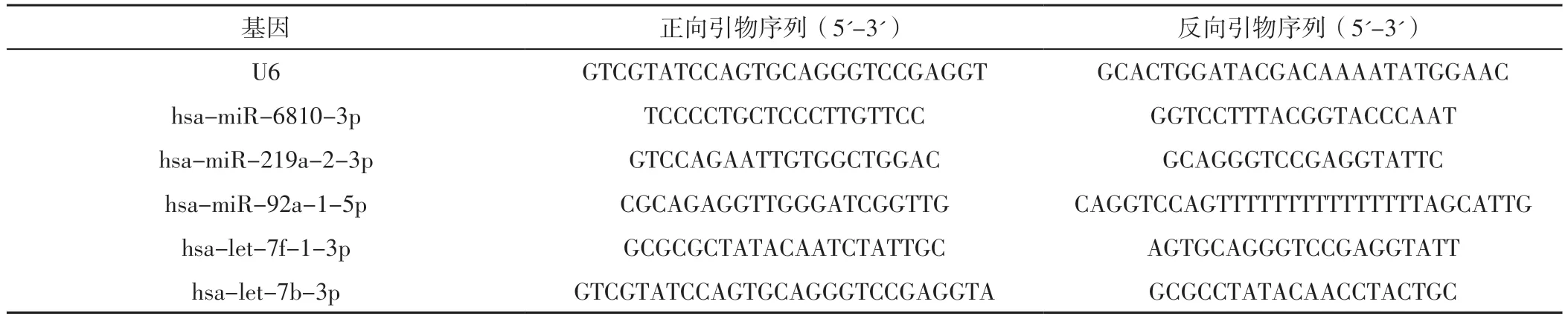
表1 引物序列Table 1 Primer sequences
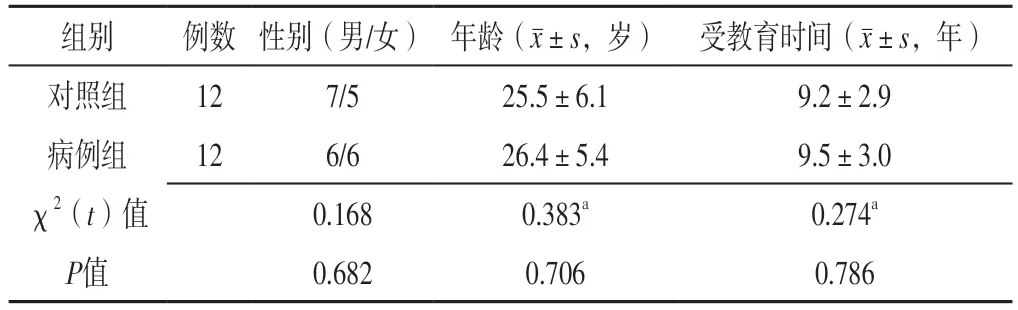
表1 两组一般资料比较Table 1 Comparison of general data between the two groups
1.2 研究方法
1.2.1 外周血采集 采集受试者清晨空腹静脉血5 ml,1 000 r/min离心5 min(离心半径124 mm)(离心机购自赛默飞世尔科技公司,型号:mySPINTM6 Mini Centrifuge),取血浆并低温保存。
1.2.2 高通量测序 委托新疆康智睿生物医学技术服务有限公司协助完成血浆高通量测序。采用Trizol法提取血浆样本中的总RNA,在分光光度计230、260、280 nm波长下测定RNA吸光度,并计算RNA浓度;采用琼脂糖凝胶电泳确定样品RNA纯度及完整性;采用NanoDrop ND-1000定量样品中总RNA质量[7]。取1 μg总RNA并使用T4 RNA连接酶进行催化,使用连接酶分别连接3'端及5'端miRNA测序接头,将随机引物反转为第一链cDNA;采用RT-PCR(PCR 11~12个循环)扩增,采用变性聚丙烯酰胺凝胶(1.0 mm,10孔,购自赛默飞世尔科技公司,货号:EC68752BOX)进行电泳纯化,生成sRNA文库,采用Picogreen荧光染料法(微型荧光仪购自北京原平皓生物技术有限公司,型号:TBS380)对sRNA的质量进行定量分析;采用Illumina cBot簇生成系统进行桥式PCR扩增,生成克隆簇;采用Illumina HiSeq 2000测序仪按照TruSeq Rapid Small RNA cluster试剂盒说明书进行高通量测序,获得原始序列数据和样品待分析数据。除去sRNA序列接头及低质量(原始序列中碱基的测序质量值>30的碱基占总碱基的百分比>80%、接头污染比例≤1%、有效序列长度≥50 bp、数据的有效比对率>70%)的序列,保留长度≥18 nt的序列读数。
1.2.3 差异表达miRNA筛选 采用Off-LineBasecaller软件分析并读取碱基序列,将原始序列数据处理后,获取高通量测序发现的miRNA的丰度信息。采用edgeR软件筛选差异表达miRNA,其筛选条件为|log2FC|≥1且P<0.05;选取差异倍数最大的5位差异表达miRNA。
1.2.4 差异表达miRNA表达水平检测 采用qPCR检测差异表达miRNA表达水平。采用PrimerPremier 5.0软件并根据目标miRNA或基因进行引物设计(见表1)。将混合液(反转录buffer 2.0 μl+上游引物0.2 μl+下游引物0.2 μl+脱氧核糖核苷酸三磷酸 0.1 μl)置于70 ℃干热浴器中3 min,取出后立刻进行冰水浴,冷却至室温;加入莫洛尼鼠白血病病毒反转录酶0.5 μl,37 ℃水浴60 min;随后立即95 ℃干热浴3 min,置于-80 ℃冰箱待测。配置PCR溶液:SYBR Green 1染料10 μl+上游引物1 μl+下游引物1 μl+dNTP 1 μl+Taq聚合酶2 μl+待测样品cDNA 5 μl+双蒸水30 μl,将上述试剂混合后以6 000 r/min离心10 min(离心半径6 cm)。将配置好的PCR溶液置于RT-PCR仪上进行PCR扩增。PCR条件:93 ℃预变性2 min,后按照93 ℃ 1 min、55 ℃ 1 min、72 ℃ 1 min进行40个循环,72 ℃延伸7 min。同时绘制目标miRNA或基因的扩增曲线和熔解曲线以检验差异表达miRNA的引物特异性。使用2-ΔΔCt法计算差异表达miRNA表达水平。
1.3 统计学方法 所有数据采用Excel录入,采用GraphPad Prism 7.00软件包进行数据分析及制图。计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以相对数表示。双侧检验水准:α=0.05。
2 结果
2.1 高通量测序结果 共完成2 4 个样本测序。各样本原始序列数据统计分析结果显示,原始序列数据为10 811 542~14 865 039个,原始测序量(碱基数目)为810 865 650~1 094 213 755个,误差率为0.026 1%~0.0 3 5 1%,原始序列中碱基的测序质量值>2 0 的碱基占总碱基的百分比为9 2.5 6%~9 7.3 2%,原始序列中碱基的测序质量值>3 0 的碱基占总碱基的百分比为8 8.0 1%~9 3.5 0%,碱基G 和C 的数量总和占总碱基数量的百分比为4 5.2 9%~5 2.0 9%。各样本样品待分析数据统计分析结果显示,样品待分析数据为10 714 978~14 226 434个,过滤后得到的测序量(碱基数目)为231 280 458~305 545 866个,误差率为0.022 5%~0.032 0%,原始序列中碱基的测序质量值>20的碱基占总碱基的百分比为95.87%~98.85%,原始序列中碱基的测序质量值>30的碱基占总碱基的百分比为95.30%~96.85%,碱基G和C的数量总和占总碱基数量的百分比为40.38%~47.58%,见表2。
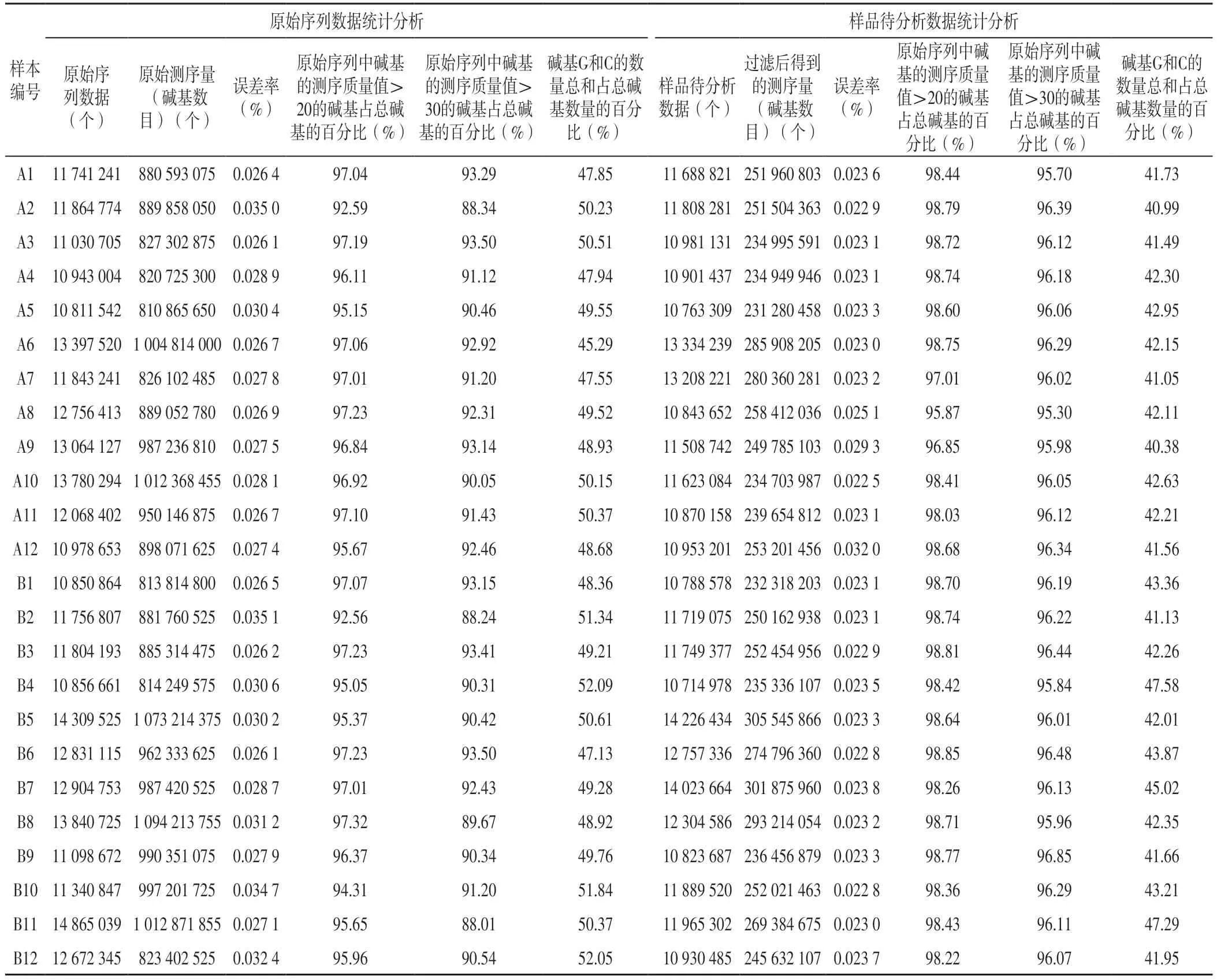
表2 两组原始序列数据、样品待分析数据统计分析Table 2 Statistical analysis of raw reads and clean reads of the two groups
2.2 差异表达miRNA筛选结果 共检测出146个差异表达miRNA,与对照组相比,研究组共有98个miRNA表达上调,48个miRNA表达下调;其中差异倍数最大的5个差异表达miRNA分别为hsa-let-7b-3p、hsa-let-7f-1-3p、hsa-miR-92a-1-5p、hsa-miR-219a-2-3p、hsa-miR-6810-3p,见表3。

表3 5位差异倍数最大的差异表达miRNATable 3 Five differentially expressed miRNA with the largest multiples of difference
2.3 差异表达miRNA表达水平检测结果 扩增曲线分析结果显示,样本均经历了良好的扩增过程,见图1。熔解曲线分析结果显示,大多数曲线为单峰,见图2。病例组hsa-let-7b-3p、hsa-miR-92a-1-5p表达水平低于对照组,hsa-miR-6810-3p表达水平高于对照组,差异有统计学意义(P<0.05);两组hsa-let-7f-1-3p、hsa-miR-219a-2-3p表达水平比较,差异无统计学意义(P>0.05),见表4。
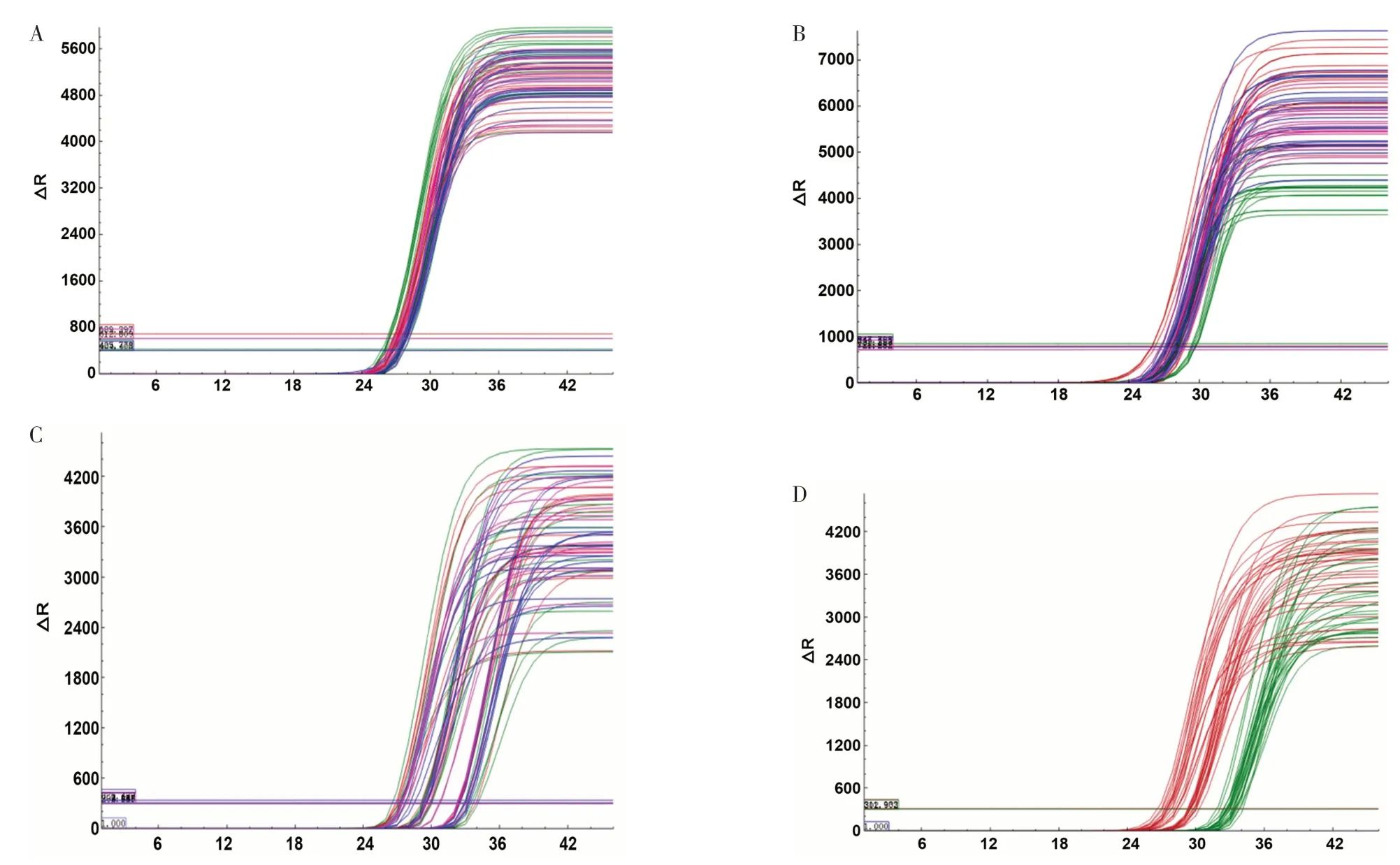
图1 差异表达miRNA的扩增曲线Figure 1 Amplification curve of differentially expressed miRNA
图2 差异表达miRNA的熔解曲线Figure 2 Fusion curve of differentially expressed miRNA
表4 两组差异表达miRNA表达水平比较(±s)Table 4 Comparison of expression levels of differentially expressed miRNA between the two groups
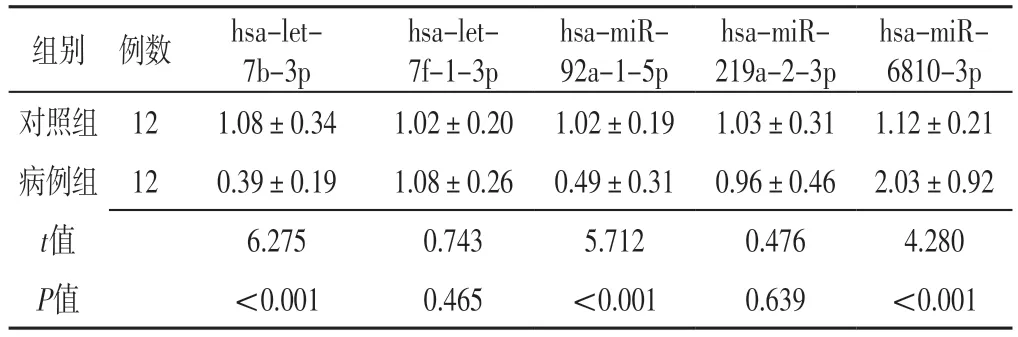
表4 两组差异表达miRNA表达水平比较(±s)Table 4 Comparison of expression levels of differentially expressed miRNA between the two groups
组别 例数hsa-let-7b-3p hsa-let-7f-1-3p hsa-miR-92a-1-5p hsa-miR-219a-2-3p hsa-miR-6810-3p对照组 121.08±0.341.02±0.20 1.02±0.19 1.03±0.31 1.12±0.21病例组 120.39±0.191.08±0.26 0.49±0.31 0.96±0.46 2.03±0.92 t值6.2750.7435.7120.4764.280 P值<0.0010.465<0.0010.639<0.001
3 讨论
研究指出,>80%的人类基因在转录时会产生大量的miRNA等多种非编码RNA,并通过影响靶基因转录、翻译及蛋白质修饰等过程而影响后生动物的生物学过程[8-9]。其中miRNA在脑发育和神经可塑性等方面发挥的作用已得到充分证实[10-12]。本研究旨在分析特发性癫痫患者外周血差异表达miRNA。
本研究各样本原始序列数据统计分析结果显示,原始序列中碱基的测序质量值>20的碱基占总碱基的百分比为92.56%~97.32%,原始序列中碱基的测序质量值>30的碱基占总碱基的百分比为88.01%~93.50%,碱基G和C的数量总和占总碱基数量的百分比为45.29%~52.09%;各样本样品待分析数据统计分析结果显示,原始序列中碱基的测序质量值>20的碱基占总碱基的百分比为95.87%~98.85%,原始序列中碱基的测序质量值>30的碱基占总碱基的百分比为95.30%~96.85%,碱基G和C的数量总和占总碱基数量的百分比为40.38%~47.58%,提示测序样本碱基分布比较均匀,可用于后续分析。
本研究结果显示,共检测出146个差异表达miRNA,与对照组相比,研究组共有98个miRNA表达上调,48个miRNA表达下调;其中差异倍数最大的5个差异表达miRNA分别为hsalet-7b-3p、hsa-let-7f-1-3p、hsa-miR-92a-1-5p、hsa-miR-219a-2-3p、hsa-miR-6810-3p。扩增曲线分析结果显示,样本均经历了良好的扩增过程;熔解曲线分析结果显示,大多数曲线为单峰;说明检测样本的特异性和稳定性比较好,且扩增产物纯度和可靠性比较高。
文献指出,cAMP反应元件结合蛋白(cAMP response element bindingprotein,CREB)对癫痫发生及持续状态的调节作用可能与has-let-7b-3p有关;CREB可通过磷酸化转为活性结构,进而启动多种基因的转录,并通过多条途径调控神经元功能,从而促进神经元兴奋、发育和重塑[13-16]。本研究结果显示,病例组has-let-7b-3p表达水平低于对照组,提示has-let-7b-3p在特发性癫痫患者中表达下调,且其可能在特发性癫痫的发病机制中发挥作用。has-miR-92a-1-5p是脑特异性miRNA,其可参与N-甲基-D-天冬氨酸谷氨酸受体信号传导,调控哺乳动物脑源性神经营养因子及其酪氨酸激酶的表达水平,从而影响大脑功能[17-18]。本研究结果显示,病例组hsa-miR-92a-1-5p表达水平低于对照组,其原因尚不清楚,需要进一步研究分析。一项基因分型分析研究指出,miR-6810-3p可能参与突触信号发生及传导、神经元分化及投射过程,且其与黄斑变性及神经退行性疾病直接相关[19]。
本研究结果显示,病例组hsa-miR-6810-3p表达水平高于对照组,提示hsa-miR-6810-3p表达水平升高可能与特发性癫痫有关,其有可能作为特发性癫痫的生物标志物。本研究结果还显示,两组hsa-let-7f-1-3p、hsa-miR-219a-2-3p表达水平比较,差异无统计学意义,分析原因可能与受试者的个体差异和本研究样本量较小等因素有关,后期需设计同质化的前瞻性研究以进一步评估hsa-let-7f-1-3p、hsa-miR-219a-2-3p在特发性癫痫中的意义。
综上所述,与健康人相比,特发性癫痫患者外周血共有98个miRNA表达上调,48个miRNA表达下调;其中差异倍数最大的5个差异表达miRNA分别为hsa-let-7b-3p、hsa-let-7f-1-3p、hsa-miR-92a-1-5p、hsa-miR-219a-2-3p、hsa-miR-6810-3p,且可能只有hsa-let-7b-3p、hsa-miR-92a-1-5p、hsa-miR-6810-3p参与了特发性癫痫的发生发展。但本研究在发现差异表达miRNA后,并未做针对性的小鼠敲低实验,不能提供其调控机制的完整证据链,期待后续研究增加基础实验以进一步深入探讨。
作者贡献:仲婷进行文章的构思与设计、文章的可行性分析、文献/资料收集,撰写论文;仲婷、景燕、陆明佳进行论文的修订;党辉、李红燕负责文章的质量控制和审校;李红燕对文章整体负责,监督管理。
本文无利益冲突。

