PLGA-姜黄素纳米颗粒的制备及体外抗炎性能评价
李 真, 郝 凯, 贺超良, 田华雨,4
(1. 中国科学院长春应用化学研究所生态环境高分子材料重点实验室, 长春 130022;2. 中国科学技术大学应用化学与工程学院, 合肥 230026;3. 厦门大学化学化工学院, 固体表面物理化学国家重点实验室, 厦门 361005;4. 福建省能源材料科学与技术创新实验室(IKKEM), 厦门 361005)
姜黄素(Cur)是一种在姜科植物中含量较高的多酚类物质, 是姜黄的主要成分[1]. 姜黄素的来源广泛, 不良反应小, 价格低廉[2], 且经研究证实其具有多种药理作用, 包括对肿瘤的抑制作用、 抗氧化作用、 抗炎作用和免疫调节作用[3]. 姜黄素可通过调节核转录因子-κB(NF-κB)信号通路抑制氧化反应,阻碍炎症细胞因子、 肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的分泌, 从而发挥抗炎作用[4,5]. 但因其亲脂性强[6]、 水溶性和稳定性差, 难以被细胞摄取和吸收, 不利于药物发挥作用, 从而极大地限制了其生物利用[7]. 目前, 一些以脂质体、 微球和聚合物胶束为载体的新型姜黄素制剂已被开发, 用于提高其分散性和稳定性[8]. 聚乳酸-羟基乙酸共聚物(PLGA)是一种生物相容性良好的材料, 已被美国食品药品监督管理局(FDA)批准用于临床治疗[9]. PLGA具有良好的药物包封效果和优良的成膜性能, 在药物递送领域获得了广泛的应用. 研究结果表明, PLGA可将药物分子封装在其形成的纳米颗粒中, 在保留药物活性的同时能够起到药物缓释的效果[10~13].
本文通过双乳液法制备了一种具有较高Cur载药率的PLGA@Cur纳米颗粒(PLGA@Cur NPs), 显著改善了Cur在水中的分散性和水溶性, 并对其抗氧化性和抗炎性进行了详细的表征. 结果表明, 在细胞水平上, PLGA@Cur NPs可有效清除细胞内的活性氧(ROS), 降低促炎细胞因子含量, 缓解细胞水平的炎症. 该纳米药物递送系统的开发为Cur用于炎症疾病的治疗奠定了基础, 为提高姜黄素的生物利用度提供了新的思路.
1 实验部分
1.1 试剂与仪器
PLGA(货号P133293)、 姜黄素(货号C400222)、 聚乙烯醇(PVA, 货号P139537)、 黄嘌呤氧化酶、黄嘌呤、 二氢乙锭和2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH), 分析纯, 上海阿拉丁生化科技股份有限公司; 二氯甲烷、 无水乙醇和过氧化氢, 分析纯, 上海沪试实验室器材股份有限公司; 无水硫酸铜, 分析纯, 北京伊诺凯科技有限公司; 甲醇(HPLC级)和3,3',5,5'-四甲基联苯胺(TMB, 分析纯), 北京百灵威科技有限公司; 冰乙酸(HPLC级)和叔丁基过氧化氢溶液(TBHP, 分析纯), 上海麦克林生化科技有限公司; RAW 264.7, 美国ATCC公司; 胎牛血清、 磷酸盐缓冲液(PBS)和细胞培养基(DMEM),美国Gibco 公司; 活性氧测定试剂盒, 上海碧云天生物技术有限公司; TNF-αELISA 试剂盒, 美国Thermo Fisher Scientific 公司; CCK-8测定试剂盒, 大连美伦生物技术有限公司; CpG核酸, 上海生工生物工程有限公司, 其意义链序列为TCGTCGTTTCGGCGCGCCGCCCACAUAAAAAACAGUUG.
UltiMate3000型超高效液相色谱仪(HPLC), 美国戴安公司; Zeiss GeminiSEM 500型场发射扫描电子显微镜(SEM), 美国蔡司公司; H1750R 型高速离心机, 湖南湘仪离心机仪器有限公司;SB-5200DTDN型超声波细胞破碎机, 宁波新芝生物科技股份有限公司; RO15型多点磁力搅拌器, 德国IKA 公司; LAMBDA 1050+型紫外-可见-近红外分光光度计(UV-Vis-NIR), 美国PerkinElmer 公司;Varioskan LUX 型酶标仪, 美国Thermo Fisher Scientific 公司; NanoBrook 173Plus 型动态光散射粒度仪(DLS), 美国Brookhaven公司.
1.2 实验过程
1.2.1 PLGA@Cur NPs 的制备 采用双乳液法制备PLGA@Cur NPs. 将50 mg PLGA 和一定质量的Cur 溶解在1 mL 二氯甲烷中形成混合溶液, 然后缓慢加入至3 mL 5%(质量分数)PVA 水溶液中, 用100 W 超声波破碎仪超声1 min, 得到初始乳液. 将该乳液缓慢加入至50 mL 1%(质量分数)PVA 水溶液中, 用100 W超声波破碎仪超声3 min, 得到复乳液. 通过在室温下搅拌12 h除去复乳液中残留的二氯甲烷. 然后用离心机以1200 r/min 的速度离心10 min, 分离得到PLGA@Cur NPs. 用15 mL超纯水洗涤PLGA@Cur NPs 3次进行纯化.
1.2.2 PLGA@Cur NPs的表征 将PLGA@Cur NPs分散在超纯水中, 配制成约500 μg/mL的悬浊液, 采用动态光散射粒度仪(DLS)对纳米颗粒的粒径、 多分散指数(PDI)和Zeta电位进行测定[14,15]. 通过扫描电子显微镜观察纳米颗粒的形貌.
1.2.3 PLGA@Cur NPs 包封率和载药率的测定 采用双乳液法制备PLGA@Cur NPs 色谱柱:Agilent Extend-C8 4.6×250 mm, 流动相为甲醇-0.5%乙酸水溶液(体积比4∶1), 柱温35 ℃, 流速1.0 mL/min, 检测波长425 nm, 进样量10 μL.
Cur 标准曲线的绘制: 将1 mg 姜黄素溶于1 mL 甲醇中, 用流动相梯度稀释为500, 250, 125,62.5, 31.25, 17.82, 3.91和1.95 μg/mL的姜黄素标准溶液, 进行HPLC测试, 记录峰面积, 绘制标准曲线.
精确称取适量冻干后的PLGA@Cur NPs, 加入一定量的乙醇, 超声20 min, 使姜黄素充分提取至乙醇中, 取上清液经过滤后用于HPLC检测. 按下式计算姜黄素的包封率(DLE, %)和载药量(DLC, %):
式中:m(Lg)为实际装载姜黄素的质量;m(Fg)为理论投入姜黄素的质量;mN(g)为载药纳米颗粒的质量.
1.2.4 PLGA@Cur NPs的抗氧化性测试 通过硫酸铜与H2O2的芬顿(Fenton)反应制得·OH. 首先将0.1 mL Cu2(+500 μg/mL)、 0.1 mL H2O(21 mmol/L)、 0.1 mL TMB(10 mmol/L)和0.1 mL 样品(2 mg/mL)加入到0.6 mL Milli-Q水中, 室温孵育1 h, 测定氧化后TMB在混合物中的UV-Vis吸光度值. 通过观察样品在650 nm处的峰值的变化考察其对·OH的清除作用. 黄嘌呤可在黄嘌呤氧化酶的作用下产生. 将0.1 mL 黄嘌呤氧化酶(5 EU/mL)、 0.1 mL 黄嘌呤(6 mmol/L)和0.1 mL PLGA@Cur NPs(2 mg/mL, 样品组)或0.1 mL Milli-Q 水(空白组)混合在0.6 mL PBS 中, 于37 ℃孵育40 min. 然后加入0.1 mL 二氢乙锭(1 mg/mL), 混合均匀后, 转移至荧光酶标板中, 用酶标仪测定二氢乙锭氧化产物乙锭的荧光强度.的相对含量(Content of O·2-, %)按下式计算:
其中:Fs和Fb分别为处理后的样品组和空白组的荧光强度.
1.2.5 PLGA@Cur NPs 的细胞毒性测试 使用CCK-8 试剂盒评价PLGA@Cur 的细胞毒性. 将RAW 264.7 细胞在含10%的胎牛血清及100 U/mL 青霉素、 100 U/mL 链霉素的DMEM 高糖培养液中进行培养, 培养箱培养条件设定为5%(体积分数)CO2, 37 ℃. 当RAW 264.7 细胞生长到一定数量时, 以1×104cell/孔的密度接种到96 孔板中, 并在37 ℃、 含5% CO2的培养箱中黏附12 h[16~18]. 然后用不同浓度的样品处理这些细胞. 在培养24 h后, 将培养基替换为含有10% CCK-8的生长培养基, 培养1 h. 用酶标仪测量孔板中溶液在450 nm处的光强度(OD 450 nm)计算细胞活力.
1.2.6 PLGA@Cur NPs 的血液相容性测试 取1 mL新鲜小鼠血液, 以1200 r/min 的转速离心10 min分离血细胞. 用PBS洗涤离心沉淀物, 直至上清液澄清透明, 离心沉淀物为血细胞. 阳性组加入10 μL血细胞和90 μL 1% TritonX-100, 阴性组加入10 μL血细胞和90 μL PBS. 在样品组中, 加入10 μL血细胞和90 μL PLGA@Cur, 使PLGA@Cur NPs 的终浓度为100 mg/mL. 各组于室温下孵育2 h, 离心后拍照.取离心后的上清液, 测定其在450 nm处的吸光度值. 按下式计算溶血率(Hemolysis, %):
其中:As,Ap和An分别为样本组、 阳性组和阴性组的吸光度值.
1.2.7 细胞内ROS 检测 将RAW 264.7 细胞以8000 cell/孔的密度接种到96 孔板中, 并在37 ℃、 含5% CO2的培养箱中黏附12 h. 用10 μL 1 mmol/L的TBHP和10 μL 1.2 mg/mL的PLGA@Cur NPs 处理细胞24 h, 细胞用H2DCFDA染色后用PBS反复冲洗, 用荧光显微镜成像.
1.2.8 细胞因子检测 将RAW 264.7 细胞以2×104cell/孔的密度接种于96 孔板中. 将10 μL 20 μg/mL 的CpG 和12.5/15/20 μL 2 mg/mL 的PLGA@Cur NPs 加入至96 孔板中. 在37 ℃、 含5% CO2的培养箱中孵育24 h后, 用TNF-αELISA试剂盒评估培养基中TNF-α的含量.
2 结果与讨论
2.1 PLGA@Cur NPs的制备
以PLGA 和Cur 的二氯甲烷溶液为油相, PVA 水溶液为水相, 通过双乳液溶剂挥发法制备了PLGA@Cur NPs[19~21](Scheme 1). 通过控制Cur与PLGA的质量比分别为1∶25, 1∶10, 1∶5, 3∶10和2∶5,得到PLGA@Cur 1~PLGA@Cur 5, 其中PLGA的质量是固定的, 改变Cur的质量. 通过SEM观察了所制备的纳米颗粒(图1), 其形态呈均一的球形, 表面光滑, 粒径大小一致. 经动态光散射粒度仪(DLS)测定了载药纳米颗粒的Zeta电位、 粒径和PDI, 结果列于表1. 与PLGA纳米颗粒相比, PLGA@Cur NPs负电性增加; PLGA@Cur NPs保留了PLGA纳米颗粒的尺寸, 其水动力学尺寸约为300 nm, 与SEM结果相符; PLGA@Cur NPs的PDI<0.3, 具有良好的单分散性.
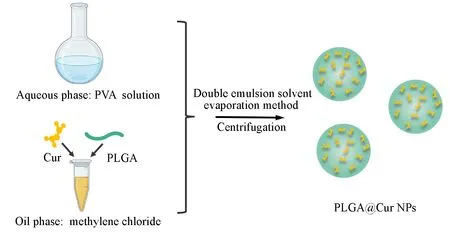
Scheme 1 Schematic for the preparation of PLGA@Cur NPs

Fig.1 SEM images of PLGA(A) and PLGA@Cur1—PLGA@Cur-5(B—F) nanoparticles

Table 1 Characteristics of different nanoparticles
2.2 包封率和载药率
通过HPLC方法[22,23]测定了所制备的系列载药纳米颗粒的Cur负载率. 由表2可见, 随着Cur含量的增加, PLGA@Cur NPs 中Cur 的DLE 增加, DLC 先增加后减少. 当Cur 与PLGA 的质量比为1∶5 时(PLGA@Cur 3), 纳米颗粒的载药率高于其它体系. 当加入的Cur过多时, 药物无法被载体包埋, 容易造成药物的损失, 使载药率下降. 当Cur与PLGA的质量比为2∶5时, 在SEM图像中观察到有姜黄素颗粒的出现, 此时载体的负载能力达到上限, 继续增加药物与载体的投料比也无法得到更高载药量的纳米颗粒. 基于药物的包封率和载药率的测定结果, 优选PLGA@Cur 3(Cur与PLGA的质量比为1∶5, 包封率为15.09%, 载药率为34.85%)用于后续的实验.

Table 2 DLE and DLC of PLGA@Cur 1—PLGA@Cur 5 nanoparticles
2.3 PLGA@Cur NPs的稳定性
纳米颗粒的稳定性对于药物的储存和运输至关重要, 通过测定纳米颗粒在PBS中的粒径变化考察了所制备PLGA@Cur NPs 的稳定性. 由图2 可见, 所制备的PLGA@Cur NPs 呈淡黄色, 均匀分散在水中. 室温下放置7 d后, PLGA@Cur NPs溶液未发生明显变化, 而经过超声分散的Cur在静置1 h后就出现了聚集, 并且下沉到样品瓶底部. DLS结果(图3)也证实PLGA@Cur NPs保留了PLGA纳米颗粒的稳定性, 粒径在7 d内没有显著变化.

Fig.2 Appearance of Cur and PLGA@Cur NPs solutions placed at different time points at room temperature
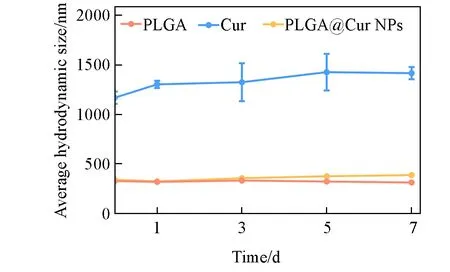
Fig.3 Hydrodynamic size of PLGA, Cur and PLGA@Cur NPs to explore the stability
2.4 PLGA@Cur NPs的抗氧化性
首先, 利用H2O2和Cu2+之间的芬顿作用产生了·OH[24,25], 当·OH 存在时可氧化·OH 的检测探针TMB生成在652 nm处有吸收峰的oxTMB(图4). 当H2O(2H), TMB(T)和Cu2+同时存在时, 652 nm处出现了明显的吸收峰. 加入PLGA@Cur NPs 后吸收峰消失, 而Cur的存在并未减少溶液中的·OH. 此外,利用黄嘌呤与黄嘌呤氧化酶的氧化作用产生, 通过测量检测探针二氢乙锭氧化产物氢乙锭的荧光强度[26,27]测定了PLGA@Cur NPs 对于O·2-的清除效率(图5). 将对照组(加入等体积的PBS)的荧光强度值定义为含量100%. 随着PLGA@Cur NPs 和Cur 浓度的增加, 溶液中的O·2-含量减少. 当PLGA@Cur NPs 浓度为200 μg/mL 时, 可以去除超过70%的, 且其清除效率强于Cur. 我们推测PLGA@Cur NPs清除·OH和的效率强于Cur的原因在于, PLGA@Cur NPs的分散性较好, 可更充分地发挥其抗氧化性, 清除溶液中的活性氧.

Fig.4 ·OH scavenging capability after different treatments

Fig.5 O·2- scavenging capability after different treatments
2.5 PLGA@Cur NPs的生物相容性
为了在细胞水平验证PLGA@Cur NPs 的性能, 首先通过CCK-8 检测了PLGA@Cur NPs 对RAW 264.7 巨噬细胞的细胞毒性. 测试结果显示(图6), 当浓度高达200 μg/mL 时, PLGA, Cur 和PLGA@Cur NPs 均不会对细胞的增殖产生影响. 此外, 还测试了PLGA@Cur NPs 的溶血性能(图7). 与阳性对照组相比, PLGA@Cur NPs并未出现溶血现象, 表明其具有良好的细胞相容性.

Fig.7 Hemolysis analysis of red blood cells(RBCs)
2.6 PLGA@Cur NPs在细胞水平的抗氧化性能和抗炎性能
验证了材料的细胞毒性后, 使用TBHP 预处理RAW 264.7 细胞, 诱导细胞产生ROS[28], 然后用PLGA@Cur NPs 处理, 以2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA)为探针评估细胞内ROS 水平. 在TBHP的刺激下, 细胞中观察到亮绿色的荧光, 表明ROS的产生(图8). 相反, PLGA@Cur NPs处理导致细胞内荧光强度明显下降, 而Cur 处理后细胞内荧光强度下降不明显. 为验证PLGA@Cur NPs 的抗炎性能, 使用免疫刺激剂CpG刺激RAW 264.7(图9). PLGA@Cur NPs 保留了Cur的抗炎性能, 使细胞中的炎症因子TNF-α恢复正常. 这些结果表明, PLGA@Cur NPs可在体外清除细胞内ROS, 缓解细胞水平的炎症.
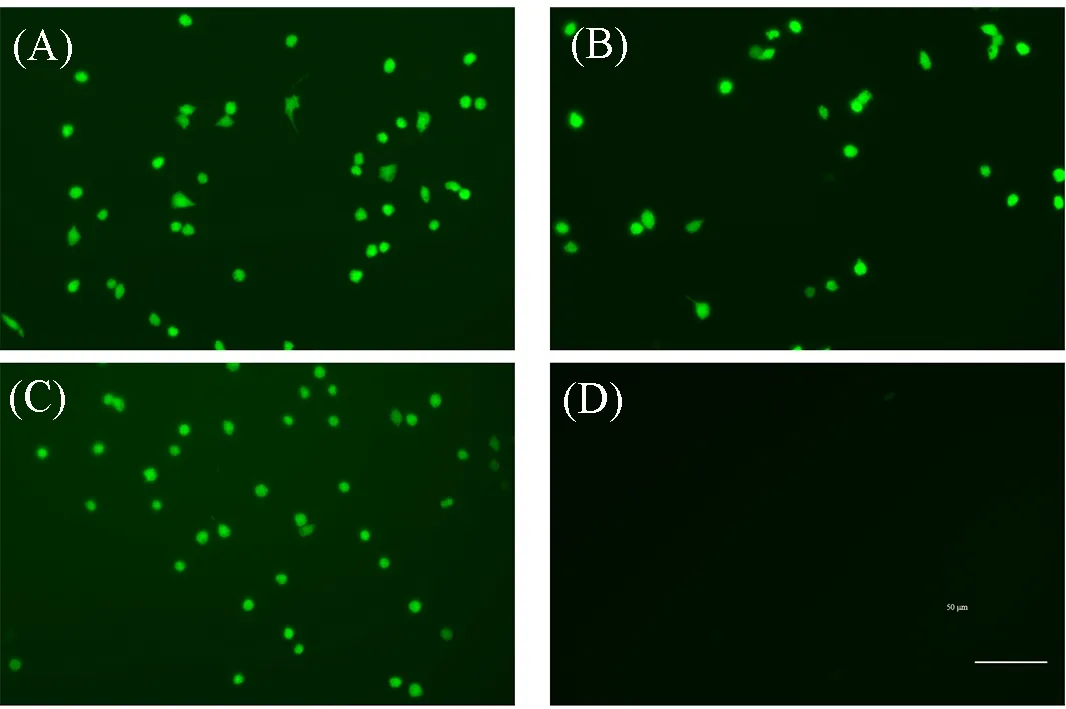
Fig.8 Intracellular ROS imaging of macrophages after different treatments

Fig.9 TNF-α cytokine generated by macrophages after different treatments for 24 h
3 结 论
通过双乳液溶剂挥发法成功制备了包载Cur的PLGA纳米颗粒PLGA@Cur NPs. 经测定, 所生成的PLGA@Cur3水动力学尺寸为340 nm, 包封率为15.09%, 载药率为34.85%. 该纳米颗粒具有良好的分散性和稳定性, 在水溶液中可稳定存在7 d. 此外, PLGA@Cur NPs还可以有效清除·OH和O·2-两种活性氧, 且清除效果强于Cur. PLGA@Cur NPs 具有良好的生物相容性, 能有效清除细胞内ROS, 具有良好的抗炎性能, 可缓解细胞水平的炎症. 可见, PLGA@Cur NPs 是一种具有优异抗氧化性和抗炎性能的药物递送系统, 其作为一种生物安全性材料有望应用于炎症疾病的治疗.

