基于肠道免疫理论分析双歧杆菌辅助治疗肺部感染所致脓毒症的应用价值
李明 苏维 马士恒
河北大学附属医院 1感染科,2检验科 (河北保定 071000)
脓毒症是由感染所引发的一系列炎性综合征,肺部感染是临床上的常见感染原因之一[1]。临床调查结果显示,脓毒症患者普遍存在肠道微生态异常,肠道是人体重要的免疫器官[2],此类患者往往同时合并有不同程度的免疫功能障碍,极易引发多器官感染与损伤,死亡率接近40%。人体肠道内定植有500 ~ 1 000 种细菌,总菌体数量可达到约1014个,这些菌群是不断变化的,在健康状态下益生菌占优势地位;在某些病理状态下,炎性反应和肠黏膜损伤的发生导致菌群移位,部分病原菌的数量增加并转为优势菌群。依靠这种菌群移位,肠道微生态可直接参与到机体的免疫调控中,故有第七大免疫系统之称[3]。另外,部分患者治疗过程中难以避免地会用到广谱抗生素,对多种菌群形成无差别打击,因此,脓毒症病理进程中,除了感染这个病原条件以外,肠道微生态受到破坏的形势也较为严峻。以此为背景,本研究在该类患者的临床治疗中使用双歧杆菌,以求纠正肠道微生态平衡与肠道免疫功能,改善患者预后,现报告如下。
1 资料与方法
1.1 一般资料 研究对象为本院2020 年10 月至2022 年7 月期间收治的143 例肺部感染所致脓毒症患者,包括男75 例,女68 例;年龄23 ~ 75 岁,平均(46.2 ± 10.6)岁。纳入标准:(1)参照《中国脓毒症/脓毒性休克急诊治疗指南(2018 版)》确诊为脓毒症;(2)由两名主治医师确定病因为肺部感染,并经后续细菌培养证实;(3)近3 个月内未使用激素或免疫调节剂;(4)自愿签署知情同意书。排除标准:(1)胃肠道疾病;(2)腹部手术史;(3)机械通气者;(4)感染前,合并免疫系统功能障碍;(5)妊娠期或哺乳期。后期剔除标准:(1)后期鉴定发现为非肺部感染诱发的脓毒症;(2)生存时间≤ 3 d;(3)依从性差或自愿退出研究。采用随机数字表将患者分为两组,两组间年龄、性别、体质量指数、病程等基线资料的差异无统计学意义(P> 0.05)。
1.2 治疗方法 所有患者均参照《中国脓毒症/脓毒症休克急诊治疗指南(2018)》予以治疗,包括早期液体复苏、纠正电解质、抗感染、营养支持等。研究组在对照组的基础上口服双歧杆菌四联活菌片(杭州远大生物制药有限公司,国药准字S20020010)。3片/次(0.5 g/片,24片/盒),每天3次,连续口服1 周。
1.3 观察指标
1.3.1 病情评分 于入院当天及治疗1 周时,评估Ⅱ版急性生理和慢性健康(acute physiology and chronic health evaluation scoring system Ⅱ,APACHEⅡ)评分与序贯器官功能衰竭(sequential organ failure assessment,SOFA)评分。其中APACHE Ⅱ由极性生理学评分、年龄评分、慢性健康状况评分三部分组成,理论最高分为71 分,分值越高病情越重。序贯器官功能衰竭(sequential organ failure assessment)评分涵盖了对循环、呼吸、肾脏、肝脏、凝血、神经6 个器官系统的功能评估,理论最高分为24 分,分值越高病情越重。
1.3.2 肠道菌群 分别于入院当天以及治疗1 周时采集粪便标本1 g,经稀释配制成菌液,进行培养基浇注与培养,37 ℃培养24 h,用天瑞基质辅助激光解析电离-飞行时间质谱仪(MALDI-TOF MS)对培养基上的不同形态菌落进行鉴定,并计算乳酸杆菌、双歧杆菌、肠球菌、大肠埃希菌及梭菌的菌落数量(CFU),结果以CFU/g 表示。
1.3.3 肠道屏障功能评估 于入院当天及治疗1 周时,进行胃肠功能障碍评分:1 分:肠鸣音减弱但未消失,肠蠕动减弱,呕血、黑便或胃引流液隐血阳性;2 分:肠鸣音近乎消失或消失,肠蠕动麻痹,呕血、黑便或胃引流液隐血阳性;3 分:肠鸣音消失,并出现应激性溃疡出血或麻痹性肠梗阻。此外采集患者空腹肘静脉血,检测血清D-乳酸、细菌内毒素水平。
1.3.4 T 淋巴细胞亚群和炎性标志物 分别于入院当天以及治疗1 周时采集空腹肘静脉血,肝素抗凝,均分为两份,一份采用密度梯度离心法分离单个核细胞,并重悬于PBS 液,经抗CD3-FITC、抗CD4-PerCP、抗CD8-PE 抗体孵育后,上机测试CD3+T、CD4+T、CD8+T 淋巴细胞计数占比。另一份3 000 r/min 离心15 min 分离血浆,采用全自动放射免疫分析仪和ELISA 试剂盒测定炎性标志物降钙素原(procalcitonin,PCT)、超敏C 反应蛋白(hypersensitive C-reactive protein,hs-CRP)和白介素6(Interleukin-6,IL-6)的血浆水平。
1.3.5 预后 以28 d 病死率作为预后的主要评估指标。
1.4 统计学方法 采用统计学软件SPSS 25.0 分析数据,连续型变量符合正态分布者用均数±标准差表示,两组间比较采用独立样本t检验,涉及多时间点测量的数据行重复测量设计的方差分析及事后LSD和SNK检验;不符合正态分布者采用M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。分类资料以百分比表示,组间比较采用分类资料采用χ2检验或者Fisher 精确检验。双侧P< 0.05 被认为有统计学意义。
2 结果
2.1 治疗前后的病情评分 治疗前,两组的APACHEⅡ与SOFA 评分差异无统计学意义(P>0.05);治疗后,两组的APACHEⅡ与SOFA 评分均有明显降低,其中研究组APACHEⅡ评分显著低于对照组(P< 0.05),SOFA 评分与对照组的差异无统计学意义(P> 0.05)。见表1。
2.2 肠道菌群 经重复测量数据的方差分析,时间因素与组别因素对乳酸杆菌、双歧杆菌、肠球菌和大肠埃希菌的含量均有影响(P< 0.05),但对梭菌的影响不明显(P> 0.05);组别因素与时间因素均不存在交互作用(P> 0.05)。组内比较结果显示,治疗后,两组的梭菌水平变化不明显(P> 0.05),但乳酸杆菌、双歧杆菌含量显著升高,肠球菌与大肠埃希菌含量降低(P< 0.05)。组间比较结果显示,治疗前,两组主要肠道菌群含量差异不显著(P> 0.05);治疗后,两组梭菌与肠球菌含量差异不显著(P> 0.05),研究组乳酸杆菌、双歧杆菌含量高于对照组,大肠埃希菌含量低于对照组(P<0.05)。见表2。
表2 两组患者治疗前后肠道菌群比较Tab.2 Comparison of intestinal flora before and after treatment between the two groups ±s,CFU/g
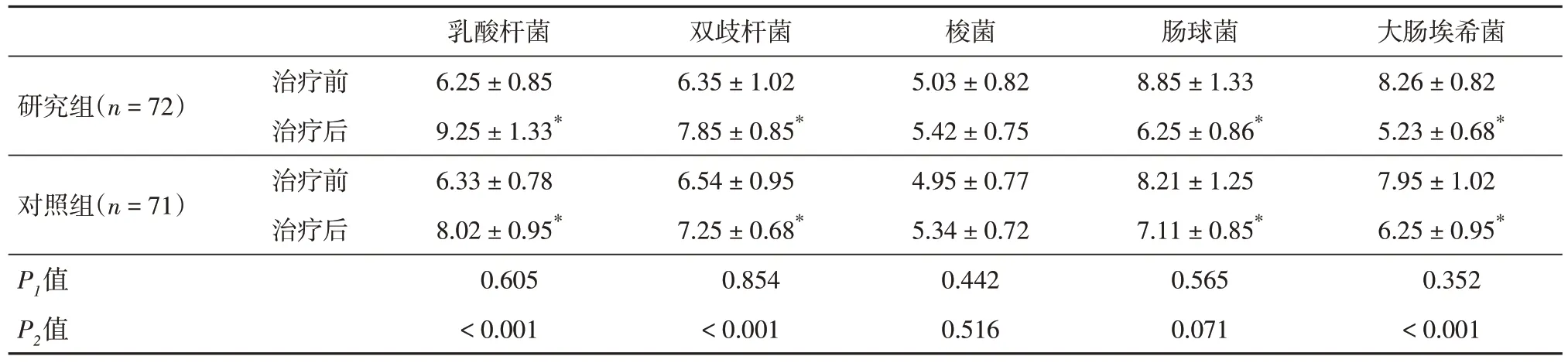
表2 两组患者治疗前后肠道菌群比较Tab.2 Comparison of intestinal flora before and after treatment between the two groups ±s,CFU/g
注:与治疗前比较,*P < 0.05;1表示治疗前研究组 vs.对照组,2表示治疗后研究组 vs.对照组
研究组(n = 72)对照组(n = 71)大肠埃希菌8.26 ± 0.82 5.23 ± 0.68*7.95 ± 1.02 6.25 ± 0.95*0.352< 0.001治疗前治疗后治疗前治疗后P1值P2值乳酸杆菌6.25 ± 0.85 9.25 ± 1.33*6.33 ± 0.78 8.02 ± 0.95*0.605< 0.001双歧杆菌6.35 ± 1.02 7.85 ± 0.85*6.54 ± 0.95 7.25 ± 0.68*0.854< 0.001梭菌5.03 ± 0.82 5.42 ± 0.75 4.95 ± 0.77 5.34 ± 0.72 0.442 0.516肠球菌8.85 ± 1.33 6.25 ± 0.86*8.21 ± 1.25 7.11 ± 0.85*0.565 0.071
2.3 肠道功能 治疗前,两组的肠道功能评分、D-乳酸、内毒素水平差异均无统计学意义(P>0.05);治疗后,两组的肠道功能评分、D-乳酸、内毒素水平均显著降低(P< 0.05),其中研究组D-乳酸与内毒素水平低于对照组(P< 0.05),肠道功能评分与对照组差异不显著(P> 0.05)。见表3。
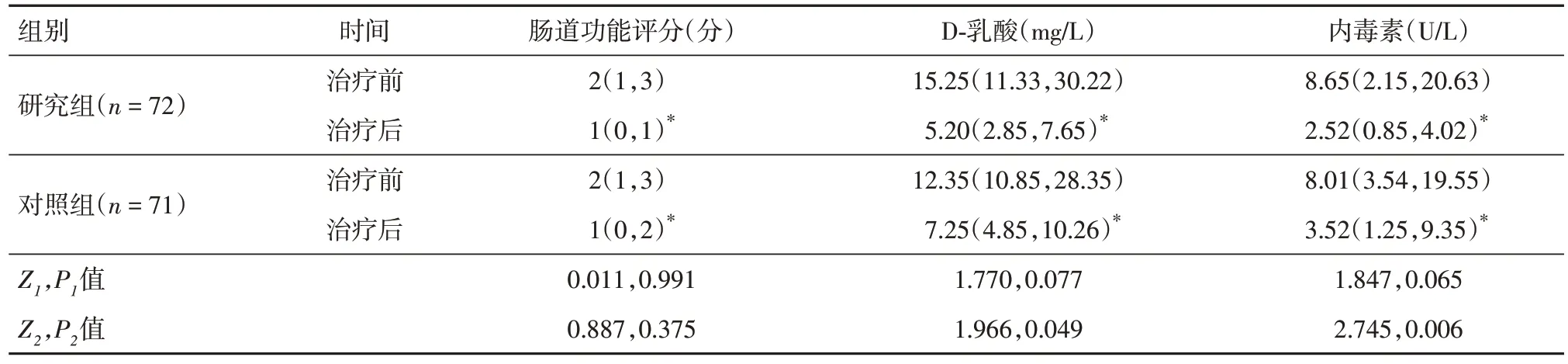
表3 两组患者治疗前后肠道功能比较Tab.3 Comparison of intestinal function before and after treatment between the two groups M(P25,P75)
2.4 T 淋巴细胞亚群和炎性因子 经重复测量数据的方差分析,时间因素与组别因素对CD4+T%、CD8+T%影响不显著(P> 0.05),对CD3+T%、hs-CRP、IL-6、PCT 水平有显著影响(P< 0.05),组别因素与时间因素不存在交互作用(P> 0.05)。组内比较结果显示,治疗后,两组CD4+T%水平有所升高,hs-CRP、IL-6、PCT 水平有所降低(P< 0.05)。组间比较结果显示,治疗前,两组T 淋巴细胞亚群和炎性因子水平差异不显著(P> 0.05);治疗后,两组PCT 水平差异不显著(P> 0.05),研究组CD3+T%水平高于对照组,hs-CRP、IL-6 水平低于对照组(P<0.05)。见表4。
表4 两组患者治疗前后T 淋巴细胞亚群和炎性因子比较Tab.4 Comparison of T-lymphocyte subsets and inflammatory factors before and after treatment between the two groups ±s

表4 两组患者治疗前后T 淋巴细胞亚群和炎性因子比较Tab.4 Comparison of T-lymphocyte subsets and inflammatory factors before and after treatment between the two groups ±s
注:与治疗前比较,*P<0.05;1表示治疗前研究组 vs.对照组,2表示治疗后研究组 vs.对照组
组别研究组(n = 72)对照组(n = 71)P1值P2值PCT(ng/mL)10.6 ± 2.9 2.9 ± 1.3*11.4 ± 3.2 3.3 ± 1.7*0.695 0.116治疗前治疗后治疗前治疗后----CD3+T(%)55.3 ± 13.5 61.7 ± 10.3*53.5 ± 15.6 57.8 ± 12.2*0.445 0.042 CD4+T(%)33.3 ± 8.7 36.6 ± 9.5 31.2 ± 9.3 34.9 ± 7.5 0.151 0.226 CD8+T(%)17.6 ± 4.2 19.3 ± 4.4 18.3 ± 3.8 20.6 ± 5.2 0.284 0.096 hs-CRP(g/L)23.5 ± 6.2 7.3 ± 2.0*24.7 ± 7.6 13.5 ± 4.2*0.284< 0.001 IL-6(pg/mL)302.5 ± 86.2 85.6 ± 21.3*288.6 ± 75.3 103.3 ± 25.3*0.115<0.001
2.5 预后 研究组与对照组患者28 d 死亡率分别为20.8%(15/72)和29.6%(21/71),两组间的差异无统计学意义(χ2= 1.451,P= 0.238)。
3 讨论
人体的肠道屏障功能包括由上皮细胞紧密相连构成的物理屏障功能以及由免疫细胞、免疫因子及微生态系统构成的化学屏障作用[4]。在脓毒症发生时,循环系统内的内毒素很容易穿过肠道屏障引发菌群移位、微生态失衡、肠道黏膜炎性损伤和通透性改变,由于肠道同时是人体重要的免疫器官和最大的营养吸收器官[5],其损伤很容易引发腹泻、代谢障碍、电解质紊乱、低白蛋白血症等一系列连锁反应,甚至导致多器官损伤与休克[6]。正因如此,有学者[7-8]建议对于脓毒症患者,应积极纠正肠道微生态环境,以改善患者预后。肺部感染所致脓毒症的原发部位虽然在肺部,但相当一部分患者也伴随有胃肠功能障碍[9],本研究推测借助益生菌及时纠正肠道微生态平衡对肺部感染所致脓毒症患者的临床治疗可能存在帮助,并从菌群分布、免疫功能、肠道屏障功能及患者治疗结局等方面综合分析了其应用价值。
本研究结果显示,两组在治疗后APACHEⅡ与SOFA 评分均有降低,且研究组APACHEⅡ评分低于对照组,说明两组病情均得到了一定程度的改善,且研究组可能优于对照组。肠道菌群分析结果显示,两组在治疗后乳酸杆菌、双歧杆菌含量有所升高,肠球菌与大肠埃希菌含量降低,且研究组乳酸杆菌、双歧杆菌含量高于对照组,大肠埃希菌含量低于对照组。肠道固有菌群可以粗略地分为生理性细菌及条件致病菌两大类,生理性细菌主要是指双歧杆菌、乳酸杆菌等益生菌,条件致病菌主要指肠杆菌、肠球菌、大肠埃希菌等兼性需氧菌[10-11]。既往研究[12]指出,脓毒症发生时肠道很容易发生微生态坍塌现象,表现为菌群的种类减少,条件致病菌数量增多,并形成优势群体,取代生理性细菌的主导地位。从本研究结果来看,两组治疗后条件致病菌数量减少,同时益生菌数量增多,说明两种治疗方式均能改善机体的肠道微生态结构。值得一提的是,对照组并未补充外源性的益生菌,患者肠道的菌群分布状态也得到了改善,这说明随着脓毒症病情的缓解,肠道菌群也受到了影响,脓毒症病理生理与肠道菌群的作用极有可能是双向的。
此外,本研究还发现治疗前,两组D-乳酸、内毒素水平差异不显著;治疗后均显著降低,且研究组低于对照组;同时,治疗前两组炎性因子hs-CRP、IL-6 水平差异也不显著,治疗后均有所降低,且研究组低于对照组。D-乳酸、内毒素主要用于衡量肠道屏障功能,因D-乳酸是细菌发酵的代谢产物[13],内毒素则产生于肠道致病菌,在肠道屏障功能正常时,两者均主要存在于肠道内,只有肠道屏障功能受损时才可能透过肠黏膜进入血液循环[14]。hs-CRP、IL-6 是经典的炎性标志物,主要用于衡量全身的炎性反应状态[15-16]。本研究结果说明两组在治疗后肠道屏障功能和炎性反应有所改善,且研究组优于对照组。关于益生菌改善肠道屏障功能,抑制炎性反应的报道已有较多,如学者王熙等[17]在脓毒症休克的临床治疗中加用益生菌,患者肠道功能和营养状态得到了明显改善;学者马磊等[18]采用益生菌及丙氨酰谷氨酰,有效降低了脓毒症患者肠道内毒素及C 反应蛋白、IL-6、IL-1β 等炎性介质的水平,促进了患者恢复。
此外,肠道免疫的效应部位主要包括位于上皮内基底膜上的肠上皮淋巴细胞和位于固有层的淋巴细胞,肠上皮淋巴细胞是人体内最大的淋巴细胞群,其数量相当于40% ~ 50%的外周淋巴细胞总数,在必要时可弥补循环免疫细胞的数量与功能。因此,肠道屏障与肠道免疫功能也能从很大程度上影响到人体的淋巴细胞总数。本研究发现两组患者在治疗后CD3+T 淋巴细胞的水平得到明显提高,且研究组高于对照组,这说明益生菌的应用对提高患者的T 淋巴细胞水平,改善细胞免疫功能可能存在帮助。在感染时,致病菌释放的内毒素与脂多糖可与宿主的免疫细胞表面受体结合,引起多种致炎因子的过度释放和免疫细胞的凋亡,因此脓毒症患者常常存在免疫细胞过度消耗和数量减少的情况,这种消耗将进一步削弱机体抗病原菌免疫功能,不利于病情恢复[19-20]。本研究结果说明适当补充益生菌对保护宿主的淋巴细胞,提高免疫功能也是有益的。
综上所述,本研究数据说明在肺部感染所致脓毒症的临床治疗中加用双歧杆菌,可从一定程度上改善肠道菌群分布,并缓解炎症带来的肠道屏障功能损伤,对促进患者修复可能有一定帮助。然而,由于本研究病例数较少,研究数据可能受到个体差异的影响发生一定的偏倚,在未来的研究中,还需要扩大样本量进一步进行验证;加之双歧杆菌用药时间和观察时间不长,本研究只能了解到短期用药对患者肠道屏障功能和肠道免疫带来的影响,长期用药的作用与安全性尚不明确,也需要进一步探讨。
【Author contributions】LI Ming designed the study and wrote the article; SU Wei performed the experiments,collected date,statistica analysis and wrote the article; MA Shiheng supervised and directed the research,instructed the papers revision.All authors read and approved the final manuscript as submitted.

