肺炎衣原体IgG抗体检测试剂国家参考品的研制和建立
赵兰青,沈舒,邓明镜,周海卫,许四宏
·技术与方法·
肺炎衣原体IgG抗体检测试剂国家参考品的研制和建立
赵兰青,沈舒,邓明镜,周海卫,许四宏
100050 北京,中国食品药品检定研究院传染病诊断二室/国家药品监督管理局体外诊断试剂质量研究与评价重点实验室(赵兰青、沈舒、周海卫、许四宏);100091 北京大学生命科学学院(邓明镜)
肺炎衣原体(chlamydia pneumonia,CP)属革兰氏阴性菌、衣原体目[1],是寄生在真核细胞内、以人为自然宿主的非典型病原体。1965 年,从一名儿童眼结膜中分离出一株新的衣原体[2],并在 1989 年命名为肺炎衣原体,是继沙眼衣原体和鹦鹉热衣原体后的第三个衣原体[3]。肺炎衣原体主要通过气溶胶在人群中传播,是急性呼吸道感染[4-6]、儿童社区获得性肺炎[7]的主要病原体之一,可引起肺炎、支气管炎及咽炎等呼吸道疾病[8],也与急性冠状动脉综合征、中枢神经系统感染、多发性硬化症和慢性炎性疾病等多种疾病相关[9-13],严重时可造成多器官损伤。根据 NCBI 数据库,肺炎衣原体基因组长度约为 1.2 Mb,编码基因约为 1090 个,编码蛋白约 1040 个,抗原决定簇主要分布在外膜蛋白上。
肺炎衣原体的诊断方法主要有细胞分离培养、免疫学检测、分子生物学检测,其中血清肺炎衣原体 IgM 和 IgG 抗体的检测在实验室诊断中具有重要的作用。本研究旨在建立一套肺炎衣原体 IgG 检测试剂国家参考盘并用于我国相关试剂盒的质量评价。到 2023 年 6 月,已经有 3 家酶联免疫法和 1 家化学发光法肺炎衣原体 IgG 抗体检测试剂获得了注册证,并有多家用于科研的诊断试剂。本文在我科室之前研究的基础上,通过样本筛选、复核、确认和协作标定,建立了适用于酶联免疫法和化学发光法的肺炎衣原体国家参考品,为该类诊断试剂提供了统一的尺度,对试剂盒的注册和上市后监管提供科学有力的保证。
1 材料与方法
1.1 材料
1.1.1 样本 血浆原料来自于山西康宝生物制品股份有限公司、深圳市卫光生物制品股份有限公司和华兰生物工程股份有限公司,共 675 份,均为血浆站报废的血浆。
1.1.2 试剂盒 肺炎衣原体 IgG 抗体检测试剂盒,包括4 种酶联免疫法,分别为以色列萨卫亚公司、欧蒙医学诊断有限公司、北京贝尔生物工程股份有限公司和珠海丽珠试剂股份有限公司产品;4 种化学发光法,分别为深圳市亚辉龙生物科技股份有限公司、迈克生物股份有限公司、深圳市新产业生物医学工程股份有限公司和安图生物工程股份有限公司产品;1 种胶体金法,为青岛汉唐生物科技有限公司产品。
1.2 方法
1.2.1 样本初筛、复核及确认 收集 675 份血浆样本,血浆经过离心、无菌纱布过滤后分装成大样及若干小样,每次检测使用 1 支小样,大样放置于–20 ℃保存。所有肺炎衣原体 IgG 抗体试剂的检测方法及结果判定均严格按照试剂盒的说明书进行。初筛使用以色列萨卫亚公司的试剂盒,复核使用北京贝尔生物工程股份有限公司和欧蒙医学诊断有限公司的试剂盒,复核后的样本使用青岛汉唐生物科技有限公司胶体金法试剂进行确认。参考品组成设定为:10 份阴性参考品、10 份阳性参考品、1 份重复性参考品和 5 份最低检测限参考品。
1.2.2 协作标定 将 26 份拟组盘参考品以发盲样的方式送至 7 家公司进行协作标定,以确定样本选择的科学性和考核指标的合理性。
1.2.3 均匀性研究 参照国家计量技术规范中有关均匀性检验的要求,随机选择 2 份阳性参考品、2 份阴性参考品、1 份重复性参考品和 1 份最低检测限参考品,每份均抽取各 10 瓶(抽样分布:前段 3 瓶、中段 4 瓶、后段3 瓶),使用北京贝尔生物工程股份有限公司的试剂检测450/630 nm,计算分装变异系数。
1.2.4 稳定性研究 模拟用户使用和储存的条件,使用欧蒙医学诊断有限公司的试剂检测稳定性。随机抽取一套参考品,在 2 ~ 8 ℃冰箱放置,于 0、7、14、21 和 28 d 取出并测试全部性能,并将 7 ~ 28 d 的结果与 0 d 对比。另随机再抽取一套参考品反复冻融 4 次,每次完全融化后测试 1 次,然后放回至–20 ℃条件,将结果与 0 d 对比。实验数据使用 GraphPad Prism 6.0 统计结果并进行检验分析。
2 结果
2.1 样本初筛、复核和确证
使用酶联免疫法、胶体金两种方法学对原料样本进行初筛、复核和确证,其中酶联免疫法使用 3 个厂家的试剂盒。第一轮实验使用以色列萨卫亚公司的 ELISA 试剂盒对675 份样本进行初筛,根据样本检测浓度在 cut-off 值上、下的分布情况,确定 13 份阴性血浆和 26 份阳性血浆作为候选原料。第二轮实验使用北京贝尔生物工程股份有限公司和欧蒙医学诊断有限公司的 ELISA 试剂盒对 39 份样本进行复核。第三轮实验使用青岛汉唐生物科技有限公司胶体金法试剂进行确证。
为了更充分、更全面评价该类诊断试剂临近 cut-off 值水平附近的检测能力,拟组盘的样本考虑纳入弱阳性样本及临近 cut-off 值的阴性样本。根据 4 家试剂的检测结果,弱阳性样本定为至少 1 家检测为灰区(±)或者 cut-off 值吸光度值 ±10%、其他为阳性的样本,接近 cut-off 值的阴性样本定为至少 1 家检测为灰区(±)或者 cut-off 值吸光度值 ±10%、其他为阴性的样本。
经过三轮实验,确定 4 家共同阳性的样本 21 份、共同阴性的样本 10 份,并筛选出弱阳性样本 5 份和临近 cut-off 值的阴性样本 2 份,详细结果见表1。
注:阴阳性判定规则,以色列萨卫亚:阴性(吸光度值)< 0.22,0.22 ≤灰区(吸光度值)< 0.26,阳性(吸光度值)≥ 0.26;北京贝尔:阴性 < 16 RU/ml,16 ≤灰区 < 22 RU/ml,阳性≥ 22 RU/ml;欧蒙诊断:阳性(吸光度值)≥ 0.15,阴性(吸光度值)< 0.15;青岛汉唐:在自然光下目视判读 C 线及 T 线确定阴阳性。
2.2 国家参考品的组成
考虑到国家参考盘在 cut-off 值上、下的强弱分布情况,阳性参考品应纳入弱阳性样本,阴性参考品应纳入临近 cut-off 值的阴性样本,所以参考品组成如下:10 支阳性参考品由强阳性(M003、M005、M006)、中阳(3、7、S001、S002)、临界阳性(S003、S004、303)三个浓度区间或吸光度值区间的血浆组成 P01 ~ P10。10 支阴性参考品由(A1 ~ A10)组成阴性参考品 N01 ~ N10,其中 A10 为临界阴性的样本。取 1 份阳性血浆(R2)作为重复性参考品 R。另取 1 份阳性血浆(H001),使用经过确认阴性血浆(A1)进行梯度稀释组成最低检测限参考品 L01 ~ L05,其中原液、1:2、1:4、1:8 稀释分别作为 L01 ~ L04,阴性血浆作为 L05。
2.3 协作标定及考核指标
国家参考品经分装贴签后组盘,邀请 7 个厂家(厂家 A、B、C 为酶联免疫法,厂家 D、E、F、G 为化学发光法)进行协作标定。根据实验结果,10 份阴性参考品除厂家 A 检出9 份阴性外(9/10),其余厂家检出结果均为阴性(10/10)。10 份阳性参考品除厂家 G 检出 9 份阳性(9/10),其余厂家检出结果均为阳性(10/10)。最低检测限参考品除厂家 A 和厂家 C 检出为 L01 ~ L03 阳性、L04 ~ L05 阴性,其余厂家为 L01 ~ L04 阳性、L05 阴性。重复性参考品各个厂家检测 10 次均为阳性,CV 在 2.0% ~ 7.7% 之间。
根据企业的协作标定结果,制订本参考品的质量标准为:阴性符合率应至少为 9/10;阳性符合率应至少为 9/10;最低检测限参考品 L01 ~ L03 应为阳性,L04 可为阳性或阴性,L05 应为阴性;重复性参考品平行检测 10 次,应均为阳性,且 CV 不大于 10.0%。
2.4 均匀性研究
随机选择 2 支阴性参考品(N05、N07)、2 支阳性参考品(P07、P09)、1 支最低检测限参考品(L01)和重复性参考品 R,每份随机抽取各 10 瓶(抽样分布:前段3 瓶、中段 4 瓶、后段 3 瓶)检测一次,并计算 CV 值。阳性参考品、重复性参考品、最低检测参考品的 10 次检验结果均为阳性,且 CV 值均< 10.0%,阴性参考品的检测均为阴性,符合要求,表明本参考盘均匀性良好(表2)。
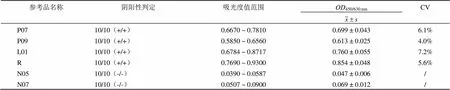
表2 6 支参考品均匀性验证
2.5 稳定性研究
2.5.1 2 ~ 8 ℃稳定性 随机抽取 1 套参考品,在 2 ~8 ℃保存,于 7、14、21 和 28 d 分别取出测试全部性能,记录结果并与 0 d 相比,7 ~ 28 d 所有参考品的阴阳性判定、浓度值无显著性差异,使用检验进行方差分析,>0.05,证明参考品在2 ~ 8 ℃保存至少4 周稳定性良好(图1A)。
2.5.2 反复冻融稳定性 随机抽取 1 套参考品进行反复冻融测试,冻融 1 ~ 4次与 0 次相比,全部参考品的阴阳性判定结果和浓度值无显著的变化,经过检验进行方差分析,> 0.05,证明参考品冻融 4 次之内稳定性良好(图1B)。
3 讨论
研究表明,肺炎衣原体是社区获得性肺炎等非典型呼吸道传染病最常见的病原微生物之一。在我国广东、湖南和浙江等地的儿童 CP-IgG 抗体阳性率为13% ~ 25%[14-22],而在健康成人血液中 CP-IgG 的阳性率超过 50%[23]。临床或科研用途的 CP-IgG 检测试剂盒已经在我国广泛应用;本研究旨在通过建立一套肺炎衣原体国家参考品,为我国 CP-IgG 检测试剂盒统一评价尺度,尤其是为待申报注册的试剂盒提供更清晰、更规范的质量标准。样本筛选阶段,使用多家试剂盒对血浆样本进行检测,在尽量选择检测结果一致样本的基础上,兼顾各试剂盒检测浓度值高低;在选择阳性参考品时,充分考虑其值或浓度值在阳性区间的分布,使参考盘覆盖强阳性、中阳和弱阳范围;在选择阴性参考品时,同样包含在 cut-off 值下的各浓度阴性血浆,以便能更充分地评价试剂盒的特异性。选择一份浓度较高的样本以阴性血浆倍比稀释成最低检测限参考品,从不同稀释度评价试剂盒的灵敏度。之后对参考品进行了均匀性和稳定性验证,均满足性能要求。
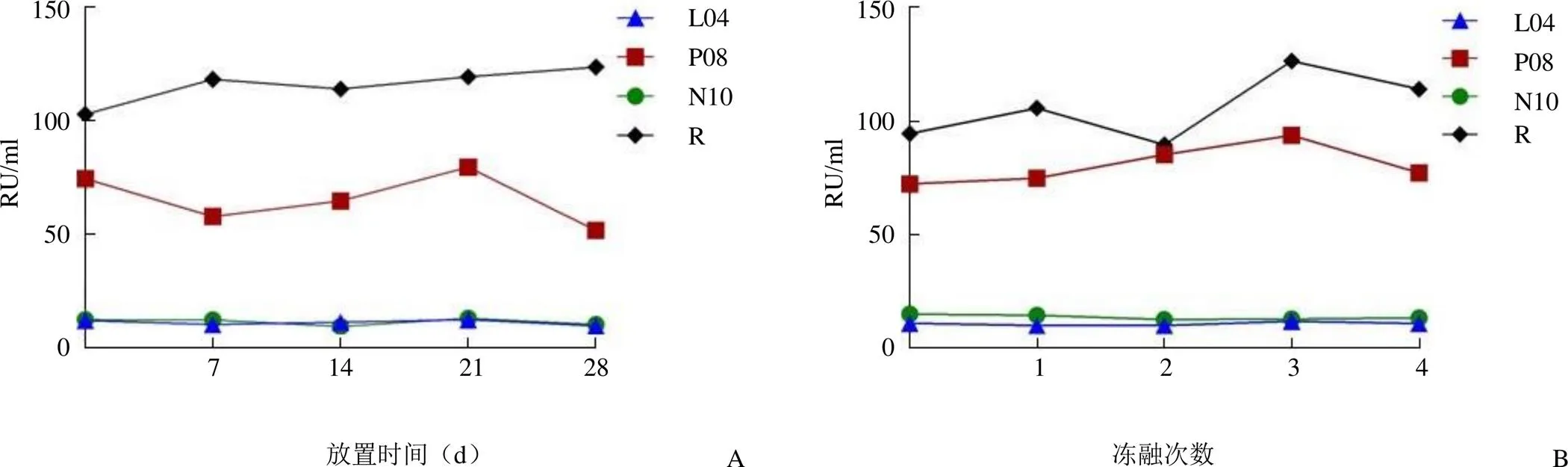
图1 4 份参考品于 2 ~ 8 ℃放置不同时间(A)和反复冻融 4 次(B)的稳定性分析
肺炎衣原体的血清抗原特异性主要由外膜蛋白决定,研究一般使用重组蛋白或者全菌抗原[8, 24],也有部分研究使用衣原体蛋白酶样活性因子(CPAF)、脂多糖(LPS)、热休克蛋白 60(HSP60)与外膜蛋白共同作为包被抗原检验[25]。感染肺炎衣原体后,血液中 IgG 抗体一般在发病后 1 个月内逐渐升高,3 个月后达到平稳状态;IgM 抗体出现较早,发病2 ~ 3 周后出现,并在 4 ~ 5 周达到高峰,3 ~ 5 个月后降低至无法测出[26]。在临床上,CP IgM 抗体检测对于急性呼吸道感染、社区获得性肺炎等疾病更具有价值和意义,但阳性率较低,在我国的北京、广州地区阳性率为0.8% ~ 13.7%[27-30];而肺炎衣原体 IgG 抗体检测对于慢性疾病,如风湿病、多发性硬化和阿尔茨海默病等也有重要意义[31-33]。
肺炎衣原体抗体检测常用方法有免疫荧光法、胶体金法、酶联免疫法和化学发光法。免疫荧光法曾经被认为是诊断“金标准”,但由于耗时长、技术要求高等原因,多数医院不将其作为常规检测项目。胶体金法操作简单、成本低,但相比于酶联免疫法,有较高的假阴性率[34]。酶联免疫法广泛应用于临床筛选和科研,但因操作繁琐、耗时长,逐渐有被化学发光法取代的趋势。而化学发光法凭借灵敏度高、自动化、通量高等优点,已经成为该类诊断试剂发展的方向。本研究制备并标定了同时适用于酶联免疫法和化学发光法的肺炎衣原体 IgG 抗体国家参考品,为我国已上市和待上市的该类检测试剂提供了统一的评价尺度,有助于企业的质量控制和产品注册,也对上市后监管提供了科学的依据和保证。
[1] Kuo CC, Jackson LA, Campbell LA, et al. Chlamydia pneumoniae (TWAR). Clin Microbiol Rev, 1995, 8(4):451-461.
[2] Kuo CC, Chen HH, Wang SP, et al. Identification of a new group of Chlamydia psittaci strains called TWAR. J Clin Microbiol, 1986, 24(6):1034-1037.
[3] Grayston JT, Kuo CC, Campbell LA, et al. Chlamydia pneumoniae sp. nov. for Chlamydia sp. strain TWAR. Int J Systc Evolutionary Microbiol, 1989, 39(1):88-90.
[4] Zhang Z, Lai LQ, Guo HX, et al. Distribution characteristics of Mycoplasma pneumonia, Chlamydia pneumoniae and Legionella pneumophila in hospitalized children with acute respiratory infection in Yuexiu District, Guangzhou from 2012 to 2019. J Pract Med, 2021, 37(15):2017-2021. (in Chinese)
张宙, 赖来清, 郭惠娴, 等. 2012-2019年广州市越秀区急性呼吸道感染住院患儿肺炎支原体、肺炎衣原体及嗜肺军团菌分布特点. 实用医学杂志, 2021, 37(15):2017-2021.
[5] Zhang BW, He C, Song JH, et al. Epidemiological characteristic of pathogens of acute respiratory infectious diseases in Mentougou district of Beijing, 2017-2019. Capital J Public Health, 2021, 15(3): 151-154. (in Chinese)
张博文, 何川, 宋景红, 等. 2017-2019年北京市门头沟区急性呼吸道传染病病原体流行特征. 首都公共卫生, 2021, 15(3):151-154.
[6] Cui J, Yan W, Xie H, et al. A retrospective seroepidemiologic survey of Chlamydia pneumoniae infection in patients in Beijing between 2008 and 2017. PLoS One, 2018, 13(11):e0206995.
[7] Wang F, Li YW, Huang XL, et al. The development and application in detection kit of chlamydia and mycoplasma pneumonia in serum of clinical children. Labeled Immunoassays Clin Med, 2018, 25(5):616- 619. (in Chinese)
王菲, 李岩伟, 黄小兰, 等. 肺炎衣原体及肺炎支原体临床血清学检测试剂的研发及应用. 标记免疫分析与临床, 2018, 25(5):616-619.
[8] Hu WJ, Guo DX, Xin DL. Development of laboratory diagnosis technology of Chlamydia pneumonia. Infect Dis Inf, 2016, 29(3):180- 184. (in Chinese)
胡文娟, 郭东星, 辛德莉. 肺炎衣原体实验室诊断技术研究进展. 传染病信息, 2016, 29(3):180-184.
[9] Petyaev IM, Zigangirova NA, Petyaev AM, et al. Isolation of Chlamydia pneumoniae from serum samples of the patients with acute coronary syndrome. Int J Med Sci, 2010, 7(4):181-190.
[10] Vaĭnshenker IuI, Nuralova IV, Onishenko LS. Chlamydial infection of the central nervous system. Laboratory diagnosis and clinic and morphological features. Arkh Patol, 2014, 76(1):57-62.
[11] Khoshbayan A, Taheri F, Moghadam MT, et al. The association of Chlamydia pneumoniae infection with atherosclerosis: Review and update of in vitro and animal studies. Microb Pathog, 2021, 154: 104803.
[12] Lateef ZM, Melconian AK, Salman ED. Detection of chlamydia pneumoniae in lung tissues derived from lung tumor-bearing iraqi patients. Iraqi J Sci, 2021, 62(11):3851-3857.
[13] Cheok YY, Lee CYQ, Cheong HC, et al. Chronic inflammatory diseases at secondary sites ensuing urogenital or pulmonary Chlamydia infections. Microorganisms, 2020, 8(1):127.
[14] Qu XX, Zhou LL, Tao HQ, et al. Epidemiological analysis of SARS pathogen infection in children with respiratory tract infection in south Zhejiang area. Chin J Health Lab Technol, 2017, 27(8):1166-1167. (in Chinese)
瞿晓晓, 周莲莲, 陶洪群, 等. 浙南地区呼吸道感染患儿非典型肺炎病原体感染的流行病学分析. 中国卫生检验杂志, 2017, 27(8): 1166-1167.
[15] Rong LT, Li XL, Zhu JM, et al. Epidemiological characteristics of respiratory tract infections in preschool children aged 1-6 years in 2016-2020. China Med Eng, 2022, 30(5):64-68. (in Chinese)
荣刘涛, 李秀玲, 祝金明, 等. 2016年至2020年1~6岁儿童呼吸道感染病例流行病学特征. 中国医学工程, 2022, 30(5):64-68.
[16] Ma Y. Analysis of results of combined detection of mycoplasma pneumoniae andchlamydia pneumoniae for 174 cases of patients with community-acquired pneumonia. Capital Med, 2020, 2(1):133-134. (in Chinese)
马颖. 174 例社区获得性肺炎患者肺炎支原体, 肺炎衣原体联合检测结果分析. 首都食品与医药, 2020, 2(1):133-134.
[17] Duan XJ, Chen YP, Huang JB, et al. Distribution of Mycoplasma pneumonia, Chlamydia pneumonia and Legionella pneumophila in 100 hospitalized children with acute respiratory infection. Chin Pediatr Integr Traditional West Med, 2018, 9(6):513-515. (in Chinese)
段效军, 陈艳萍, 黄建宝, 等. 100例急性呼吸道感染住院患儿肺炎支原体、肺炎衣原体及嗜肺军团菌分布特点分析. 中国中西医结合儿科学, 2018, 9(6):513-515.
[18] Liao JY, Zhang T. Distribution characteristics of Mycoplasma pneumoniae, Chlamydia pneumoniae, and Legionella pneumophila in hospitalized children with acute respiratory tract infection: an analysis of 13198 cases. Chin J Contemp Pediatr, 2016, 18(7):607-613. (in Chinese)
廖嘉仪, 张涛. 13198例急性呼吸道感染住院患儿肺炎支原体、肺炎衣原体及嗜肺军团菌分布特点分析. 中国当代儿科杂志, 2016, 18(7):607-613.
[19] Chen J. Clinical analysis of acute respiratory pneumonia chlamydia infection in children. Contemp Med, 2015, 21(9):45-46. (in Chinese)
陈剑. 儿童急性呼吸道肺炎衣原体感染临床分析. 当代医学, 2015, 21(9):45-46.
[20] Xia HC, Peng HX, Luo XB, et al. Pathogenic investigation and clinical characteristics of community acquired pneumonia for children in Nansha district of Guangzhou. China Pract Med, 2017, 12(20):6-8. (in Chinese)
夏厚才, 彭惠轩, 罗小兵, 等. 广州市南沙区儿童社区获得性肺炎病原调查及临床特点分析. 中国实用医药, 2017, 12(20):6-8.
[21] Li J, Lin L. Clinical significance of detection of specific antibodies against mycoplasma pneumoniae and Chlamydia pneumoniae in children with respiratory tract infection. Med Inf, 2019, 32(3):96-98. (in Chinese)
李娇, 林琳. 儿童呼吸道感染者肺炎支原体及肺炎衣原体特异性抗体检测临床意义. 医学信息, 2019, 32(3):96-98.
[22] Liu H, Mao L. Uighur Chlamydia pneumoniae pneumonia clinical analysis of 108 cases. Med Forum, 2013, 17(25):3284-3286. (in Chinese)
刘虹, 毛莲. 维吾尔族肺炎衣原体肺炎108例临床分析. 基层医学论坛, 2013, 17(25):3284-3286.
[23] Yang SD, Wang HF. The serological analysis of mycoplasma pneumoniae and Chlamydia pneumoniae in 3600 cases of healthy people. Chin Foreign Med Res, 2014, 12(27):39-40, 41. (in Chinese)
杨松娣, 王海峰. 3600例健康体检者肺炎衣原体和肺炎支原体的血清学分析. 中外医学研究, 2014, 12(27):39-40, 41.
[24] Chen D, Lei L, Lu C, et al. Characterization of Pgp3, a chlamydia trachomatis plasmid-encoded immunodominant antigen. J Bacteriol, 2010, 192(22):6017-6024.
[25] Cheong HC, Lee CYQ, Cheok YY, et al. CPAF, HSP60 and MOMP antigens elicit pro-inflammatory cytokines production in the peripheral blood mononuclear cells from genital Chlamydia trachomatis-infected patients. Immunobiology, 2019, 224(1):34-41.
[26] Miyashita N, Kawai Y, Tanaka T, et al. Antibody responses of Chlamydophila pneumoniae pneumonia: Why is the diagnosis of C. pneumoniae pneumonia difficult? J Infect Chemother, 2015, 21(7): 497-501.
[27] Li JY, Wu ZY, Xu B, et al. Prevalence status of Chlamydia pneumoniae infection in 1426 adults with respiratory infections. Infect Dis Inf, 2016, 29(1):44-46. (in Chinese)
李静宜, 吴赵永, 徐波, 等. 1426例成人呼吸系统感染住院患者肺炎衣原体感染状况分析. 传染病信息, 2016, 29(1):44-46.
[28] Chen Q, Sun Y, Zhao JY, et al. Analysis of detection results of 9 respiratory pathogens IgM antibodies in 850 adult patients with respiratory pathogens tract infection. Chin Med, 2022, 57(2):160-163. (in Chinese)
陈倩, 孙宇, 赵建越, 等. 850例成人呼吸道感染患者 9 种呼吸道病原体检测结果分析. 中国医刊, 2022, 57(2):160-163.
[29] Wei TL, Li JY, Wu ZY. Infection analysis of chlamydia pneumonia in adult patients with respiratory tract infection. J Clin Exp Med, 2017, 16(16):1627-1629. (in Chinese)
魏田力, 李静宜, 吴赵永. 成人呼吸道感染患者肺炎衣原体感染分析. 临床和实验医学杂志, 2017, 16(16):1627-1629.
[30] Cheng FA. Epidemiological characteristics and detection value of chlamydia pneumoniae IgM antibody test in children with respiratory tract infection. Med Innovation China, 2021, 18(12):93-96. (in Chinese)
程福安. 肺炎衣原体IgM抗体检验在呼吸道感染患儿中的流行病学特征及其检测价值. 中国医学创新, 2021, 18(12):93-96.
[31] Chacko A, Delbaz A, Walkden H, et al. Chlamydia pneumoniae can infect the central nervous system via the olfactory and trigeminal nerves and contributes to Alzheimer’s disease risk. Sc Rep, 2022, 12(1):2759.
[32] Petrova MS, Molochkova YV, Molochkov VA, et al. Reactive arthritis in coinfection with Chlamydia trachomatis and Chlamydia pneumoniae. Russian J Skin Venereal Dis, 2023, 26(2):181-192.
[33] Marrodan M, Alessandro L, Farez MF, et al. The role of infections in multiple sclerosis. Mult Scler, 2019, 25(7):891-901.
[34] Yu TH. Analysis of the clinical effect of gold labeling method in detecting chlamydia pneumoniae antibodies. World J Complex Med, 2021, 7(4):82-84. (in Chinese)
余天会. 金标法检测肺炎衣原体抗体的临床效果分析. 世界复合医学, 2021, 7(4):82-84.
10.3969/j.issn.1673-713X.2023.05.010
许四宏,Email:xushong@nifdc.org.cn
2023-06-20

