HR-MR VWI在椎基底动脉延长扩张症管壁重构中评估作用及对脑梗死预测价值研究
肖 瑶,康志雷,耿姿慧,王心颖,管铁岗,刘 兵*
(1.河北省衡水市人民医院影像中心,河北 衡水 053000;2.河北省衡水市第四人民医院影像中心,河北 衡水 053000;3.河北省衡水市人民医院神经内科,河北 衡水 053000)
椎基底动脉延长扩张症(vertebrobasilar artery lengthening and dilation,VBD)指椎基底动脉发生明显扩张、迂曲、延长的变异性疾病,该病可致使凝血功能异常及血液流动障碍,进而导致血管受损及血栓形成,诱发脑梗死、脑出血等严重病症,且VBD早期症状较为隐匿,临床检出率较低,随椎基底动脉扩张程度加重,可形成难以逆转病变,严重影响患者生命安全[1-3]。因此,早期提高VBD检出率,针对性开展临床治疗,降低脑梗死等不良脑血管事件发生风险至关重要。近年来随着医学影像技术不断改善,VBD临床检出率有所升高,其中MR高分辨血管壁成像(high resolution magnetic resonance vascular wall imaging,HR-MR VWI)可对活体动脉管壁进行结构分析[4]。报道[5]显示,HR-MR VWI检测结果与病变部位组织学检测表现一致性较高,可通过定量分析颅内动脉粥样硬化病变血管进行病情评估。目前临床认为脑梗死发生风险与血管狭窄程度密切相关,而管壁重构模式等靶病变形态学特点也为脑血管病变重要影响因素之一,准确评估VBD管壁重构具有重要意义[6]。基于此,本研究试分析HR-MR VWI在VBD管壁重构中评估作用及对脑梗死预测价值。
1 资料与方法
1.1一般资料 选取2020年1月—2022年1月河北省衡水市人民医院收治的VBD患者200例,均行HR-MR VWI检查。以门诊或电话方式随访6个月,根据6个月内是否发生脑梗死分为发生组44例和未发生组156例。2组性别、年龄、体重指数(body mass index,BMI)、合并糖尿病、高血压、高脂血症比较差异均无统计学意义(P>0.05),具有可比性。见表1。
本研究经医院伦理委员会审核批准。
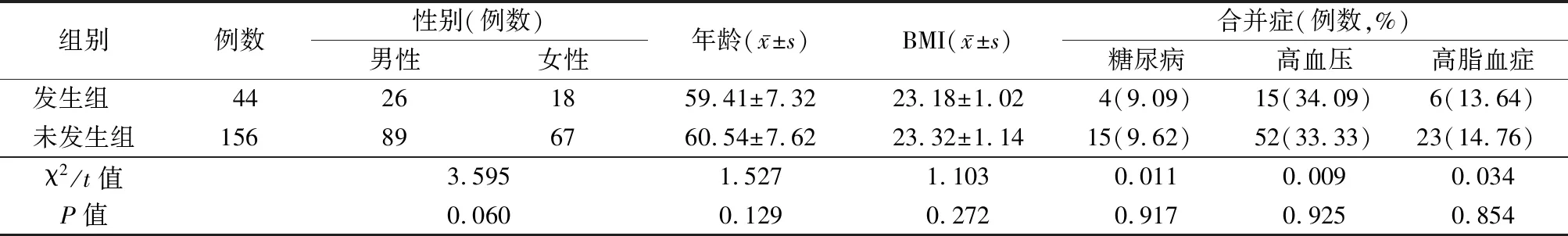
表1 2组一般资料比较
1.2纳入标准及排除标准 纳入标准:①参照Ubogu等[7]提出的VBD评估标准:经磁共振血管成像显示基底动脉总长>29.5 mm,起始点至两侧大脑后动脉分叉位置垂直连线>10.0 mm,椎动脉颅内长度>23.5 mm,以椎动脉颅内入口至基底动脉起始点连线为标准线,任一椎动脉偏离标准线距离>10.0 mm,椎动脉或基底动脉任意部位的直径>4.5 mm;②均为初次确诊;③知晓本研究,并签订知情同意书。排除标准:①合并动脉硬化型、心源型、血管炎等其他心脏疾病者;②因全身血管病变、全身遗传或代谢性疾病引起的VBD或椎动脉颅外段血管狭窄患者;③合并全身性感染者;④小脑、脑干、蛛网膜下腔因外伤出血者;⑤恶性肿瘤者;⑥精神障碍无法积极配合本研究者;⑦代谢性疾病、自身免疫性疾病者。
1.3方法 HR-MR VWI检查方法:均采用西门子3.0T超导磁共振扫描仪进行检查,选取32通道头颈部专用线圈,常规头颅平扫后行HR-MR VWI检查,扫描序列包括:给予SPACE容积扫描技术的T1WI,T1WI增强扫描。参数设置:TE=25 ms,TR=800 ms,FOV=250 mm×220 mm,层间隔=0 mm,层厚=0.7 mm,层数=144,Matrix=332×302,对比剂:0.2 mL/kg钆-喷酸葡胺。所有操作及影像评估均由同2名具有丰富经验影像学医师进行,将获取的高质量图像上传至后台工作站进行多平面重组,分别于矢状位、冠状位调整轴位层面垂直于基底动脉,获取近端参考层面、基底动脉最窄层面短轴横断面图,手动标记血管边界及基底动脉管腔,分别于近端参考层面、最窄层面测量血管腔面积及血管壁面积。
管壁重构、特点评估:血管壁面积=血管-血管腔,最窄层面斑块面积=最窄层面血管壁-参考层面血管壁,最窄层面管腔狭窄率=(1-最窄层面血管腔面积/参考层面血管腔面积)×100%,斑块负荷=(最窄层面斑块面积/最窄层面血管面积)×100%。重构指数(remodeling index,RI)=最窄层面血管面积/参考层面血管面积,≤0.95为负性重构,0.95~1.05为无重构,≥1.05为正性重构。
斑块特点评估:斑块稳定型:①无钙化,大脑动脉管壁、管腔厚度无异常;②钙化斑块,由纤维帽包裹(T1WI、T2WI呈低信号);③无钙化,血管壁增厚或偏心性小斑块,呈弥散性。
斑块不稳定型:①斑块混杂信号或大脂质核心;②斑块强化(T1WI增强扫描呈偏心性强化);③斑块内出血(T1WI增强扫描无强化,T1WI、T2WI呈高信号)。
随访方法:所有患者治疗出院后均以电话、门诊等方式进行随访6个月。随访的终点事件定义:首次发生急性脑梗死,且经影像学检查证实。
1.4观察指标 ①发生组、未发生组管壁重构情况、管壁特点、斑块特点比较。②分析管壁重构指数与最窄层面管腔狭窄率、斑块负荷关系。③分析VBD患者发生脑梗死影响因素。④分析HR-MR VWI检查参数对于VBD患者发生脑梗死的预测价值。
1.5统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用独立样本t检验,计数资料比较采用χ2检验,相关性分析采用Pearson相关系数模型,通过Logistic进行多因素回归分析,预测效能分析采用受试者工作特征(receiver operating characteristic,ROC)曲线,获取曲线下面积(area under the curve,AUC)、置信区间、敏感度、特异度及截断值。P<0.05为差异有统计学意义。
2 结 果
2.1HR-MR VWI评估VBD管壁重构作用 VBD患者200例中,92例(46.0%)为正性重构,71例(35.5%)为负性重构,37例(18.5%)无重构。各个阶段表现具体情况见图1~3。
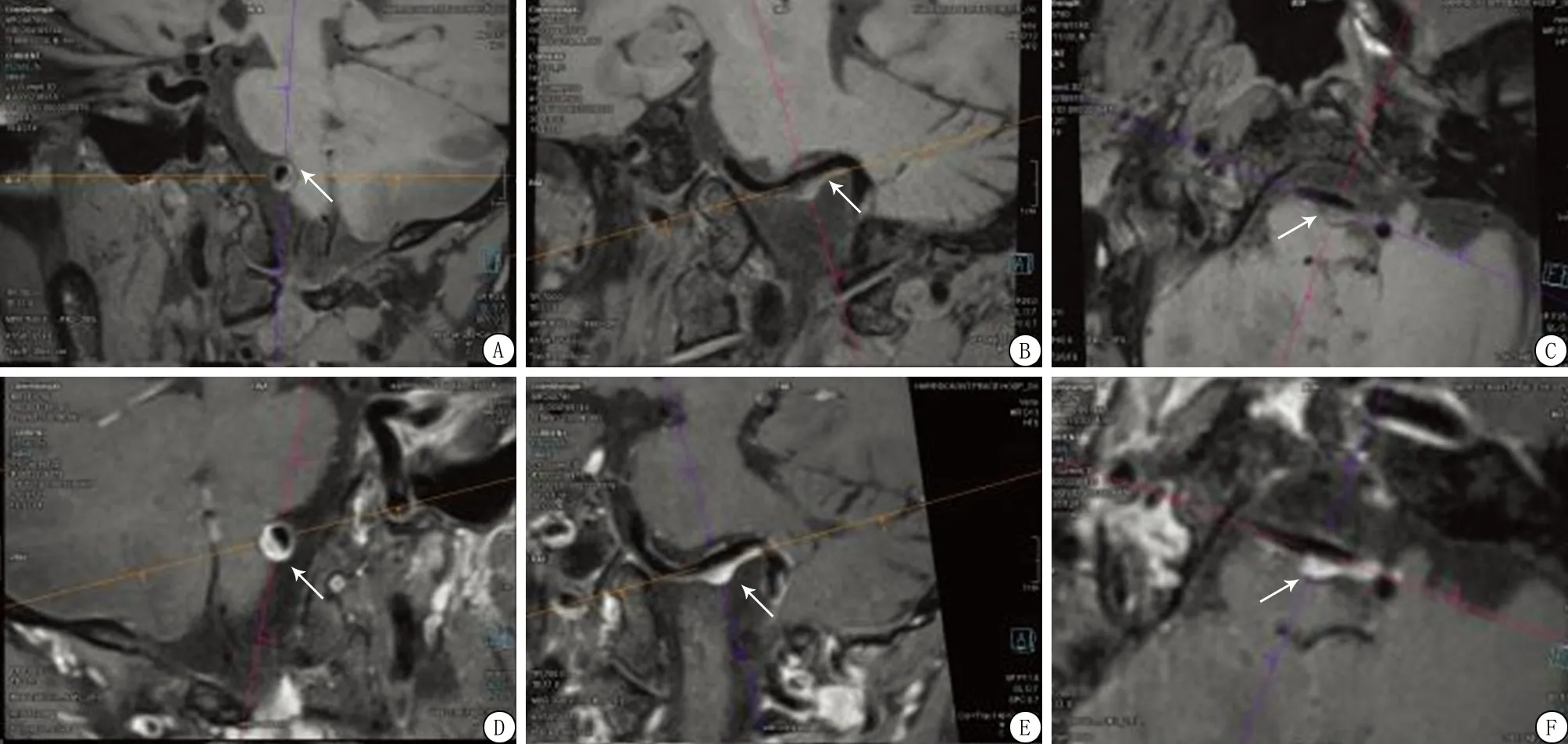
图1 正性重构HR-MR VWI图
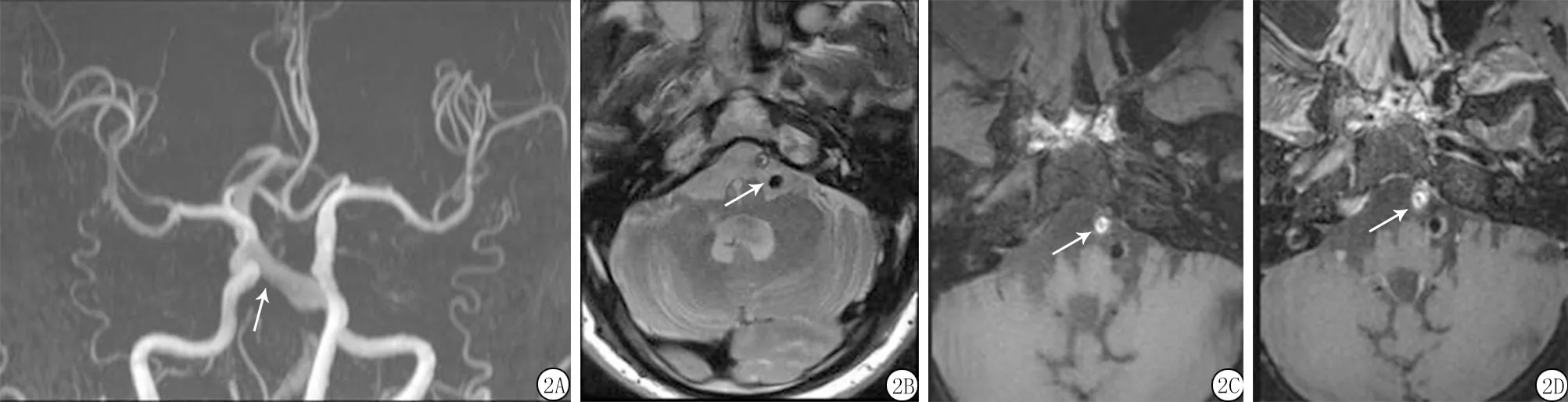
图2 负性重构HR-MR VWI图
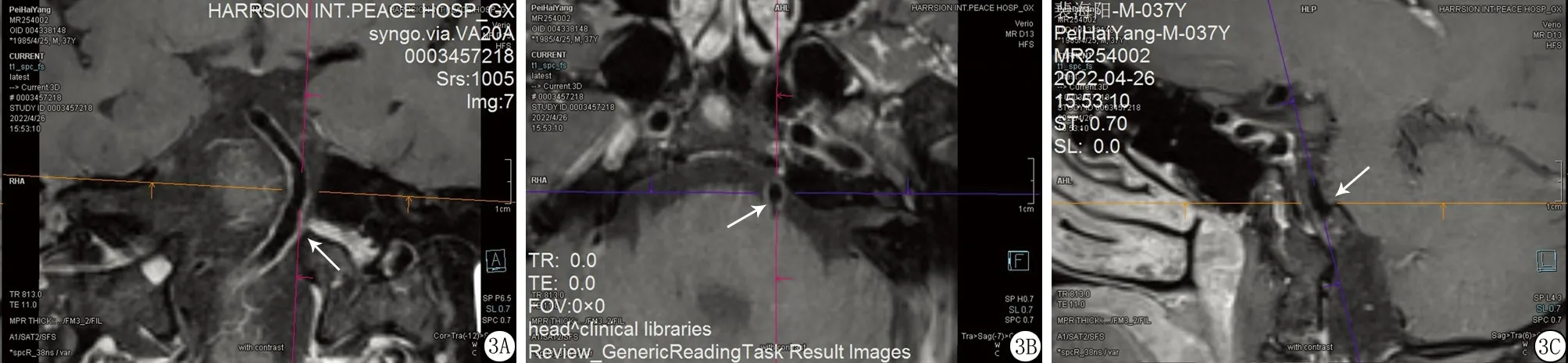
图3 无重构HR-MR VWI图
2.22组管壁重构情况、管壁特点、斑块特点比较 发生组与未发生组管壁重构情况比较差异有统计学意义(P<0.05);发生组最窄层面血管面积、管壁面积高于未发生组,最窄层面管腔狭窄率、斑块负荷高于未发生组,不稳定斑块多于未发生组,差异有统计学意义(P<0.05)。见表2。VBD合并脑梗死复发患者,不稳定斑块形成,基底动脉近端增强显示管壁偏心增厚并较明显强化,累及分支血管,见图4。VBD未合并脑梗死复发,基底动脉走行迂曲,HR-MR VWI未见明显粥样斑块及强化影,见图5。
2.3管壁重构指数与最窄层面管腔狭窄率、斑块负荷关系 管壁重构指数与最窄层面管腔狭窄率、斑块负荷呈正相关(r=0.756、0.729,P<0.05)。见图6。
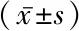
表2 2组管壁重构情况、管壁特点、斑块特点比较
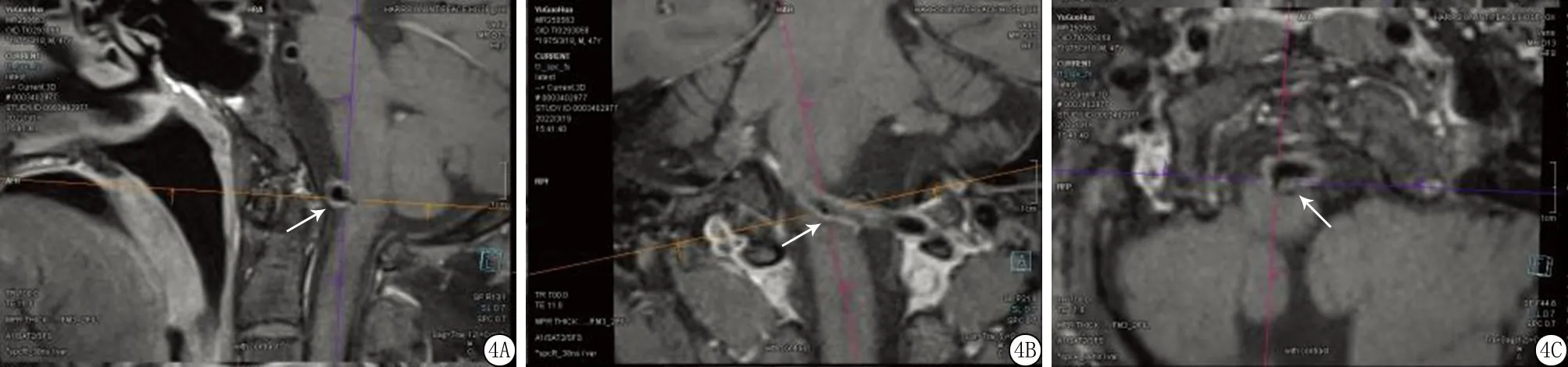
图4 发生组HR-MR VWI图
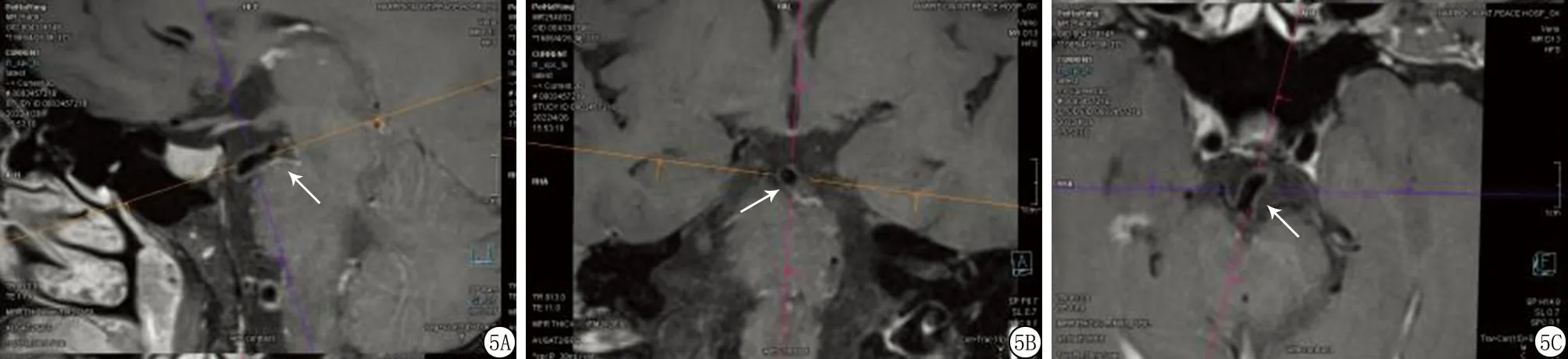
图5 未发生组HR-MR VWI图
图6 管壁重构指数与最窄层面管腔狭窄率、斑块负荷关系
2.4脑梗死影响因素的Logistic回归分析 以脑梗死为因变量,以脑梗死发生情况(未发生=0,发生=1)、管壁重构情况(无重构=0,负性重构=1,正性重构=2)、最窄层面中血管面积(mm2)(实际值)、管壁面积(mm2)(实际值)、最窄层面管腔狭窄率(%)(实际值)、不稳定斑块(个/人)(实际值)、斑块负荷(%)(实际值)为自变量,多因素Logistic回归分析显示,正性重构、最窄层面血管面积和管壁面积、最窄层面管腔狭窄率、不稳定斑块、斑块负荷均与VBD患者发生脑梗死独立相关(P<0.05)。见表3。
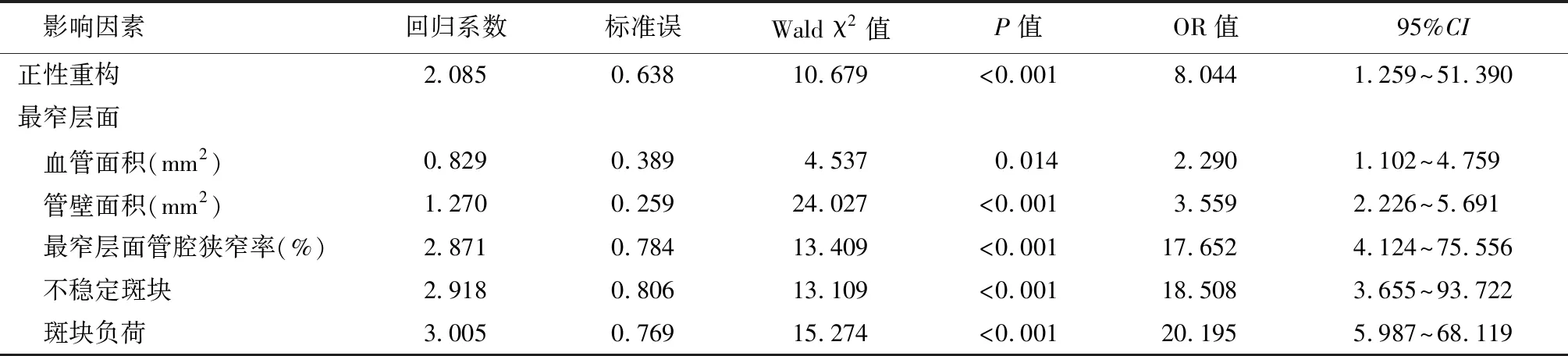
表3 脑梗死影响因素的Logistic回归分析
2.5HR-MR VWI预测脑梗死的ROC曲线分析 绘制ROC曲线显示,正性重构、最窄层面血管面积和管壁面积、最窄层面管腔狭窄率、不稳定斑块、斑块负荷脑梗死的AUC分别为0.649、0.804、0.807、0.808、0.809、0.752,联合预测AUC为0.921,大于单一参数。见图7、表4。
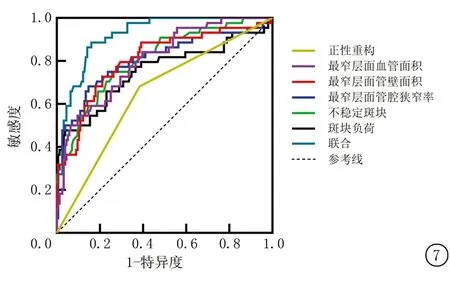
图7 HR-MR VWI预测脑梗死的ROC曲线
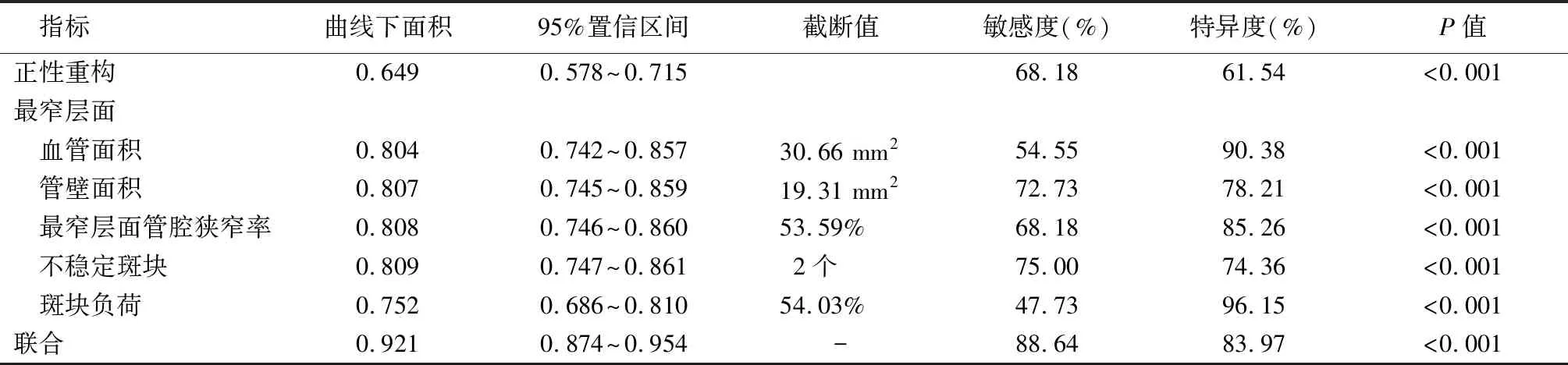
表4 HR-MR VWI预测脑梗死的ROC曲线分析
3 讨 论
VBD目前发病机制尚未明确,多认为由椎-基底动脉的内弹力膜广泛缺陷,中膜网状纤维缺乏导致动脉管壁受长期血流冲击所引起[8]。VBD可引起血管内血流动力学发生改变,促进血栓形成及血栓附壁脱落,引起继发性血管壁损伤,可显著提高脑梗死发生风险。本研究200例VBD患者随访6个月内共发生脑梗死44例(22.00%),略高于既往研究[9]发生率,原因可能在于所选病例病情相对较重,发生脑梗死风险较高。因此,早期对VBD患者发生脑梗死进行预测评估,及时给予相应干预措施意义重大。目前临床多通过CT血管成像、磁共振血管成像对颅内动脉狭窄情况进行评估,但仅能显示血管狭窄程度,无法判断狭窄处管壁特征及管腔狭窄原因[10]。近年来研究显示,HR-MR VWI技术可应用于临床动脉粥样硬化斑块结构及稳定性评估中,能通过特殊序列抑制血流信号,突出血管壁结构及附着于管壁的斑块[11-12]。
本研究结果显示,发生组、未发生组管壁重构情况、最窄层面血管面积、管壁面积、最窄层面管腔狭窄率、斑块负荷、不稳定斑块比较差异有统计学意义,可推测管壁重构、最窄层面管壁特点、斑块特点与VBD患者发生脑梗死密切相关。研究[13]显示,冠状动脉管壁重构为狭窄血管的代偿方式,颅内动脉也存在与冠状动脉相似的重构现象。王国军等[14]研究表明,基底动脉硬化血管壁正性重构表现为血管向外扩张,血管狭窄程度较轻,负性重构表现为管壁向腔内增厚,管腔狭窄程度加重,均可促进脑梗死的发生。证实管壁重构与VBD患者脑梗死的发生具有紧密联系。此外,VBD发生脑梗死患者正性重构比例明显大于负性重构,笔者认为,正性重构血管膨胀性生长,具有较大的血管面积,可形成高负荷斑块,在血流冲击作用下,斑块易损脱落,阻断下游较细分支血管,从而诱发脑梗死[15-16]。最窄层面血管面积、管腔面积及管腔狭窄率可反映基底动脉硬化血管狭窄情况,狭窄程度越大,远端脑组织灌注不足越严重,进而诱发脑梗死[17]。石增强等[18]研究显示,随最窄层面血管面积、管壁面积提高,基底动脉狭窄程度随之加重,与梗死体积呈正相关。国外报道显示[19-20],不稳定斑块及高斑块负荷与斑块局部内皮细胞功能障碍密切相关,可引起斑块破裂、脱落,且脱落组织可阻塞分支血管,引起供血区域发生急性脑梗死。本研究通过相关性分析显示,管壁重构指数与最窄层面管腔狭窄率、斑块负荷呈正相关,进一步证实管壁重构与VBD患者脑梗死的发生密切相关,共同参与脑梗死的形成过程。
本研究通过多因素Logistic回归分析显示,正性重构、最窄层面血管面积和管壁面积、最窄层面管腔狭窄率、不稳定斑块、斑块负荷均为VBD患者发生脑梗死的重要影响因素。张明宇等[21]研究表明,经HR-MR VWI检查,基底动脉硬化血管壁面积、斑块负荷及管壁重构与急性脑梗死病理过程密切相关,对于预后具有较高预测评估价值。基于上述研究结果,本研究尝试采用ROC曲线评估正性重构、最窄层面血管面积和管壁面积、最窄层面管腔狭窄率、不稳定斑块、斑块负荷对VBD患者发生脑梗死的预测价值,结果显示各指标单独预测AUC分别为0.649、0.804、0.807、0.808、0.809、0.752,具有一定预测价值,联合预测AUC为0.921,可有效提高预测效能,提示临床可通过上述指标联合预测VBD患者并发脑梗死风险,以针对性制定干预措施,改善预后。
综上所述,HR-MR VWI检查可有效评估VBD患者基底动脉管壁重构、管壁及斑块特点,各参数均为VBD并发脑梗死的重要因素,可通过联合预测VBD患者脑梗死发生风险,为临床针对性制定治疗方案、降低脑梗死发生率提供依据。但本研究存在样本量较少的不足,仍需通过多中心研究进一步验证。

