伴有睾丸侵犯的淋巴母细胞淋巴瘤患儿17例病例系列报告
党宛玉 张永红 段彦龙 杨 菁 周春菊 黄 爽 张 梦 李 楠 金 玲
淋巴母细胞淋巴瘤(LBL)是一组起源于不成熟前体T或B淋巴细胞的恶性肿瘤,占儿童非霍奇金淋巴瘤(NHL)的30%~35%。当以肿瘤性病灶起病而无骨髓及外周血浸润或骨髓中肿瘤性淋巴母细胞<25%时诊断为LBL;当以骨髓和外周血受累为主要表现,骨髓中淋巴母细胞>25%时,则诊断为急性淋巴细胞白血病(ALL)。按照免疫表型分为T细胞型(占70%~80%)和B细胞型(占20%~30%)[1,2]。经采用与危险度相关的ALL样化疗方案,LBL患儿5年无事件生存率(EFS)达75%~90%[3]。在既往的治疗方案中,对于伴有睾丸侵犯的LBL患儿采用化疗联合睾丸局部放疗;而现代治疗方案中,对诱导治疗结束时睾丸病灶消失的患儿,已取消放疗。本研究回顾性收集首都医科大学附属北京儿童医院(我院)收治的以肿瘤性病灶起病伴有睾丸侵犯的LBL患儿的临床资料,评估BCH-NHL-2009-LBL方案[来自改良BFM-90方案,即含大剂量甲氨蝶呤(HD-MTX)等的系统化疗而无局部放疗]的疗效。
1 方法
1.1 伦理和知情同意 本研究获得我院医学伦理委员会批准(审批号:IEC-C-008-A08-V.05.1),患儿家长签署治疗相关的书面知情同意书。
1.2 诊断标准和临床分期
1.2.1 LBL诊断标准 对受累组织活检进行组织病理学、免疫表型、细胞遗传学和分子生物学的检测,经至少2家三级甲等医院病理专家会诊,结果一致后确诊。按WHO 2008病理诊断分型标准进行诊断和分型。
1.2.2 睾丸侵犯 经睾丸手术活检或穿刺活检诊断,或已经病理确诊的LBL患儿经影像学(睾丸B超、PET/CT)诊断。
1.2.3 临床分期 化疗前通过至少2个部位骨髓穿刺及髂骨骨髓活检了解有无骨髓转移,腰椎穿刺检查了解有无CNS转移,参照儿童淋巴瘤的St.Jude分期标准进行临床分期[3]。
1.3 纳入标准 ①2009年1月至 2017年4月于我院初诊的以肿瘤性病灶起病的LBL住院患儿;②年龄<18岁;③伴有睾丸侵犯。
1.4 治疗方案 所有患儿均采用BCH-NHL-2009-LBL方案化疗,包括诱导缓解治疗、巩固治疗、强化治疗和维持治疗等,总疗程2~2.5年。维持治疗时间为16~22月。治疗过程中定期进行评估。
根据不同分期及危险因素进行危险度分组,采用不同强度分层化疗。(1)低危组:不具有高危因素的Ⅰ和Ⅱ期患儿,采用诱导缓解治疗[VDLP(长春新碱、柔红霉素、左旋门冬酰胺酶、泼尼松)+CAM(环磷酰胺、阿糖胞苷、巯嘌呤)×2]、巩固治疗(4疗程HD-MTX)、延迟强化治疗[VDLD(VDLP方案中的泼尼松改为地塞米松)+CAM]、维持治疗[6-MP(巯嘌呤)+MTX/VD(长春新碱、地塞米松)]方案。(2)中危组:不具有高危因素的Ⅲ和Ⅳ期患儿,在延迟强化治疗后增加8周中间维持治疗及1次VDLD+CAM强化治疗,再进入维持治疗。(3)高危组:通过瘤灶、骨髓、外周血评估治疗反应,符合以下任意一项进入高危组,①强的松预治疗d8,外周血幼稚细胞>1×109·L-1;②诱导治疗d15骨髓幼稚细胞>25%;③诱导治疗d33肿瘤残存>25%或骨髓幼稚细胞>5%,或骨髓MRD≥10-2,或脑脊液中持续存在幼稚细胞(即3次鞘内注射后脑脊液中仍有肿瘤细胞);④巩固治疗前(第2疗程CAM方案化疗后)评估仍有残留病灶者,或骨髓微小残留病灶(MRD≥10-3);⑤具有不良遗传学特征:t(9;22)或BCR/ABL,t(4;11)或MLL/AF4及其他MLL基因重排、SIL-TAL1。高危组巩固治疗采用6个疗程高危方案[HR-1(地塞米松+长春新碱+甲氨喋呤+环磷酰胺+阿糖胞苷+左旋门冬酰胺酶)×2、HR-2(地塞米松+长春地辛+甲氨喋呤+异环磷酰胺+柔红霉素+左旋门冬酰胺酶)×2、HR-3(地塞米松+阿糖胞苷+依托泊苷+左旋门冬酰胺酶)×2],其他治疗同低危组。HD-MTX剂量:B-LBL为3 g·m-2,T-LBL为5 g·m-2。
1.5 疗效评估 ①完全缓解(CR):患儿体格检查、骨髓涂片、脑脊液细胞学及影像学检查等各项指标均提示肿瘤完全消失;②部分缓解(PR):患儿肿瘤体积缩小>50%,但未达CR标准;③疾病进展:患儿原肿瘤病灶增大,或病理检查提示新病灶出现。
1.6 随访 停药后第1~2年,每3个月随访1次;停药2年后,每6个月评估1次。随访评估行瘤灶影像学(B超、CT、MR)、骨髓细胞形态学及MRD检查,免疫功能,肝、肾及心脏功能,LDH,青春期激素水平检测等。本研究随访数据截至2022年12月31日。失访定义为完成全部或部分治疗而后续未采集到随访信息者,失访者以末次随访时实际状态和时间计算。
1.7 统计学方法 采用SPSS 23.0软件进行统计学分析。采用Kaplan-Meier方法绘制生存曲线。OS时间为从诊断之日起至任何原因死亡或随访终点的时间间隔。EFS时间为从诊断之日起至肿瘤复发、死亡或随访终点的时间间隔。失访患儿的生存期计算至末次随访日期。
2 结果
2.1 一般情况 研究期间共收治LBL患儿277例,T-LBL 147例,其中睾丸侵犯5例(3.4%);B-LBL 130例,其中睾丸侵犯12例(9.2%)。17例伴有睾丸侵犯的LBL患儿的主要临床特征见表1,中位发病年龄6.2(2.5~13.5)岁,出现症状至诊断明确的中位时间为30(5~240)d。临床分期:Ⅲ期4例,Ⅳ期13例。中危组13例,高危组4例。纵隔占位5例,CNS侵犯3例,骨髓受累12例(其中8例已达白血病期),高白细胞血症2例,伴有腹股沟区、盆腔、坐骨/耻骨等区域侵犯11例,巨大瘤灶7例。7例LDH呈2倍以上升高,中位值为438(151~4 560)U·L-1。白血病融合基因5例阳性:2例SIL-TAL1,MLL-AF10、TEL-AML1和E2A-PBX1各1例。3例T-LBL合并气道梗阻及上腔静脉压迫综合征,1例发生肿瘤溶解综合征。
2.2 睾丸侵犯情况 原发性睾丸淋巴瘤1例,为T-LBL,以单侧睾丸肿块起病,经睾丸切除活检病理确诊;继发性睾丸淋巴瘤16例,均为全身多发侵犯,受累部位均>4个。睾丸受累表现:11例查体睾丸大小、质地、形态无明显异常,仅B超提示睾丸浸润;6例查体睾丸有单侧或双侧增大、质地变硬,其中1例睾丸有结节感。睾丸B超影像学表现有睾丸实质回声粗糙减低呈弥漫性或局灶性改变、附睾头部肿胀等。6例为双侧睾丸侵犯,11例为单侧睾丸侵犯。
2.3 治疗和不良反应 17例患儿均应用至少4个疗程HD-MTX治疗,均未行睾丸放疗。治疗过程中,发生凝血功能障碍3 例,诱导期颅内出血1例,静脉血栓2例,肝功能损害5例,口腔黏膜炎2例,1例发生高MTX血症并发肝肾功能损害,对症治疗后均好转。全部患儿在治疗期间均合并严重骨髓抑制,2例发生重症感染(包括肺部感染、败血症等),经积极抗感染,给予输注红细胞、血小板和升白细胞等支持治疗均抢救成功,无感染相关死亡。
2.4 疗效评估及事件分析 6例睾丸肿大患儿经激素预治疗病灶均有回缩,质地变软;VDLP方案诱导治疗第33天行早期评估,查体睾丸均回缩至正常大小,质地恢复正常;完成VDLP方案及2个疗程CAM方案后行中期评估,B超评估睾丸瘤灶均消失。诱导治疗结束早期评估,CR 12例,PR 5例;继续治疗至中期评估,CR 15例,PR 2例。中位随访时间为103(3~129)个月。图1显示,17例患儿5年OS和EFS分别为(87.5±8.3)%和(68.8±11.6)%;同期277例LBL患儿5年OS和EFS分别为(86.2±2.1)%和(82.6±2.3)%,差异均无统计学意义[5年OS:HR=1.15(95%CI:0.277~4.77),P=0.847;5年EFS:HR=0.468(95%CI:0.200~1.094),P=0.072]。
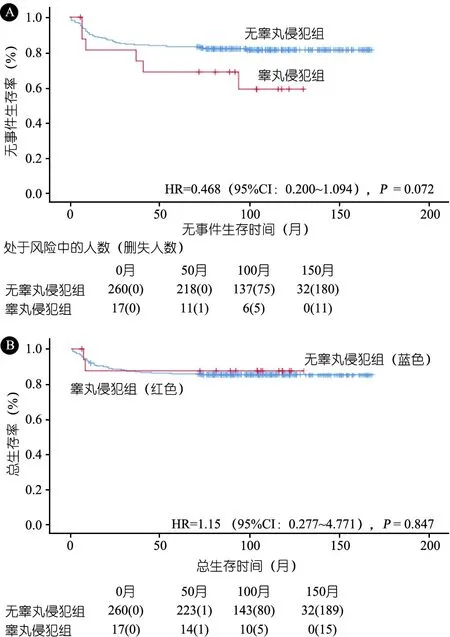
图1 LBL患儿的生存曲线
复发6例,其中1例B-LBL患儿于停药3个月睾丸复发,再次按标准方案化疗及双侧睾丸放疗后达CR,长期无病生存;CNS复发1例,再次化疗后长期缓解;1例停药2年余原发瘤灶及骨髓复发,1例于停药5年2个月骨髓复发,均经化疗缓解后行异基因造血干细胞移植,长期存活;2例原发瘤灶及骨髓治疗中复发后死亡。17例中睾丸复发仅1例,死亡2例(均为复发后疾病迅速进展后死亡),失访1例(化疗3个月后因经济原因未复诊)。
2.5 青春期睾酮水平随访 5例因移植、失访或死亡不能进行性激素检测,4例未查,余8例未移植患儿进入青春期(11~13岁)行睾酮水平检测,1例偏低,余7例均处于正常水平(表1)。
3 讨论
儿童LBL具有高度侵袭性,临床进展快,病程短,T-LBL好发于年长儿,男性多见,多表现为前纵隔肿物、淋巴结病变(颈部、锁骨上和腋下)等;而B-LBL发病年龄较小,无明显性别特异性,常见淋巴结肿大及皮肤、软组织(尤其是头颈部)、骨等结外侵犯。两者均易发生骨髓和CNS浸润,根据文献报道,LBL睾丸侵犯率约为5%,本研究与之相近[1,2]。
儿童原发性睾丸淋巴瘤罕见,多为继发性。睾丸浸润临床表现相对隐匿,最常见的首发症状为单侧睾丸增大,不规则肿胀,肿块硬结,伴或不伴有疼痛、坠胀感。约20%的患儿同时累及双侧睾丸。50%~60%患儿睾丸大小、质地无明显异常,仅通过影像学检查发现,超声是诊断睾丸侵犯最好的检查手段[4],可表现为单侧或双侧睾丸增大,弥漫性或局灶性回声减低,病变内血流增加等。本文11/17例(64.7%)患儿无症状,仅影像学B超发现,6例查体睾丸有单侧或双侧增大、质地变硬,亦与文献报道睾丸侵犯的临床特征相符[4]。
综合文献,LBL睾丸侵犯的临床和生物学危险因素有:年龄<1岁或≥10岁;T细胞表型;初始具有高肿瘤负荷或高WBC计数;其他髓外受累,如CNS侵犯、纵隔肿块和/或肝脾肿大,伴有腹股沟区、骨盆、盆腔侵犯者;具有高危遗传特征(如BCR-ABL1和KMT2A重排)。本文病例中,无小于1岁者,其他各年龄段均有发病;B细胞型多于T细胞型;17例中除1例原发睾丸T-LBL外,受累部位均超过4个,均具有高肿瘤负荷,且髓外受累广泛,其中11例(64.7%)伴有腹股沟区、骨盆、盆腔侵犯;2例伴SIL-TAL1基因患儿有高白细胞血症,1例伴MLL-AF10患儿年龄仅2岁,伴头皮巨大包块、腹股沟区淋巴结肿大、骨髓转移,均具有睾丸侵犯危险因素。符合文献报道的诊断时睾丸受累与较差的预后特征相关,但睾丸侵犯并非独立的预后不良因素[1,4]。
人体的血-睾屏障和血-脑屏障均由紧密连接的内皮细胞组成,具有天然免疫屏障功能,因为一般化疗药物进入睾丸和CNS的血药浓度远低于其他组织,使睾丸组织或CNS免受细胞毒性物质攻击,因此这两个部位成为了白血病细胞的天然“庇护所”[5]。睾丸是LBL髓外复发率仅次于CNS的部位,影响患儿长期生存率。故睾丸侵犯的治疗和预防是LBL治疗中的重要组成部分。
以往睾丸侵犯多采用双侧睾丸放疗或病侧手术切除, 随着现代治疗方案的不断优化,逐渐以全身强化治疗和HD-MTX的化疗为主,HD-MTX可透过血-睾屏障有效清除睾丸浸润的淋巴瘤/白血病细胞。睾丸局部放疗疗效尚佳,但放疗后出现的性腺功能障碍,包括不育,多在青春期或更大年龄时需用睾酮替代,显著影响患儿远期生存质量[6]。通过当前一线强化疗(包含睾丸渗透性良好的药物如HD-MTX、大剂量阿糖胞苷、地塞米松及有助于全身化疗的长春新碱、环磷酰胺、门冬酰胺酶等),初治睾丸侵犯可得到有效治疗,睾丸复发的风险降为2%或更低,故无需放疗[4,7]。我院对于睾丸浸润患儿,采用不含睾丸放疗的BCH-NHL-2009-LBL方案化疗,17例均于诱导缓解后睾丸瘤灶消失,仅1例于停药后3个月睾丸复发,再次按标准方案化疗及双侧睾丸放疗后达CR,长期无病生存。监测睾酮水平除1例偏低,余均在正常范围,提示睾丸侵犯及目前化疗未对青春期发育造成影响,远期生育能力尚需观察。
在当前系统治疗的策略下仍有1%~2%复发/难治患儿。对于孤立性睾丸复发,再次化疗后缓解率高,酌情辅以睾丸放疗,大多可获得长期生存[6],预后良好。CAR-T细胞疗法为睾丸侵犯患者提供了一种新的治疗选择。CAR-T细胞可有效到达髓外复发部位,如宫颈、乳房、骨骼及睾丸等。天津血液病研究所报告了7例B-ALL孤立性睾丸复发的男孩接受CD19 CAR-T细胞治疗后睾丸瘤灶均消失,CAR-T细胞可穿透血-睾屏障并有效清除睾丸内白血病细胞,而对睾丸功能未表现出毒性,使患者获得长期 CR[8,9]。

