体液因子及其相关miRNA 与慢性阻塞性肺疾病合并外周骨骼肌功能障碍的关系
那媛媛,刘朝晖,赵祝香,徐慧,梁志科,汪新龙
数据显示,截至2015年,我国40岁以上人群慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)发病率已达14%;2019年全球确诊COPD患者例数较1990年增加了85%[1]。随着病情进展,COPD患者体质量及肌肉耐力不断下降,运动能力不断变差,从而引起一系列级联反应;而外周骨骼肌功能障碍(peripheral skeletal muscle dysfunction,PSMD)作为COPD最常见的一种合并症,是预测COPD患者预后的一个关键指标,且COPD患者一旦发生PSMD,其预后不良[2]。目前评估COPD患者合并PSMD的方法主要为CT检查和MRI检查,其可以直观地测量患者的肌肉面积和观察肌肉形态,且诊断准确性高,但CT检查具有辐射性,对幼儿和妊娠期妇女危害较大;而MRI检查费用高昂,且具有检查时间长、检查条件严苛的特点,不适用于危重症患者[3]。因而寻找有效且方便无创的COPD合并PSMD的诊疗手段是非常有必要和有意义的。
研究发现,COPD患者肌肉中的蛋白质合成和降解均受到相关体液因子包括肌细胞增强因子2(myocyte enhacer factor 2,MEF2)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、组蛋白去乙酰化酶(histone deacetylase,HDAC)4和血清应答因子(serum response factor,SRF)等的调控[4-7]。miRNA是一种长度约为22个核苷酸的非编码单链RNA,其依靠内源性基因编码,主要生物学功能是调控基因的转录;在人类基因组中,共有1 700多种miRNA,且越来越多的miRNA被确定在人类的肌肉形成、发育和肌肉萎缩的损伤修复中起关键作用[8],这为miRNA成为治疗COPD合并PSMD的新靶点提供了依据。本研究旨在分析体液因子(MEF2A、IGF-1、HDAC4、SRF)及其相关miRNA与COPD合并PSMD的关系,以期为寻找更多COPD合并PSMD的治疗靶点提供理论依据。
1 材料与方法
1.1 实验时间 本实验时间为2021年12月至2022年9月。
1.2 实验动物 健康雄性C57BL/6小鼠11只(广东省医学实验动物中心提供),8~10周龄,体质量为20~25 g。将小鼠饲养于12 h光照/12 h黑暗、温度控制在26 ℃、温差不高于3 ℃、湿度为40%~70%的无特定病原体(specific pathogen free,SPF)级别的环境中,自由饮水和摄食,适应性饲养1周后开始动物实验。本实验经广州医科大学动物伦理委员会审批通过(伦理批号:2022102)。
1.3 主要实验试剂和仪器 红梅牌香烟(烤烟型,焦油量:1 3 m g)购自云南红塔集团有限公司,MEF2A抗体(批号:AF6381)购自美国Affinity公司,IGF-1抗体(批号:BS6817)、HDAC4抗体(批号:BS6486)、SRF抗体(批号:BS9121)购自Bioworld Technology公司,HRP标记的山羊抗兔IgG二抗(批号:GB23303)、HRP标记的驴抗山羊IgG二抗(批号:GB23304)、HRP标记的山羊抗小鼠IgG二抗(批号:GB23301)、HRP标记的山羊抗大鼠IgG二抗(批号:GB23302)、有机玻璃染毒箱(120 cm×80 cm×80 cm)购自湖南省凯达生物科技有限公司,DSI Buxco PFT动物肺功能检测系统购自美国DSI公司,ECL化学发光液购自美国Bio-Rad公司。
1.4 实验方法
1.4.1 实验分组及干预方法 将11只健康雄性C57BL/6小鼠随机分为对照组(n=6)与模型组(n=5)。对照组小鼠自由进食和饮水,不做任何处理。模型组小鼠采用烟熏法构建COPD合并PSMD模型,具体方法如下:将小鼠置于有机玻璃染毒箱内,点燃10支红梅牌香烟进行烟熏,30 min/次,2次/d,两次间隔时间至少为4 h,连续干预6个月。
1.4.2 观察小鼠大体情况 实验期间,观察小鼠的呼吸(有无咳嗽、气急、喘鸣等)、毛发(光泽度及脱落情况)、饮水和进食情况、活泼度以及对外界刺激的反应情况。分别测量两组小鼠干预0、1、2、3、4、5、6个月时的体质量。
1.4.3 检测小鼠肺功能指标 干预6个月后,采用1%戊巴比妥钠(100 mg/kg)腹腔注射以麻醉小鼠,采用DSI Buxco PFT动物肺功能检测系统检测肺功能指标,包括50毫秒用力呼气容积(forced expiratory volume in 50 millisecond,FEV50)/用力肺活量(forced vital capacity,FVC)、每分通气量(minute ventilation,MV)、气道阻力(airway resistance,AR)、动态肺顺应性(dynamic lung compliance,Cdyn)、吸气峰流量(peak inspiratory flow,PIF)、呼气峰流量(peak expiratory flow,PEF)。
1.4.4 小鼠胸大肌标本的收集 完成肺功能指标检测后采用颈椎脱臼法处死各组小鼠,在小鼠胸骨左侧第3、4肋间沿胸大肌边缘做一长为1 cm左右的切口,钝性分离皮下组织达深筋膜浅面,向两侧适当分离皮瓣,锐性打开深筋膜,暴露胸大肌后将其剪下。将一部分胸大肌组织立即放入液氮内冻存,另一部分胸大肌组织置于4%甲醛溶液中保存。
1.4.5 HE染色检测小鼠胸大肌组织肌纤维数量、肌纤维总面积、横切肌纤维平均面积 取4%甲醛溶液中的小鼠胸大肌组织,进行脱水、石蜡包埋、切片处理,之后进行HE染色,采用中性树胶封固,使用CaseViewer 2.2软件扫描切片并截取3张400倍视野的截图,采用Image-Pro Plus 6.0软件计数3个视野中肌纤维数量、肌纤维总面积,并计算横切肌纤维平均面积(横切肌纤维平均面积=肌纤维总面积/肌纤维数量)。
1.4.6 Western blot法检测小鼠胸大肌组织中MEF2A、IGF-1、HDAC4、SRF表达水平 取50 mg液氮内冻存的小鼠胸大肌组织,解冻,用冷却过的PBS冲洗干净,然后装入匀浆管内,添加已经被蛋白酶抑制剂裂解过的裂解液进行匀浆,再将匀浆管放入冰上裂解0.5 h,震荡数次,直至组织完全被裂解;在4 ℃条件下将裂解组织以12 000 r/min的速率离心10 min(离心半径10 cm),取上清液,分离出实验所需要的小鼠胸大肌总蛋白溶液,采用100 ℃金属浴加热5 min以变性,进行SDS-PAGE,终止电泳后进行转膜(转膜条件为300 mA恒流转膜0.5 h),快速涮洗转印完的膜,室温下封闭30 min,加入MEF2A、IGF-1、HDAC4、SRF抗体进行孵育,用TBST清洗3次、5 min/次,加入二抗(1∶5 000稀释)后室温下孵育30 min,用TBST清洗3次、5 min/次,在暗室中加入ECL化学发光液进行充分反应,然后进行压片、显影、曝光,从而分析目标蛋白表达水平。
1.4.7 预测Mef2a、Igf-1、Hdac4、Srf基因的miRNA使用R语言multiMiR软件包预测Mef2a、Igf-1、Hdac4、Srf基因的miRNA;选取预测出的最相关的1%的miRNA,并使用Cytoscape 3.8.2软件绘制mRNA-miRNA网络图;选择Mef2a、Igf-1、Hdac4、Srf 4个基因中有交集的miRNA进行下一步实验。
1.4.8 qPCR法检测小鼠mmu-miR-466I-3p、mmumiR-705表达水平 取小鼠胸大肌组织50 mg,提取总RNA,并进行反转录,采用qPCR法检测mmu-miR-466I-3p、mmu-miR-705表达水平。PCR条件:95 ℃10 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环,72 ℃30 s。mmu-miR-466l-3p的上游引物为:5'-ACACT CCAGCTGGGATACACACACACATAC-3',下游引物为:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGT TGAGTAGTGTGT-3';mmu-miR-705的上游引物为:5'-ACACTCCAGCTGGGGGTGGGAGGTGGGG-3',下游引物为:5'-CTCAACTGGTGTCGTGGAGTCGGCA ATTCAGTTGAGTGCCCACC-3';内参U6的上游引物为:5'-CTCGCTTCGGCAGCACA-3',下游引物为:5'-AACGCTTCACGAATTTGCGT-3'。
1.5 统计学方法 采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠大体情况 干预前,两组小鼠均比较健康,饮水与进食正常,活泼好动,毛发有光泽,没有咳嗽或打喷嚏等症状。干预过程中,模型组小鼠逐渐出现食欲不振,毛发逐渐失去光泽且颜色发黄,精神萎靡,活动量明显减少,部分小鼠出现了打喷嚏症状;且烟熏时小鼠喜欢扎堆,倦怠蜷缩,出汗明显,腹部胀大,呼吸急促,出现点头运动甚至张口呼吸。干预0、1个月时,对照组和模型组小鼠体质量比较,差异无统计学意义(P>0.05);干预2、3、4、5、6个月时,模型组小鼠体质量低于对照组,差异有统计学意义(P<0.05),见表1。
表1 对照组和模型组小鼠不同时间点体质量比较(±s,g)Table 1 Comparison of body mass between control group and model group at different time points
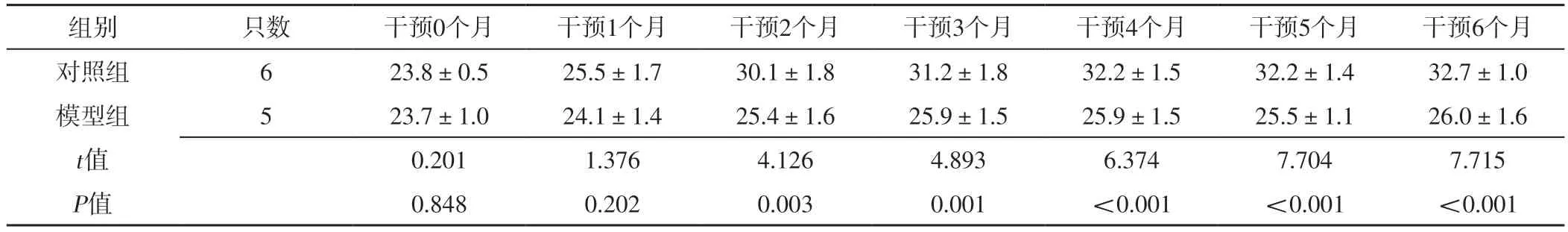
表1 对照组和模型组小鼠不同时间点体质量比较(±s,g)Table 1 Comparison of body mass between control group and model group at different time points
组别只数干预0个月干预1个月干预2个月干预3个月干预4个月干预5个月干预6个月对照组623.8±0.525.5±1.730.1±1.831.2±1.832.2±1.532.2±1.432.7±1.0模型组523.7±1.024.1±1.425.4±1.625.9±1.525.9±1.525.5±1.126.0±1.6 t值0.2011.3764.1264.8936.3747.7047.715 P值0.8480.2020.0030.001<0.001<0.001<0.001
2.2 肺功能指标 模型组小鼠FEV50/FVC低于对照组,MV、Cdyn小于对照组,AR大于对照组,PIF、PEF慢于对照组,差异有统计学意义(P<0.05),见表2。
表2 对照组和模型组小鼠肺功能指标比较(±s)Table 2 Comparison of lung function indexes between control group and model group
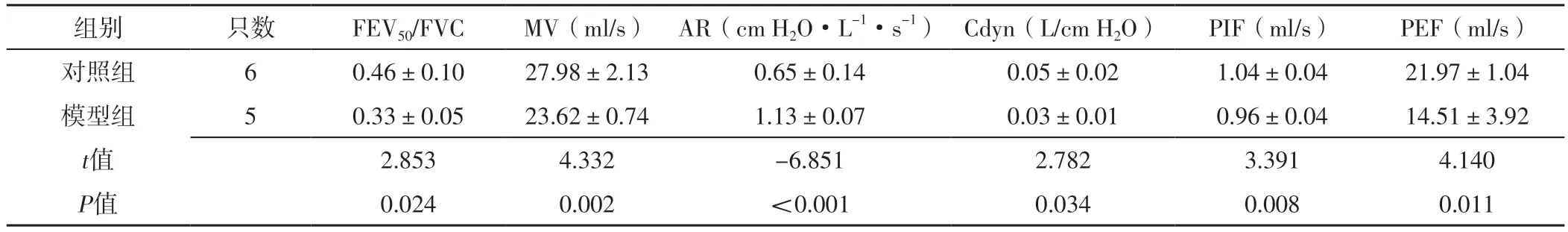
表2 对照组和模型组小鼠肺功能指标比较(±s)Table 2 Comparison of lung function indexes between control group and model group
注:FEV50=50毫秒用力呼气容积,FVC=用力肺活量,MV=每分通气量,AR=气道阻力,Cdyn=动态肺顺应性,PIF=吸气峰流量,PEF=呼气峰流量;1 cm H2O=0.098 kPa
组别只数5022)PEF(ml/s)对照组60.46±0.1027.98±2.130.65±0.140.05±0.021.04±0.0421.97±1.04模型组50.33±0.0523.62±0.741.13±0.070.03±0.010.96±0.0414.51±3.92 t值2.8534.332-6.8512.7823.3914.140 P值0.0240.002<0.0010.0340.0080.011
2.3 小鼠胸大肌组织肌纤维数量、肌纤维总面积、横切肌纤维平均面积 模型组小鼠胸大肌组织肌纤维数量少于对照组,肌纤维总面积、横切肌纤维平均面积小于对照组,差异有统计学意义(P<0.05),见表3、图1。
表3 对照组和模型组小鼠胸大肌组织肌纤维数量、肌纤维总面积、横切肌纤维平均面积比较(±s)Table 3 Comparison of the number of muscle fibers,the total area of muscle fibers and the average area of cross-cut muscle fibers in pectoralis major muscle tissue of mice between control group and model group
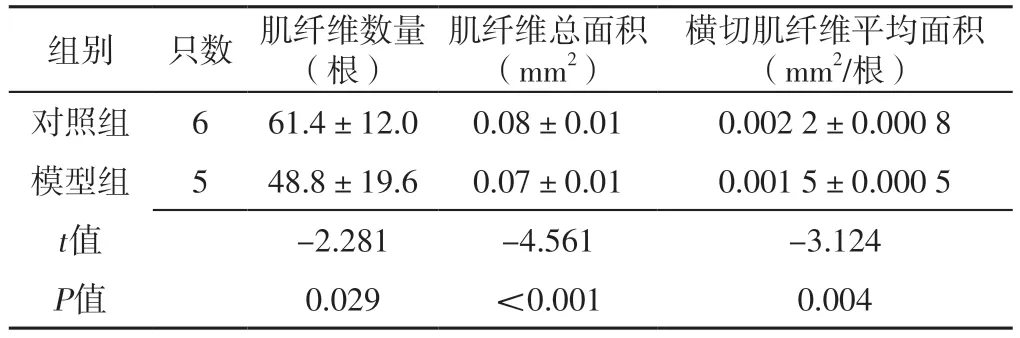
表3 对照组和模型组小鼠胸大肌组织肌纤维数量、肌纤维总面积、横切肌纤维平均面积比较(±s)Table 3 Comparison of the number of muscle fibers,the total area of muscle fibers and the average area of cross-cut muscle fibers in pectoralis major muscle tissue of mice between control group and model group
组别只数 肌纤维数量(根)肌纤维总面积(mm2)横切肌纤维平均面积(mm2/根)对照组661.4±12.00.08±0.010.002 2±0.000 8模型组548.8±19.60.07±0.010.001 5±0.000 5 t值-2.281-4.561-3.124 P值0.029<0.0010.004
2.4 小鼠胸大肌组织中MEF2A、IGF-1、HDAC4、SRF表达水平 对照组和模型组小鼠胸大肌组织中MEF2A、HDAC4、SRF表达水平比较,差异无统计学意义(P>0.05);模型组小鼠胸大肌组织中IGF-1表达水平高于对照组,差异有统计学意义(P<0.05),见表4。
表4 对照组和模型组小鼠胸大肌组织中MEF2A、IGF-1、HDAC4、SRF表达水平比较(±s)Table 4 Comparison of expression levels of MEF2A,IGF-1,HDAC4 and SRF in pectoralis major muscle tissue of mice between control group and model group
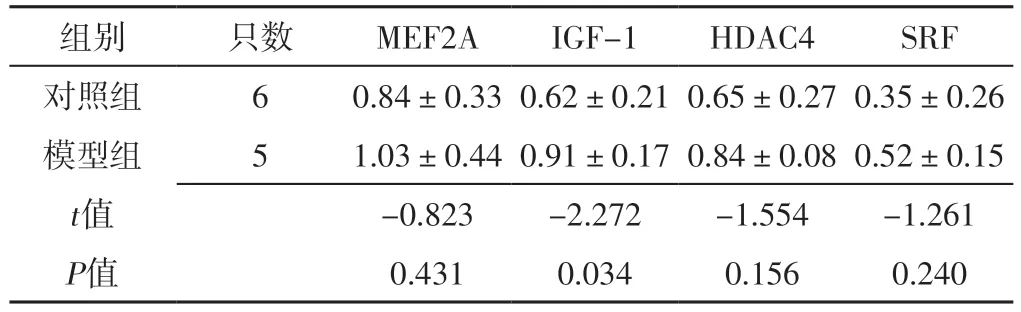
表4 对照组和模型组小鼠胸大肌组织中MEF2A、IGF-1、HDAC4、SRF表达水平比较(±s)Table 4 Comparison of expression levels of MEF2A,IGF-1,HDAC4 and SRF in pectoralis major muscle tissue of mice between control group and model group
注:MEF2=肌细胞增强因子2,IGF-1=胰岛素样生长因子1,HDAC4=组蛋白去乙酰化酶4,SRF=血清应答因子
组别只数MEF2AIGF-1HDAC4SRF对照组60.84±0.33 0.62±0.21 0.65±0.27 0.35±0.26模型组51.03±0.44 0.91±0.17 0.84±0.08 0.52±0.15 t值-0.823-2.272-1.554-1.261 P值0.4310.0340.1560.240
2.5 Mef2a、Igf-1、Hdac4、Srf基因的miRNA 没有预测到任何关于Igf-1基因的miRNA,而可预测到较多关于Mef2a、Hdac4、Srf基因的miRNA。选取最相关的1%的miRNA,结果显示,Mef2a、Hdac4、Srf基因的miRNA数目分别为7、33、16个,Mef2a、Srf基因共同受mmu-miR-466l-3p调控,Mef2a、Hdac4基因共同受mmu-miR-705调控。
2.6 小鼠mmu-miR-466I-3p、mmu-miR-705表达水平 对照组和模型组小鼠mmu-miR-466I-3p、mmu-miR-705表达水平比较,差异无统计学意义(P>0.05),见表5。
表5 对照组和模型组小鼠mmu-miR-466I-3p、mmu-miR-705表达水平比较(±s)Table 5 Comparison of the expression levels of mmu-miR-466I-3p and mmu-miR-705 in mice between control group and model group

表5 对照组和模型组小鼠mmu-miR-466I-3p、mmu-miR-705表达水平比较(±s)Table 5 Comparison of the expression levels of mmu-miR-466I-3p and mmu-miR-705 in mice between control group and model group
组别只数mmu-miR-466I-3p mmu-miR-705对照组61.17±0.702.79±2.46模型组51.47±0.683.88±2.03 t值-0.732-0.793 P值0.4950.451
3 讨论
目前全球COPD发病率和死亡率均在逐年攀升,随着年龄增长,患者活动受限,蛋白质分解增加,导致营养不良,同时大量使用类固醇类药物等会引起PSMD;且COPD合并PSMD的病因复杂,慢性心功能不全、慢性肾功能不全、恶性肿瘤、结核、代谢性疾病(如糖尿病、甲状腺功能亢进)等均可导致PSMD[8]。COPD合并PSMD的机制与肌肉蛋白质合成减少和分解增多导致机体蛋白质平衡被打破有关[9]。而在许多疾病中,肌肉蛋白质合成和降解均受到相关体液因子包括MEF2A、IGF-1、HDAC4、SRF等的调控[10]。此外,包括miRNA调控在内的表观遗传事件已成为COPD合并PSMD的研究热点。研究显示,骨骼肌中大量表达的miRNA可以作为诊断COPD合并PSMD的分子标志物[11-12]。本研究旨在分析MEF2A、IGF-1、HDAC4、SRF及其相关miRNA与COPD合并PSMD的关系。
研究显示,COPD合并PSMD患者不仅表现为气促、咳嗽、呼吸困难等,还会出现肺功能异常,同时也会出现躯体总质量下降、骨骼肌萎缩,在分子层面上表现为骨骼肌相关蛋白质合成减少、降解增加[13]。本研究结果显示,干预过程中,模型组小鼠逐渐出现食欲不振,毛发逐渐失去光泽且颜色发黄,精神萎靡,活动量明显减少,部分小鼠出现了打喷嚏症状;且烟熏时小鼠喜欢扎堆,倦怠蜷缩,出汗明显,腹部胀大,呼吸急促,出现点头运动甚至张口呼吸;干预2、3、4、5、6个月时,模型组小鼠体质量小于对照组;模型组小鼠FEV50/FVC低于对照组,MV、Cdyn小于对照组,AR大于对照组,PIF、PEF慢于对照组;模型组小鼠胸大肌组织肌纤维数量少于对照组,肌纤维总面积、横切肌纤维平均面积小于对照组;提示COPD合并PSMD模型构建成功。
COPD合并PSMD患者的主要表现是机体骨骼肌发生器质性和功能性改变。MEF2属于有丝分裂阻滞缺陷蛋白(mitotic arrest deficient,MAD)家族成员,是一种转录因子,其主要作用是调控肌肉发育过程[14]。IGF-1主要来源于肝细胞,其不仅可以调控肝细胞的功能,还可以调控一些其他组织如骨骼肌、心肌、脑的功能[10]。HDAC是细胞内重要的一种蛋白,其可以调控基因的转录,即协同组蛋白乙酰化酶(histone acetyltransferase,HAT)使蛋白乙酰化和去乙酰化达到动态平衡,从而维持基因转录的稳定性[15]。在有脊椎动物中,HDAC分为四种亚型,即HDAC1、HDAC2、HDAC3、HDAC4,目前研究最多的亚型是HDAC4,其主要作用是调控机体内的葡萄糖代谢和脂类代谢,抑制葡萄糖转运蛋白4(glucose transporter 4,GLUT 4)和肉毒碱棕榈酰基转移酶1(carnitine palmitoyl transferase 1,CPT1)基因转录,从而抑制骨骼肌、心脏及大脑等的功能[16]。研究显示,HDAC4可抑制卵泡抑素的表达,而卵泡抑素有拮抗肌肉细胞生成的作用,可导致肌肉质量的损失[17]。SRF是MAD转录因子家族一员,其在生物体的生长发育和信号传导中发挥着重要作用,如调控骨骼肌细胞、心肌细胞或平滑肌细胞中的基因转录[18]。本研究结果显示,模型组小鼠胸大肌组织中IGF-1表达水平高于对照组,提示COPD合并PSMD可能与IGF-1表达水平升高有关,分析原因为:COPD合并PSMD时,机体为了代偿,会产生更多的IGF-1来修复肌肉损伤[16]。但本研究结果还显示,对照组和模型组小鼠胸大肌组织中MEF2A、HDAC4、SRF表达水平比较,差异无统计学意义,分析原因可能与本研究样本量较小或者实验重复次数不足有关,尚需要大样本量的研究进一步证实。
目前关于COPD合并PSMD相关miRNA的研究大多集中在少数几个miRNA,如miR-1、miR-133、miR-206等,在庞大的miRNA家族里,应该可以挖掘出更多可以作为COPD合并PSMD诊断和治疗靶点的miRNA[19]。本研究选择MEF2A、SRF、HDAC4和IGF-1 4个肌肉萎缩相关分子进行溯源,即检索Mef2a、Igf-1、Hdac4、Srf基因的miRNA,结果显示,没有预测到任何关于Igf-1基因的miRNA,而可预测到较多关于Mef2a、Hdac4、Srf基因的miRNA;选取最相关的1%的miRNA,结果显示,Mef2a、Hdac4、Srf基因的miRNA数目分别为7、33、16个,Mef2a、Srf基因共同受mmu-miR-466l-3p调控,Mef2a、Hdac4基因共同受mmu-miR-705调控。进一步比较对照组和模型组小鼠mmu-miR-466I-3p、mmu-miR-705表达水平,但差异无统计学意义,提示mmu-miR-466I-3p、mmu-miR-705与COPD合并PSMD可能无关,也可能与multiMiR软件包内所收集数据有限有关。
综上所述,IGF-1与COPD合并PSMD可能有关,而MEF2A、SRF、HDAC4与COPD合并PSMD可能无关,且调控Mef2a、Hdac4、Srf基因的mmu-miR-466I-3、mmu-miR-705与COPD合并PSMD可能无关。但本研究尚存在一定局限性:(1)样本量较小,未来可以考虑增加样本量以减少随机误差;(2)虽然人和小鼠的基因有很大的同源性,但COPD合并PSMD患者与COPD合并PSMD模型小鼠依然存在很大区别,除了物种不同,前者还常受到外界环境、医疗干预等的影响。
作者贡献:那媛媛、刘朝晖进行文章的构思与设计;那媛媛进行研究的实施与可行性分析、数据收集、统计学处理,撰写论文;赵祝香进行数据整理;徐慧、梁志科、汪新龙进行结果的分析与解释;刘朝晖对文章整体负责,监督管理。
本文无利益冲突。

