血清PG、G-17、IL-10 在不同菌型Hp 感染慢性非萎缩性胃炎中的表达及对预后评估的价值分析
陆瑛 杨晓军
慢性非萎缩性胃炎为临床上常见的消化系统疾病,于成年人中发病率高达80%, 患者主要表现为中上腹不适、消化不良等特征, 若未及时得到有效治疗, 会出现肠上皮化生、异型增生, 严重者甚至会出现胃癌, 威胁患者生命安全。研究数据表明, Hp 感染于胃肠道疾病中发挥关键作用, 且Hp 感染率高达30%~50%, Hp抗体主要可分为Ⅰ型与Ⅱ型, 不同菌型Hp 感染会导致不同的疾病发展情况[1]。血清PG 为评估胃黏膜功能的血清学指标, G-17 为胃泌素的主要存在形式, IL-10为人体重要的免疫调节因子, 临床发现, 慢性非萎缩性胃炎患者的PG、G-17、IL-10 表达水平会随病情的变化而变化[2]。现阶段, 临床探究血清PG、G-17、IL-10 在不同菌型Hp 感染慢性非萎缩性胃炎中的表达及对预后的评估价值, 基于此, 本文选择本院2020 年11 月~2022 年1 月164 例Hp 阳性的慢性非萎缩性胃炎患者作为探讨对象, 展开以下分析。
1 资料与方法
1.1 一般资料 选择无锡市锡山人民医院2020 年11 月~2022 年1 月收治的164 例Hp 阳性的慢性非萎缩性胃炎患者作为研究对象, 其中男89 例、女75 例;年龄38~62 岁, 平均年龄(50.00±5.34)岁, 发病时间12~32 个月, 平均发病时间(22.00±3.43)个月;体质量指数17~24 kg/m2, 平均体质量指数(20.50±1.21)kg/m2;文化程度:初中及以下38 例、高中72 例、大专及以上54 例。
诊断标准:参考《慢性胃炎基层诊疗指南(实践版·2019)》[3], 确诊为慢性非萎缩性胃炎。纳入标准:已明确确诊;均Hp 阳性;患者近1 年内未曾进行抗Hp 治疗;患者均知晓且自愿参与本次研究。排除标准:慢性萎缩性胃炎;合并胃癌、胃泌素瘤、消化性溃疡等疾病;肝肾功能不全;严重心血管系统疾病史;合并恶性肿瘤疾病;近期服用抑酸剂、糖皮质激素、铋剂等药物;具有神经系统疾病或病史;资料不完整;依从性差。
1.2 方法
1.2.1 Hp 抗体分型检测方法 抽取所有患者4 ml清晨空腹静脉血, 注入抗凝管, 于常温环境下静置2 h, 待其凝固后, 以300 r/min、4℃的条件持续离心处理15 min, 取上层血清, 按照Hp 抗体分型检测试剂盒(深圳市伯劳特生物制药有限公司)操作步骤, 以免疫印迹法进行检测。
结果判读标准:①细胞毒素相关基因A(CagA)阳性:116KD 位置出现条带;②空泡细胞毒素A(VacA)阳性:95KD/91KD 位置出现条带;③尿素酶A(UreA)阳性:30KD 位置出现条带;④尿素酶B(UreB)阳性:66KD 位置出现条带。
Hp 感染分型标准:①Ⅰ型Hp 抗体阳性:CagA、VacA 2 条区带单独或同时显现;UreA、UreB 2 条区带单独或同时显现。②Ⅱ型Hp 抗体阳性:UreA、UreB 2 条区带单独或同时显现;未见CagA、VacA。③Hp感染阴性:CagA、VacA、UreA、UreB 抗体均为阴性[4]。
1.2.2 血清学指标检测方法 抽取所有患者清晨空腹静脉血3 ml, 以3000 r/min 转速、7 cm 离心半径持续离心处理10 min, 选取上层血清, 放置于-20℃冰箱中保存, 以待检测。采用微孔双抗体夹心法, 按照PGⅠ定量检测试剂盒(艾维可生物科技有限公司)操作步骤检测血清PGⅠ水平, 依据PGⅡ定量检测试剂盒(上海市瑞番生物科技有限公司), 以微孔双抗体夹心法检测血清PGⅡ水平, 计算PGR 值。采用人G-17 定量检测试剂盒(镇江博研生物科技有限公司), 按照操作步骤, 以酶联免疫吸附试验法(ELISA)检测血清G-17 水平。采用人IL-10 检测试剂盒(上海联迈生物工程有限公司),按照操作步骤, 以ELISA 法检测血清IL-10 水平。
1.2.3 预后情况 持续对患者随访1 年, 统计两组病情发展情况, 若病情得到有效控制则判定为预后良好,若病情发展为胃癌则判定为预后不良。
1.3 观察指标 分析Hp 抗体分型检测结果, 对比不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR、G-17、IL-10 水平, 不同预后患者血清PGⅠ、PGⅡ、PGR、G-17、IL-10 水平。
1.4 统计学方法 采用SPSS22.0 统计学软件进行统计分析。计量资料以均数±标准差(±s)表示, 采用t 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 Hp 抗体分型检测结果 164 例慢性非萎缩性胃炎患者中, Ⅰ型Hp 感染125 例, 占比76.22%;Ⅱ型Hp 感染39 例, 占比23.78%。见表1。
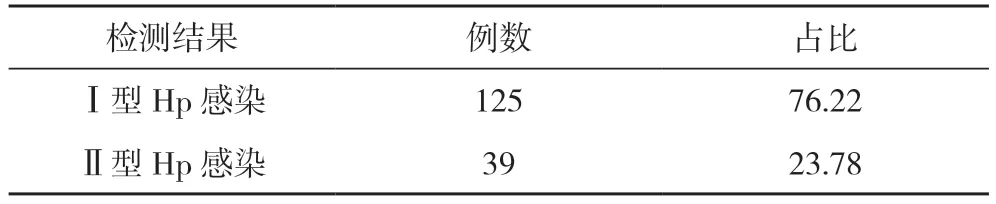
表1 Hp 抗体分型检测结果(n, %, n=164)
2.2 不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR水平比较 Ⅱ型Hp 感染患者的PGⅠ、PGR 水平均高于Ⅰ型Hp 感染患者, PGⅡ水平低于Ⅰ型Hp 感染患者,差异有统计学意义(P<0.05)。见表2。
表2 不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR 水平比较( ±s)
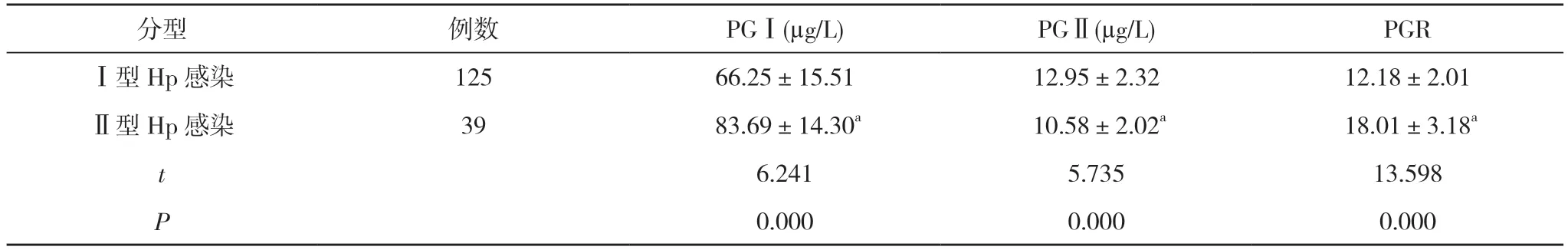
表2 不同菌型Hp 感染患者血清PGⅠ、PGⅡ、PGR 水平比较( ±s)
注:与Ⅰ型Hp 感染比较, aP<0.05
分型 例数 PGⅠ(μg/L) PGⅡ(μg/L) PGRⅠ型Hp 感染 125 66.25±15.51 12.95±2.32 12.18±2.01Ⅱ型Hp 感染 39 83.69±14.30a 10.58±2.02a 18.01±3.18a t 6.241 5.735 13.598 P 0.000 0.000 0.000
2.3 不同菌型Hp 感染患者血清G-17、IL-10 水平比较 Ⅱ型Hp 感染患者IL-10 水平高于Ⅰ型Hp 感染患者, 差异有统计学意义(P<0.05);Ⅰ型、Ⅱ型Hp 感染患者G-17 水平比较, 差异无统计学意义(P>0.05)。见表3。
表3 不同菌型Hp 感染患者血清G-17、IL-10 水平比较( ±s)

表3 不同菌型Hp 感染患者血清G-17、IL-10 水平比较( ±s)
注:与Ⅰ型Hp 感染比较, aP<0.05
分型 例数 G-17(pmol/L) IL-10(pg/ml)Ⅰ型Hp 感染 125 16.58±2.53 35.11±4.23Ⅱ型Hp 感染 39 15.90±3.02 39.54±3.16a t 1.397 6.031 P 0.164 0.000
2.4 不同预后患者血清PGI、PGII、PGR 水平比较持续对患者随访1 年, 164 例患者预后良好134 例、预后不良30 例。预后不良患者PGⅠ、PGR 水平低于预后良好患者, PGⅡ水平高于预后良好患者, 差异有统计学意义(P<0.05)。见表4。
表4 不同预后患者血清PGⅠ、PGⅡ、PGR 水平比较( ±s)
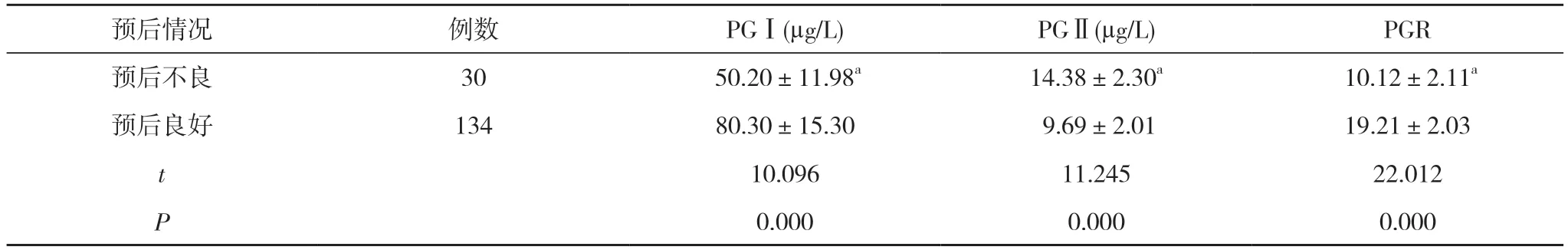
表4 不同预后患者血清PGⅠ、PGⅡ、PGR 水平比较( ±s)
注:与预后良好比较, aP<0.05
预后情况 例数 PGⅠ(μg/L) PGⅡ(μg/L) PGR预后不良 30 50.20±11.98a 14.38±2.30a 10.12±2.11a预后良好 134 80.30±15.30 9.69±2.01 19.21±2.03 t 10.096 11.245 22.012 P 0.000 0.000 0.000
2.5 不同预后患者血清G-17、IL-10 水平比较 预后不良患者G-17、IL-10 水平明显低于预后良好患者,差异有统计学意义(P<0.05)。见表5。
表5 不同预后患者血清G-17、IL-10 水平比较( ±s)

表5 不同预后患者血清G-17、IL-10 水平比较( ±s)
注:与预后良好比较, aP<0.05
预后情况 例数 G-17(pmol/L) IL-10(pg/ml)预后不良 30 14.92±3.02a 33.10±4.25a预后良好 134 18.60±2.55 40.20±3.18 t 6.901 10.350 P 0.000 0.000
3 讨论
近些年来, 随着人们生活习惯及饮食结构的不断变化, 慢性非萎缩性胃炎发病率明显上升, 严重降低了我国国民生活质量。目前一致认为, 该病在演变至胃癌的过程中, 胃黏膜经历了Hp 感染、慢性非萎缩性炎症、萎缩性炎症等一系列阶段, 而Hp 感染为此病的重要致病因素。Hp 感染可分为不同菌型, 其中Ⅰ型Hp可产生细胞毒素, 毒力较强, 致病性强, Ⅱ型Hp 不产生细胞毒性, 毒力弱, 致病性弱, 因此, 明确慢性非萎缩性胃炎的具体Hp 感染菌型具有必要性[5]。
李清清等[6]报道发现, 170 例Hp 感染消化性溃疡(PU)患者中, Hp Ⅰ型占比57.06%, Hp Ⅱ型占比15.29%。本文结果显示, 164 例慢性非萎缩性胃炎患者中, Ⅰ型Hp 感染125 例, 占比76.22%;Ⅱ型Hp 感染39 例, 占比23.78%。这与李清清等[6]研究一致, 提示慢性非萎缩性胃炎患者中主要以Ⅰ型Hp 感染为主, 可能是因为Ⅰ型Hp 为Hp 感染相关性胃炎的优势菌种,在临床上更多见。
了解不同菌型Hp 感染慢性非萎缩性胃炎患者的血清相关因子表达情况, 对于监测病情发展情况具有重要意义[7-9]。本文数据显示, Ⅱ型Hp 感染患者的PGⅠ、PGR 水平均高于Ⅰ型Hp 感染患者, PGⅡ水平低于Ⅰ型Hp 感染患者, 差异有统计学意义(P<0.05)。结果提示, 慢性萎缩性胃炎患者Ⅰ型Hp 感染对胃癌的发生诱导作用更强。主要是因为, Ⅰ型Hp 毒力更强,会加速向萎缩性胃炎、肠上皮化生、胃癌的转化, 因此, 加强Ⅰ型Hp 根除治疗非常重要。本文研究还发现,Ⅱ型Hp 感染患者IL-10 水平高于Ⅰ型Hp 感染患者,差异有统计学意义(P<0.05)。提示Ⅰ型、Ⅱ型Hp 感染均会对胃窦G 细胞分泌功能产生影响, 可能会有胃窦萎缩性炎症;Ⅰ型Hp 感染的抗炎能力较Ⅱ型Hp 感染更低。
本文研究还发现, 预后不良患者PGⅡ水平高于预后良好患者, PGR、PGⅠ、G-17、IL-10 水平均低于预后良好患者, 差异有统计学意义(P<0.05), 表明该类指标对于评估Hp 感染慢性非萎缩性胃炎患者的预后情况有一定指导意义。分析原因主要是, PG 为胃蛋白酶的前体, 于胃酸作用下会形成胃蛋白酶, 具有水解蛋白质的功能, 可体现胃黏膜功能[10-12]。Hp 感染后,主细胞内磷酸肌醇、环状核苷酸(cAMP)浓度增加, 从而使主细胞分泌PG 增加, 且PGⅡ水平升高明显, 使PGR 失调, PGR 明显下降, 而PGR 降低为胃癌的高危因素之一[13]。G-17 为胃泌素的主要活性成分, 可刺激胃酸及胃蛋白酶分泌, 促使黏膜生长, 调节胃肠功能[14,15]。Hp 带菌者多会有高胃泌素血症, 若血清G-17 表达持续降低, 提示胃窦黏膜萎缩, 血清G-17持续降低为胃癌的高危因素[16,17]。IL-10 为机体重要免疫调节因子, 可对Hp 感染过程中促炎因子的合成、活性进行抑制, 与抗炎介质发挥协同作用, 在活动期胃炎的炎症程度、抗Hp 治疗中具有重要作用, 若机体IL-10 水平明显降低, 提示胃炎炎症程度有所加重, 为胃癌的高危因素[18,19]。
综上所述, 慢性非萎缩性胃炎患者中Ⅰ型Hp 感染更多见, Ⅰ型与Ⅱ型Hp 感染患者G-17 水平表达基本一致, 但Ⅰ型Hp感染患者的胃黏膜抗炎免疫机制更低,更易发展为胃癌。PGⅠ、PGR、PGⅡ、G-17、IL-10水平表达情况与患者预后情况有一定关系, 可作为评估患者预后情况的有效指标。

