NLR、PLR对接受根治性同步放化疗的局部晚期头颈部肿瘤病人的生存预测价值
万强琨,何 斌,李婷婷,江 浩
头颈部肿瘤是最为常见的恶性肿瘤之一[1]。在我国男性中,其发病率为第6位,死亡率为第7位[2]。头颈部肿瘤最常见的病理类型是鳞癌,其中鼻咽癌主要由EB病毒感染引起,其他头颈部肿瘤主要与吸烟、饮酒等生活习惯相关[3]。传统意义上,恶性肿瘤治疗方案的制定及预后分析主要依据肿瘤的病理类型[4]、原发部位和TNM分期[5]。但临床中,经常发生病人预后与预期明显偏差的现象。这种现象引发了思考,除了上述原因以外,影响肿瘤预后的因素究竟还有哪些?随着人们对肿瘤认识的不断加深,更多因素如炎症水平、免疫组织化学结果、分子病理结果等被纳入研究范围。
炎症与肿瘤有着密切的关系[6]。全身免疫炎症指数(systemic immune-inflammation index,SII)的概念在2014年被提出[7]。研究[8-9]表明,基于中性粒细胞计数(ANC)、淋巴细胞计数(Lymph)、血小板计数(Plt)的SII可以作为预测胰腺癌、肝癌、乳腺癌预后的指标。SII之后,血细胞计数外周血中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)被广泛讨论。陆续被证实与卵巢癌[10]、子宫内膜癌[11]、肺癌[12]、食管癌[13]、前列腺癌[14]等肿瘤预后相关。头颈部肿瘤常常伴随着炎症,研究炎症与头颈部肿瘤的关系有着重要的临床意义。本研究目的在于通过分析接受根治性同步放化疗的头颈部肿瘤病人NLR、PLR与预后的关系,探索NLR、PLR对病人生存的预测价值。现作报道。
1 资料与方法
1.1 一般资料 回顾性分析2019年1月至2022年9月在我科接受根治性同步放化疗的局部晚期头颈部肿瘤病人247例,按照纳入、排除标准,最终纳入205例。纳入标准:(1)所有病人均有完整的病理、检验、影像及随访资料。(2)治疗前分期为T3、T4。(3)治疗前卡氏评分(KPS)>80分。(4)治疗方法为调强放疗(IMRT)+同步化疗。(5)放疗期间完成至少1周期同步化疗。排除标准:(1)治疗前出现远处转移。(2)未完成放射治疗,或放疗期间未完成至少1周期同步化疗。(3)合并其他原发肿瘤。(4)同步放化疗前接受2周期以上诱导化疗(不含2周期)。(5)合并严重肝肾功能损伤、严重内科基础疾病及免疫系统疾病。(6)合并血栓及出血性疾病。
1.2 数据采集 采集纳入病人放疗开始前、放疗结束后最近的一次血常规检测结果(若检测前1周内病人使用粒细胞刺激因子等升血药物,则按时间顺序顺延采集。分别记录ANC、Lymph、Plt,并计算出NLR、PLR。
1.3 治疗方法 本研究纳入的病人均采用IMRT+同步化疗的治疗方法。放射治疗的靶区勾画由1位主治医师完成,2位副主任医师审核通过后交物理师在放射治疗计划系统(TPS)上进行计划制作。TPS计划完成后由2位副主任医师审核。放疗计划的执行由1位副主任技师监督实施。靶区范围、剂量、危及器官受量及实施、质控标准均依据中国头颈部肿瘤放射治疗指南。同步化疗方案多数病人采用单药顺铂(顺铂,100 mg/m2,第1天,每3周1次)。也有少数病人采用顺铂+多西他赛(顺铂,40 mg/m2,第1、8、29、36天;多西他赛,40 mg/m2,第1、8、29、36天)、卡铂+紫杉醇(卡铂,AUC=2,第1天,1次/周;紫杉醇,50 mg/m2,第1天,1次/周)、顺铂+紫杉醇(紫杉醇,150 mg/m2,第1天;顺铂,35 mg·m-2·d-1,第1~2天,每3周1次)、顺铂+替吉奥(替吉奥,80~100 mg·m-2·d-1,第1~14天;顺铂,70 mg/m2,第8天,每3周1次)的方案。
1.4 随访方式 门诊复查、电话随访。最后随访日期2022年12月31日。中位随访时间33个月。
1.5 统计学方法 采用t检验、logistic回归分析、ROC曲线、χ2检验、 Kaplan Meier曲线、log-rank检验和COX比例回归多因素模型。
2 结果
2.1 同步放化疗前、后各项血液学指标变化 治疗后病人ANC、Lymph、Plt较治疗前均明显降低(P<0.01),而NLR、PLR均明显升高(P<0.01)(见表1)。

表1 同步放化疗前、后各项血液学指标比较(n=247)
2.2 NLR及PLR的最佳截断值 截止2022年12月31日随访结束,死亡44例(21.5%),存活161例(78.5%)。中位随访时间33个月(2~48个月)。死亡组病人治疗前、后NLR及PLR水平均高于存活组(P<0.01)(见表2)。
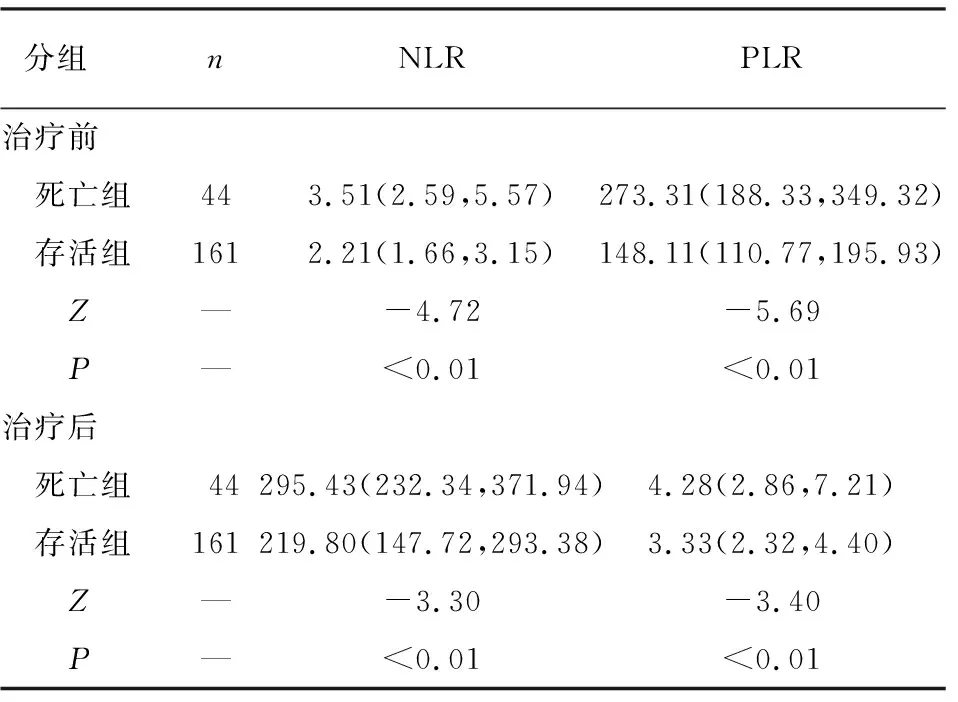
表2 死亡组和存活组治疗前后NLR及PLR水平比较
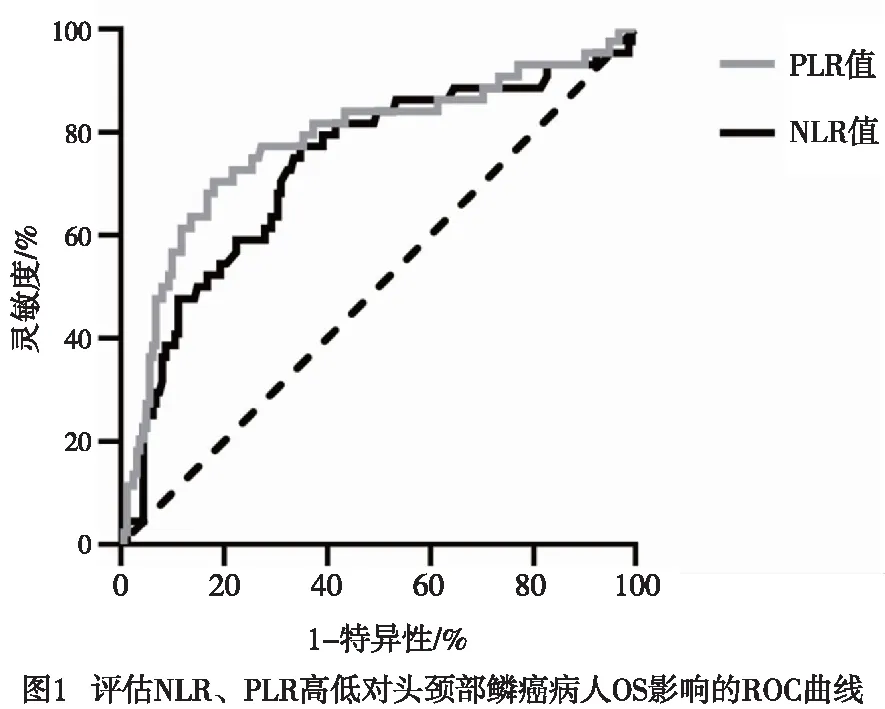
选择病人OS为研究终点,利用二元logistic回归,分析得出病人治疗前NLR、PLR均显著影响病人OS(P<0.05)。运用ROC曲线计算最佳截断值,NLR=2.554(AUC=0.732),95%CI(0.643~0.822),PLR=213.931(AUC=0.780),95%CI(0.692~0.867)(见图1)。
2.3 分组和组间一般资料的比较 根据截断值,将病人分为NLRhigh(NLR>2.554,90例,43.9%)、NLRlow(NLR<2.554,115例,56.1%)、PLRhigh(PLR>213.931,60例,29.3%)、PLRlow(PLR<213.931,145例,70.7%)4组。NLRhigh与NLRlow、PLRhigh与 PLRlow两两比较,病人年龄差异无统计学意义(P>0.05)。NLRhighvs NLRlow、PLRhighvs PLRlow两两比较,性别、肿瘤分期、肿瘤病理类型、肿瘤原发部位比较差异无统计学意义(P>0.05)(见表3、4)。
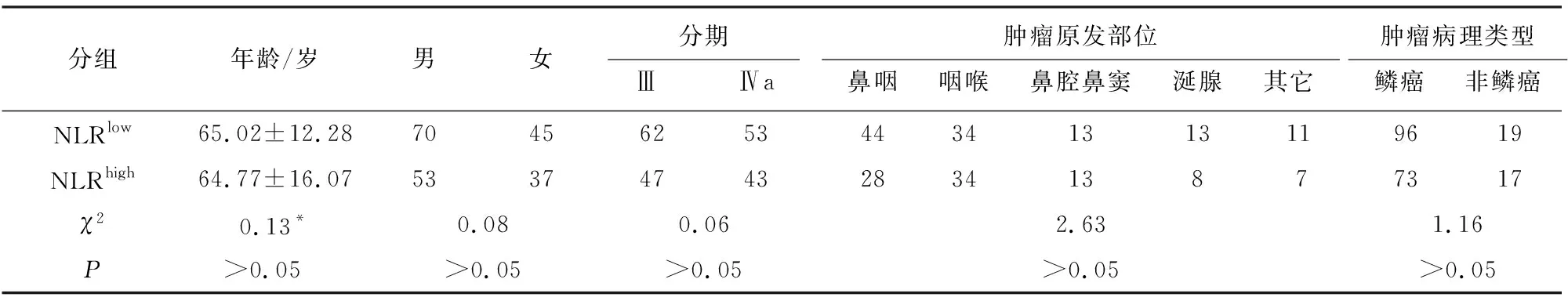
表3 NLR高水平及低水平病人一般资料比较(n)
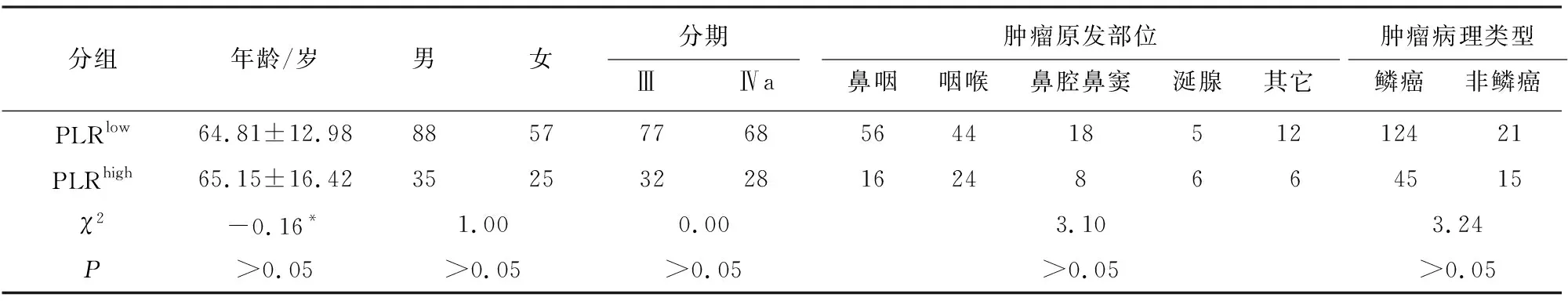
表4 PLR高水平及低水平病人一般资料比较(n)
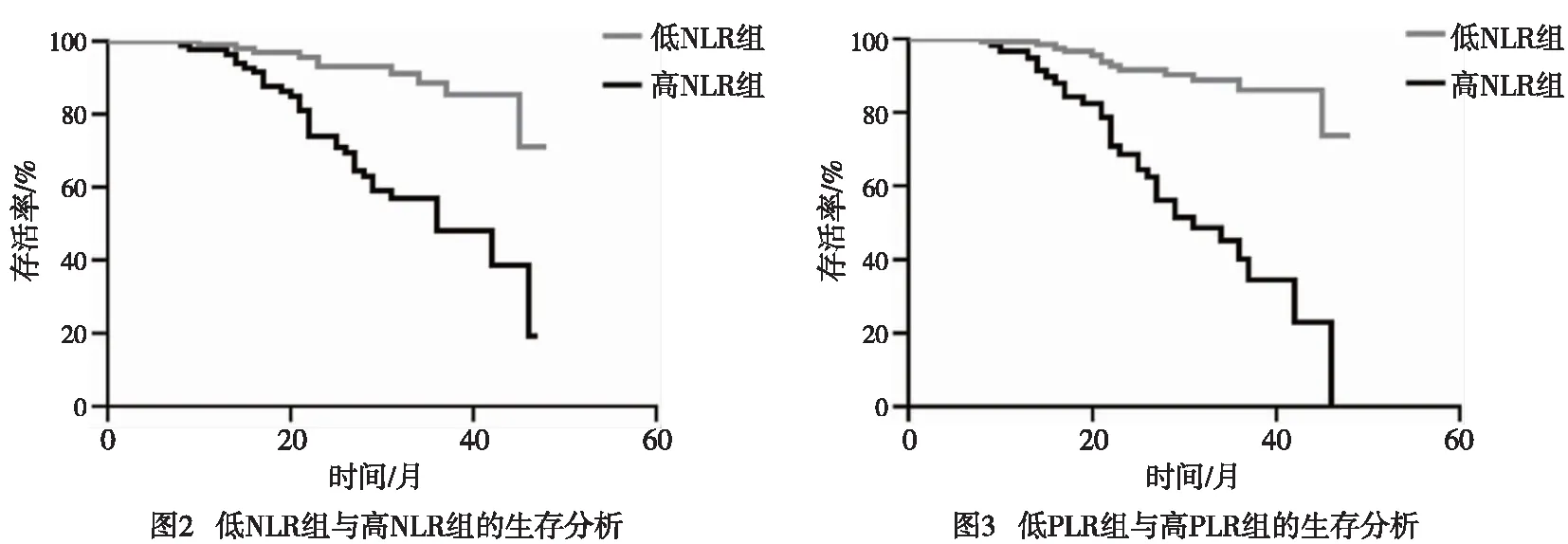
2.4 NLRhighvs NLRlow、PLRhighvs PLRlow的生存分析 通过Kaplan Meier曲线进行生存分析,采用log-rank检验分别比较NLRhighvs NLRlow,PLRhighvs PLRlow病人生存情况,统计分析得出:NLRlow及NLRhigh病人OS分别为44(42,46)个月及31(28,34)个月,组间比较差异有统计学意义(χ2=39.93,P<0.01);PLRlow及PLRhigh病人OS分别为44(42,46)个月及34(31,37)个月,组间比较差异有统计学意义(χ2=24.36,P<0.01)(见图2)。
2.5 OS相关的影响因素分析
2.5.1 单因素分析 将病人预后作为因变量,肿瘤分期、性别、NLR、PLR、肿瘤原发部位、年龄及肿瘤病理类型作为自变量进行单因素回归分析,结果显示NLR、PLR、肿瘤原发部位、肿瘤病理类型4个影响因素与病人OS相关(P<0.05~P<0.01)(见表5)。
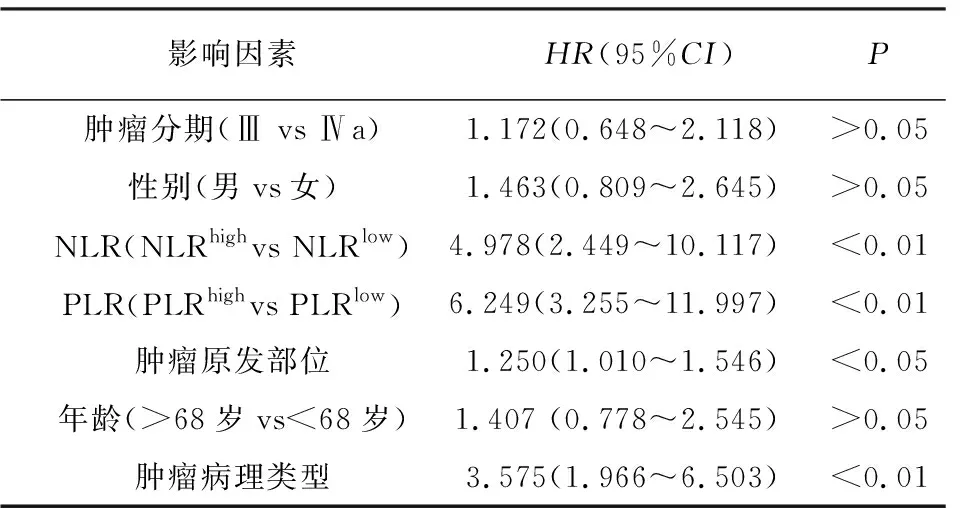
表5 可能影响病人OS的单因素分析
2.5.2 多因素分析 将病人预后作为因变量,将单因素分析有差异的指标NLR、PLR、肿瘤原发部位、肿瘤病理类型作为自变量进行多因素回归分析,结果显示仅NLR、PLR、病理类型3个影响因素与病人OS相关(P<0.05~P<0.01)(见表6)。
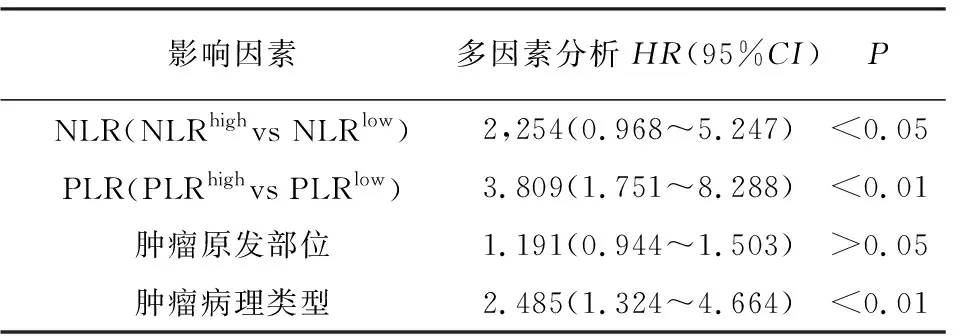
表6 影响病人OS的多因素分析
3 讨论
我们一般将炎性细胞浸润较少的肿瘤称为“冷肿瘤”,炎性细胞大量浸润的肿瘤称为“热肿瘤”。两者在生物学行为、治疗敏感性、免疫应答等方面都有很大区别。一般认为,中性粒细胞“帮助”肿瘤细胞增殖,淋巴细胞“破坏”肿瘤细胞增殖,血小板则是肿瘤细胞的“保护伞”。具体的作用机制尚不明确。目前主流的研究方向有:中性粒细胞促进肿瘤细胞增殖、转移机制:(1)通过释放炎症因子(弹性蛋白酶等);(2)通过激活内皮细胞和实质细胞;(3)通过提高循环肿瘤细胞的黏附力[15]。淋巴细胞抑制肿瘤细胞增殖、转移机制:(1)通过造成细胞毒性细胞死亡;(2)通过分泌细胞因子[16]。血小板的肿瘤细胞保护机制:(1)激活κB、TGF-β/Smad等信号转导通路;(2)诱导上皮-间质转化[17]。
骨髓抑制是同步放化疗中最常见的并发症[18]。本研究中病人治疗后ANC、Lymph、Plt均下降,NLR、PLR不降反升,提示淋巴细胞的减少程度较中性粒细胞和血小板似乎更加明显。苏州大学一项研究[19]表明,接受同步放化疗的鼻咽癌病人,单核细胞计数(AMC)下降与ANC下降具有相关性,AMC的改变可以预测ANC的变化。接受同步放化疗后,病人ANC、Lymph、Plt的下降程度、下降速度及相关性有待进一步研究。
因为治疗后NLR、PLR明显上升,不能客观反映病人血液学指标的初始状态。本研究选取治疗前NLR、PLR作为研究对象,纳入了205例头颈部肿瘤病人。在生存分析中发现,治疗前NLR、PLR低的病人,比疗治前NLR、PLR高的病人OS更长。2010年AN等[20]研究证实了低NLR病人的特异性生存率(DSS)、无远处转移生存率(DMFS)均高于高NLR病人。JIANG等[21]研究了治疗前NLR、PLR与鼻咽癌预后的关系,该研究结果表明NLR为鼻咽癌OS、无进展生存(PFS)、DMFS的独立预后因素,但该研究并没有证明PFS、DMFS与PLR的相关性。RASSOULI等[22]发现,在单因素分析中,头颈部鳞癌(HNSCC)NLRhigh(>4.27)和PLRhigh(>170)与病人的OS相关。这与本研究结果一致。该研究还显示了NLRhigh与较高的复发率相关,但PLRhigh未呈现这一结果。LEE等[23]研究表明,在口腔癌中,NLR、PLR在单因素分析时均为OS及无复发生存时间(RFS)的影响因素,纳入多因素分析后发现仅NLR是独立影响因素。一项对HNSCC的荟莘分析[24]显示,治疗前高NLR病人预后不良,易发生局部侵袭和远处转移,这也与本研究结果一致。
本研究显示,单因素分析中,病人OS的独立影响因素有:肿瘤病理类型、肿瘤原发部位、NLR、PLR。纳入多因素分析后,仅病理类型、NLR、PLR是病人OS的影响因素,原发部位不同并不影响病人OS。该结果引发两点思考:(1)TNM分期在本研究中并不影响病人预后。分析原因,本研究仅纳入了局部晚期(Ⅲ、Ⅳa期)病人,并未纳入早期病人,这可能导致分期对病人OS影响有限。(2)肿瘤原发部位在单因素分析中的结果与多因素分析结果不一致。分析原因,可能与样本量不足、样本中各个病种数量差异较大有关。
综上所述,NLR、PLR是头颈部肿瘤病人OS的独立影响因素,治疗前NLR、PLR更低的病人生存时间更长。运用NLR、PLR判断病人预后的优势在于数据容易获取,从实验室血常规检测结果中就可以计算获得。故治疗前评估NLR、PLR可能为头颈部肿瘤的生存评估提供新的思路。

