姜黄素联合5-氨基水杨酸介导Notch信号通路治疗溃疡性结肠炎大鼠的分子机制研究
薛永举,杨 丽,柯希权,朱 玉,王 猛
溃疡性结肠炎(ulcerative colitis,UC)是以非特异性炎症病变为主的肠道疾病,病变位置可累及直肠和结肠黏膜层[1],其病因主要为遗传倾向、环境触发因素、肠道微生物作用和免疫失调[2]。UC的临床特征为持续性或复发性腹泻、大便伴黏液血或化脓、腹痛和各种全身症状[3]。这种疾病很难治愈,目前治疗主要针对症状缓解[1]。UC的并发症包括贫血、低蛋白血症、中毒性巨结肠、肠穿孔和下消化道出血,严重威胁病人的健康[4]。近年来,随着饮食习惯的改变,UC的患病率急剧上升。
5-氨基水杨酸(5-aminosalicylic acid,5-ASA)在治疗轻中度UC的临床试验中起重要作用[5],主要以抑制环氧合酶和脂加氧酶的活性在临床治疗中起作用[6]。但近段时间内也有研究[7]报道,5-ASA 可以影响肠道微生物群的生长环境,从而改变肠道微生物的黏附力和持久性[7],导致UC病人在治疗后肠道黏膜细菌减少。因此,需要一种更可靠、风险更低有抗炎治疗作用的药用植物或其活性成分,尤其是含食物驱动成分。姜黄素(二阿魏酰甲烷)就是这样一种具有广泛治疗应用的化合物。已证明具有广泛的生物和药理活性,大量研究证据支持姜黄素的抗炎、抗氧化、抗肿瘤、抗菌和伤口愈合作用[8-12]。有Meta分析显示,姜黄素辅助疗法可有效缓解UC病人的临床病情,而不会引起严重不良反应[13]。由于其溶解性和生物利用度较差,天然姜黄素无法发挥其治疗功效的全部潜力。因此,为了提高姜黄素的生物利用度,将其与5-ASA进行复合。本研究将探究姜黄素与5-ASA联合使用是否能够在三硝基苯磺酸(TNBS)诱导UC大鼠中发挥更显著的治疗作用。
1 材料和方法
1.1 实验动物 本实验所使用的动物均为SD大鼠,采购于湖南斯莱克景达实验动物有限公司(许可证号:SCXK(湘)2019-0004)。饲养和繁殖均在湖南斯莱克景达实验动物有限公司医药实验动物中心恒温室(24±2)℃中,每日光照/黑暗循环各12 h,用常规标准饲料喂养,自由获取食物和水。SD大鼠为雄性,体质量180~220 g,饲养于温度20~26 ℃,湿度40%~70%的条件下。所有动物实验严格遵照动物护理和使用委员会的指南进行。
1.2 实验试剂 姜黄素(货号:C7090,厂家:索来宝);5-ASA(货号:14055,厂家:MCE);TNBS(货号:SLCK4178,厂家:Sigma);苏木素染液(货号:ZLI-9610,厂家:中衫金桥);伊红染色液(货号:G1100,厂家:索来宝);Mouse Monoclonal Anti-Actin(货号:TA-09,厂家:中杉金桥);辣根酶标记山羊抗鼠IgG(H+L)(货号:ZB-2305,厂家:中杉金桥);目的一抗:Rabbit Anti Notch1(货号:af5037,厂家:affinify);目的一抗:Rabbit Anti HESL (货号:df7569,厂家:affinify);目的一抗:Rabbit Anti Jagged1(货号:bs-1448R,厂家:Bioss);Trizon Reagent(货号:CW0580S)和超纯RNA提取试剂盒(货号:CW0581M)北京康为世纪生物科技有限公司;HiScript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)(货号:R223-01)和ChamQ Universal SYBR qPCR Master Mix(货号:Q711-02)采购于南京诺唯赞生物科技股份有限公司 。
1.3 实验仪器 显微镜(型号:CX43)采购于奥林巴斯(中国)有限公司;切片机(型号:2235)采购于徕卡显微系统(上海)贸易有限公司;全自动酶标仪(型号:WD-2102B)和蛋白垂直电泳仪(型号:DYY-6C)采购于北京市六一仪器厂;高速台式冷冻离心机(型号:H1750R)采购于湖南湘仪实验室仪器开发有限公司;荧光PCR仪(型号:CFX Connect 实时)采购于伯乐生命医学产品(上海)有限公司。
1.4 实验方法
1.4.1 大鼠UC模型制备 大鼠经禁食不禁水48 h,麻醉后由肛门轻缓插入直径为2 mm的橡胶输液管,深度为7 cm,输液管内装有TNBS(按照2 mL/kg溶入0.25 mL的50%乙醇中)。使用注射器来推动橡胶输液管中的TNBS,使之注入大鼠结肠,随后将大鼠持续倒置60 s。随后让大鼠平躺在笼中,等待自然清醒,任其自由饮食。48 h后取2只模型组大鼠的结肠组织观察及HE染色,肉眼可见模型组结肠黏膜充血水肿,伴坏死及溃疡形成,HE染色见结肠组织炎细胞浸润及隐窝炎甚至隐窝脓肿形成,证明模型制备成功(见图1)。

1.4.2 药物治疗处理 将18只UC大鼠随机分组进行药物治疗,分为5-ASA组、姜黄素中剂量组和姜黄素中剂量+5-ASA 组,每组各6只。对模型组UC大鼠每天以5 mL/kg的5-ASA进行灌胃,对姜黄素中剂量组UC大鼠每天以5 mL/kg的姜黄素溶液进行灌胃,对姜黄素中剂量+5-ASA联用组UC大鼠每天以5 mL/kg的姜黄素溶液和5-ASA进行灌胃,模型组和正常组大鼠以溶剂对照按相同方式灌胃处理,共灌胃10 d。
1.4.3 疾病活动指数(DAI)评分 各组大鼠注药后每日观察它们的一般情况,如精神状态、进食、活动和大便情况等,并每天使用联苯胺法测大便隐血,根据观察结果进行DAI评价。DAI 评分标准见表1。

表1 DAI评分标准
1.4.4 结肠黏膜损伤指数(CMDI) 处死动物观察大体标本并评价CMDI。CMDI评分标准见表2。

表2 CMDI评分标准
1.4.5 HE染色和组织学评分 大鼠结肠黏膜石蜡切片,先进行烤片、脱蜡、水化,再用苏木素染液染色3~5 min,经流水冲洗后,用1%盐酸乙醇分化,反蓝液反蓝,伊红染色3~5 min后,切片脱水,封片,在显微镜(BX43,Olympus)下观察,进行组织学评分。组织学指标包括溃疡、炎症、肉芽肿、病变深度及纤维化,按有无及轻重分别记0、1、2分,病变深度达黏膜下层、肌层、浆膜层分别计1、2、3分,各项相加得总分。
1.4.6 免疫组织化学 免疫组织化学可以检测大鼠结肠黏膜内Notch信号通路中Notch1、jaggled1、Hes1的蛋白表达情况。大鼠结肠黏膜切片,烤片、脱蜡、水化后,用柠檬酸缓冲液进行抗原修复。经5% BSA抗原封闭2 h后,用Notch1(1∶100,兔抗)、jaggled1(1∶100兔抗)、Hesl(1∶100兔抗)进行一抗孵育,4 ℃过夜后,进行辣根过氧化物酶标记的山羊抗兔二抗(1∶100)孵育,经DAB适当时间显色,再用苏木精复染反蓝,用梯度乙醇和二甲苯脱水透明后,用中性树脂进行封片,最后在显微镜(BX43,Olympus)下进行观察,拍片记录。
1.4.7 Western blotting 取大鼠结肠黏膜组织适当重量,加入磷酸酶蛋白酶抑制剂和RIPA裂解液的混合物,用组织研磨仪进行研磨,提取组织总蛋白(对于细胞:取细胞,弃去培养基,用RIPA裂解液提取总蛋白)。在4 ℃、16 000 g的设定条件下,高速离心机离心15 min,仔细吸取上清液避免吸取到EP管底沉淀物质,用BCA蛋白测定法来进行蛋白定量。对蛋白样品进行变性后,进行十二烷基苯磺酸钠凝胶电泳(SDS-PAGE),后用300 mA恒流转膜。将蛋白转移至PVDF膜(millipore)后用脱脂奶粉室温摇床上封闭2 h后,用TBST清洗3×10min,随后在4 ℃条件下过夜孵育一抗,次日用TBST清洗3×10 min,室温摇床上孵育二抗2 h,漂洗3×10 min。用ECL显影液浸湿PVDF膜,置于超高灵敏度化学发光成像系统(Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司)中进行显影。
1.4.8 RT-PCR 采用Trizol试剂提取结肠黏膜组织中的总RNA,采用RNA 超纯提取试剂盒提取mRNA,利用紫外可见分光光度计测定mRNA的浓度和纯度(OD260/OD280),通过RNA逆转录试剂盒合成cDNA,采用荧光PCR仪进行荧光定量PCR。反应步骤如下:预变性 95 ℃,10 min;变性95 ℃,10 s;退火58 ℃,30 s;延伸72 ℃,30 s;40个循环。以GAPDH作为内参,基因的相对表达量根据2-△△Ct法计算。引物序列见表3。

表3 引物序列
1.5 统计学方法 采用方差分析和q检验。
2 结果
2.1 姜黄素对UC大鼠疾病活动和结肠黏膜损伤的影响 各组大鼠结肠组织对比,可以看出除对照组外,其余各组结肠黏膜均有不同程度损伤,模型组损伤最严重,药物干预后略有下降(见图2A)。在造模后第1天与对照组相比,其他4组大鼠出现松散大便和稀便,大便肉眼可见隐血,且DAI显著高于对照组。随着时间的推移,5-ASA组、姜黄素中剂量组和联合给药组大便隐血消退,消退所需要的时间短于模型组(见图2B)。与对照组相比,模型组CMDI评分明显上升(P<0.01),其他给药组较模型组CMDI下降(P<0.05~P<0.01),且联合给药治疗组CMDI评分下降最为明显(P<0.01)(见表4)。

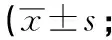
表4 各组CMDI评分比较分)
2.2 姜黄素对UC大鼠结肠黏膜病理的影响 与对照组比较,模型组的结肠黏膜组织肉眼明显可观察到出血糜烂和溃疡,显微镜下观察发S现杯状细胞消失,肠壁增厚,黏膜下层有大量的炎性细胞深入浸润(见图3)。与模型组相比,5-ASA组、姜黄素中剂量组和联合用药组结肠组织学损伤评分明显下降(P<0.01);且联合用药组结肠组织学损伤评分下降更为明显(P<0.01)(见表5)。

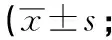
表5 各组大鼠结肠黏膜病理情况分)
2.3 姜黄素对UC大鼠结肠黏膜组织中Notch1通路蛋白表达的影响 与对照组相比,模型组Notch1、jaggledl、Hes1蛋白水平表达量明显升高(P<0.01);与模型组相比,5-ASA组和姜黄素中剂量组、联合用药组Notch1、jaggledl、Hes1蛋白均明显表达下降(P<0.01)(见表6~8)。大鼠结肠黏膜中Hes1、jaggledl、Notch1免疫组织化学示意图见图4。

表6 各组大鼠结肠黏膜中Hes1表达情况

表7 各组大鼠结肠黏膜中jaggledl表达情况

表8 各组大鼠结肠黏膜中Notch1表达情况

2.4 姜黄素对UC大鼠结肠黏膜Hes1、jaggledl、Notch1蛋白表达的影响 与对照组比较,模型组Hes1、jaggledl、Notch1蛋白表达明显上升(P<0.01);与模型组相比,5-ASA组和姜黄素中剂量组、联合用药组Hes1、jaggledl、Notch1蛋白表达水平均明显下降(P<0.01),下降幅度:联合用药组>姜黄素中剂量组>5-ASA组>模型组(见表9~11、图5)。

表9 大鼠结肠黏膜中Hes1蛋白表达情况

表10 大鼠结肠黏膜中jaggledl蛋白表达情况

表11 大鼠结肠黏膜中Notch1蛋白表达情况

2.5 姜黄素对UC大鼠结肠黏膜Notch1、jaggledl、Hes1 mRNA表达的影响 与对照组比较,模型组Notch1、jaggled1、Hes1mRNA表达水平明显升高(P<0.01);与模型组相比,5-ASA组和姜黄素中剂量组Notch1、jaggled1、Hes1mRNA表达水平明显下降(P<0.01)(见表12~14)。

表12 大鼠结肠黏膜中Hes1的mRNA表达情况

表13 大鼠结肠黏膜中jaggledl的mRNA表达情况

表14 大鼠结肠黏膜中Notch1的mRNA表达情况
3 讨论
UC是一种慢性及复发性炎症[14],结肠黏膜的炎性反应是其主要病理特征[15],且病因复杂,临床发现可能与遗传因素、免疫缺陷、环境刺激等多种因素有关[16-19],其最突出的表现是血性腹泻,其他症状有腹痛、消瘦、直肠紧迫感、里急后重等。UC发病机制较复杂,研究[20]发现肠黏膜屏障功能障碍在UC发病中起极重要作用[20],而结肠黏膜屏障损伤的主要原因是结肠上皮细胞增殖、分化失常[21]。已知构成结肠上皮的主要细胞是杯状细胞,而当杯状细胞缺失时,黏膜会发生一定的缺损、肠道的通透性也会升高、免疫功能发生改变以及肠源性感染也时有发生。本研究通过将100 mg/kg TNBS肛门给药构建大鼠UC模型[22],HE染色结果表明UC模型组的大鼠结肠黏膜部位发生出血,糜烂和溃疡,杯状细胞消失,肠壁增厚,黏膜下层炎性细胞浸润。
姜黄素是一种源自姜黄的多酚类化合物,具有抗氧化、抗炎和免疫抑制作用,并下调肿瘤坏死因子-α(TNF-α)、干扰素-γ、转化生长因子-β、白细胞介素(IL)-1β、IL-2、IL-6、IL-12和IL-17的表达[23-25]。姜黄素还具有抗菌和抗肿瘤的潜力,可以改善与UC相关的症状[26-27]。本研究按照姜黄素(100 mg/kg)和5-ASA(100 mg/kg)单独和联合对UC大鼠给药进行灌胃治疗,结果显示,姜黄素和5-ASA单独或联合使用均能够显著降低 TNBS 诱导的 UC 大鼠CMDI评分和DAI评分。HE病理染色结果显示姜黄素和5-ASA单独给药组炎性细胞有所减少,结肠黏膜出血糜烂溃疡情况缓解,且姜黄素-5-ASA联合给药组不见出血溃疡情况,只有少量炎性细胞,效果最显著。说明姜黄素联合5-ASA给药可有效缓解肠黏膜的损伤,发挥治疗UC的作用。
研究人员最初是在果蝇中发现的Notch信号通路。随后有大量的研究证明,在许多哺乳动物中Notch信号通路也广泛存在。胚胎干细胞、造血干细胞、淋巴细胞、肠上皮细胞和各种肿瘤细胞是Notch信号通路主要表达的位置。此通路在跨膜受体蛋白家族进化中是相对保守的信号通路。有研究[28]称,Notch通路靶基因Hes1和Math1以及配体Dll1可能是治疗UC的新的治疗靶点,其作用可能为进一步研究提供理论基础。事实上,Notch信号通路是肠内稳态过程中细胞命运决定的主要调节器,在维持结肠上皮细胞增殖和分化中起着重要作用,治疗UC最关键的信号通路之一[29]。据报道[29-30],DSS结肠炎小鼠炎症肠细胞的增生性隐窝中存在Notch信号通路基因的过度表达。Notch受体、Notch配体、CSLDNA结合蛋白、靶基因、效应分子等是Notch信号通路的主要组成成分。而在哺乳动物中,Notch受体之一的Notch1 在肠道中存在[31],当Notch受体与配体结合时,就会使Notch信号通路被激活,从而使下游靶基因 Hesl等发生转录调节,随后使肠上皮细胞增殖分化,靶基因Hesl的表达促使结肠上皮细胞向吸收系细胞分化[32]。研究[33]表明,当把小鼠的Hesl基因敲除后,发现杯状细胞等分泌细胞在小鼠结肠增多,而肠细胞却发生减少[34]。而一些实验结果发现,在UC小鼠结肠上皮组织中,Notch1、Hesl mRNA水平和蛋白水平表达量均较正常小鼠有显著升高的趋势,在经过特定药物干预后,可以显著降低小鼠结肠上皮组织 Notch1、Hesl mRNA和蛋白水平的表达。值得注意的是,Notch信号通路基因的异常表达和失调与几种疾病的发病机制密切相关,Notch1、Notch2、Hes1和Jagged1等Notch基因的表达在隐窝中富集[35]。在研究人员[36]对UC研究过程中发现,人类结肠细胞系中,Notch信号通路的异常表达导致了转录因子HES1的表达也随之增加,并抑制肠上皮细胞分化为杯状细胞从而减弱黏液屏障。那么在姜黄素治疗大鼠UC中是否有Notch信号通路的调控呢?DEY等[37]研究发现姜黄素可以抑制Notch1/Hes1信号通路进而减轻氧化应激对内皮细胞的损伤。也有研究发现姜黄素可下调 Notch1 通路从而改善气道炎症[38]。在本研究通过免疫组织化学、Western blotting、qPCR检测姜黄素、5-ASA单独和联合对UC大鼠给药后的结肠黏膜中Notch1、jaggledl、Hes1 蛋白和mRNA表达发现,UC模型组中Notch1、jaggled1、Hes1表达上升,而与模型组相比,姜黄素中剂量组和5-ASA Notch1、jaggled1、Hes1表达下降,且姜黄素中剂量+5-ASA联合用药组Notch1、jaggled1、Hes1基因下降趋势最明显。
综上所述,姜黄素与5-ASA联合应用能有效抑制UC大鼠结肠黏膜炎性反应的病理改变,并且加快恢复肠黏膜组织损伤的修复,而本研究中发现下调结肠黏膜组织中Notch1、jaggled1、Hes1蛋白和mRNA表达水平是其可能存在的作用机制。因此,可以通过抑制Notch信号通路的过度活化来抑制其发挥作用,并且促进结肠黏膜上皮细胞正常分化,黏液层结构和功能完整来最终实现对UC的治疗作用。

