颈动脉支架术前血压变异性与术后颈动脉窦反应的相关性研究
殷 亮,赵新秀,许娟娟,李倩倩
在我国脑血管病是一种致死或致残率高发的疾病。脑卒中作为一种急性脑血管疾病,是大脑血管受到各种原因导致的闭塞或破裂引起出血,或由于堵塞引起的脑组织缺血、缺氧[1],表现出高发病率、致残率以及死亡的趋势。据报道,在中国每年有超过200万脑卒中新病例,是所有疾病中因残疾而损失生命最高者[2]。缺血性脑卒中可以占到所有脑卒中发病类型的80%左右,因而被认为是一种最常见的类型。颈动脉狭窄作为缺血性脑卒中最常见的发病原因之一,临床上30%~60%的缺血性脑卒中是由颈动脉病变引起的[3-4]。近年来随着医疗技术进步和器械材料的改进,颈动脉支架置入术(carotid artery stenting,CAS)被认为是治疗颈动脉狭窄的一种新的微创方法,其具有易操作、创伤小、安全高效且费用低等优点,已被确定为高手术风险病人的一种选择[5]。尽管如此,CAS会导致多种并发症,其中颈动脉窦反应(carotid sinus reaction,CSR)是一种常见的CAS后并发症。CSR导致的血压低、心率慢以及昏厥等症状严重影响病人预后,甚至会导致病人致残和死亡[6]。因此,本研究旨在通过回顾性分析病人CAS术前24 h内血压变异性各项指标,寻找可以预测术后CSR发生风险的潜在因素以对病人进行及时有效预防措施,从而使病人及其家庭受益。
1 资料与方法
1.1 一般资料 纳入2019年8月至2023年2月于蚌埠医学院第一附属医院神经内科完成24 h动态血压监测后接受颈动脉起始部支架置入手术的59例病人。根据CSR的定义(支架或球囊置入后,收缩压<90 mmHg或心率<60次/分的任何发作)[7],分为CSR组和非CSR组。进一步将CSR病人分为三类亚型,分别是低血压型[收缩压(SBP)<90 mmHg(或)SBP基线降低了>30 mmHg],心动过缓型[心率<60次/分(并)心率基线降低了>20次/分],以及同时并发二者的混合型。纳入标准:(1)根据北美有症状颈动脉内膜剥脱试验(NASCET)标准,颈动脉狭窄率>50%的症状性颈动脉狭窄,包括黑矇、短暂性脑缺血或非致残性脑卒中;(2)高于70%的无症状颈动脉狭窄;(3)术前改良Rankin评分量表(MRS)评分<2分;(4)接受单侧、单个且仅颈动脉起始部支架植入术病人。排除标准:(1)存在脑出血或其他颅内疾病的病人;(2)MRS评分≥3分;(3)半个月内发生心梗病人;(4)伴有恶性高血压或低血压病人;(5)有颅内出血倾向;(6)合并严重心、肝、肾病以及全身感染的病人;(7)预期寿命低于1年的病人。本研究已通过蚌埠医院第一附属医院伦理委员会,同时所有参与研究的病人均已签署知情同意书。
1.2 动态血压监测及动态血压变异性(BPV)指标 采用全自动无创便携式动态血压监护仪,在病人接受颈动脉起始部支架置入手术前1天将监护仪袖带绑在手臂上并连接仪器24 h。设置日间监测时间为早06:00-22:00,共测量45次;夜间为22:00-06:00,共测量13次。24 h内共完成58次测量并分别记录24 h平均收缩压(24 h MSBP)、24 h平均舒张压(24 h MDBP)以及各自的标准差(SD)和变异系数(CV),日间及夜间SBP、舒张压(DBP)以及各自的标准差(SD)和变异系数(CV)。术后24 h监测血压及心率。
1.3 颈动脉起始部支架手术流程 术前病人进行拜阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)以及阿托伐他汀(40 mg/d)用药3 d治疗。术前局部麻醉,经股动脉入路穿刺置管。术中全身肝素化,长鞘或导引导管置于患侧颈总动脉近端后送入脑保护装置。根据NASCET标准计算病变血管狭窄率和狭窄长度,合适球囊进行预扩张,再选择合适支架置入狭窄段,复查造影后撤移脑保护装置和导引导管。术中进行血压、心率和血氧饱和度的检测。病人术后服用阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)联合治疗3个月,依据耐药情况进行单独用药,并长期维持。
1.4 统计学方法 采用t检验、Pearson相关分析、Mann-Whitney检验、Spearman相关分析、χ2检验、二元logistic回归分析和多元logistic回归分析。
2 结果
2.1 病人一般资料比较 59例病人中,CSR病人34例(57.63%)、非CSR病人25例(42.37%)。在CSR病人中,低血压型为19例(55.88%),心动过缓型8例(23.53%),混合型7例(20.59%)。CSR组与非CSR组年龄大小、性别分布、糖尿病、冠心病以及饮酒史、三酰甘油、胆固醇水平差异均无统计学意义(P>0.05);CSR组病人高血压、吸烟史和血管狭窄程度均高于非CSR病人组(P<0.05)(见表1)。进一步logistic二元回归分析显示高血压为CSR的独立危险因素(P<0.01)(见表2)。

表2 二元logistic回归分析CSR的基本风险因素
2.2 病人动态血压基本参数及BPV比较 2组病人除MSBP外(P>0.05),CSR病人组24 h血压基本指标与BPV各指标均高于非CSR病人组(P<0.05~P<0.01);在日间和夜间2组病人MSBP和MDBP差异均无统计学意义(P>0.05),CSR病人组其他各指标均高于非CSR病人组(P<0.01)(见表3)。
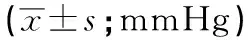
表3 CSR与非CSR组病人动态血压参数以及BPV比较
2.3 血压基本参数及BPV与CSR发病的相关性及功能预测分析 采用Spearman相关性继续分析所纳入病人24 h平均SBP、DBP及对应SD、CV与CSR发病相关性。结果显示,病人24 h MSDP、MDBP与SR的发病相关性差异无统计学意义(r=0.181、0.251,P>0.05),SBP/DBP-SD以及SBP/DBP-CV均与CSR的发病呈正相关关系(r=0.848、0.586、0.745、0.743,P<0.01),即提示病人术前24 h血压BPV越高,术后CSR发病风险越高。
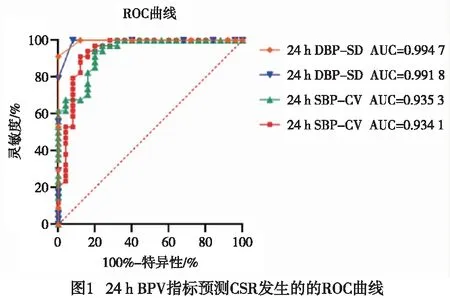
为进一步判断24 h术前BPV对术后CSR发病的预测价值,使用ROC曲线对与CSR发生呈显著相关性的术前24 h BPV指标进行分析。结果显示,24 h SBP/DBP的SD和CV的ROC曲线下面积(AUC)分别为0.994 7、0.991 8、0.935 3、0.934 1(见图1),均高于0.9,说明每项单独指标具备良好的对术后CSR发病的预测功能。
2.4 3个CSR亚型间的血压差异性比较 CSR病人中低血压型、心动过缓型和混合型三个亚型之间的血压比较显示,混合型CSR病人24 h DBP的CV高于低血压型和心动过缓型病人(P<0.05),混合型日间和夜间SBP的SD和CV均高于低血压型和心动过缓型(P<0.05),在夜间混合型病人的DBP的SD和CV也均高于低血压型病人的(P<0.05);但24 h、日间和夜间,BPV任何指标组在低血压型和心动过缓型组间差异均无统计学意义(P>0.05)(见表4)。

表4 CSR 3个亚组间的血压差异性比较
2.5 3个CSR亚组的独立风险因素分析 为进一步明确3个CSR亚组的独立风险因素,使用分类的无序logistic回归将CSR类型设置为因变量,并将上述结果中有差异的24 h、日间及夜间的MSBP/DBP及其各自的SD以及CV作为自变量,以低血压型作为参考类别进行比较分析。多元logistic模型拟合信息显示,当加入以上自变量时相比无任何自变量存在显著差异(P<0.05),提示模型拟合度良好,自变量重要性高。24 h仅DBP的CV是影响混合型CSR的独立因素(P<0.05);然而,日间和夜间SBP和CV均是影响混合型CSR的独立风险因素(P<0.05)(见表5)。
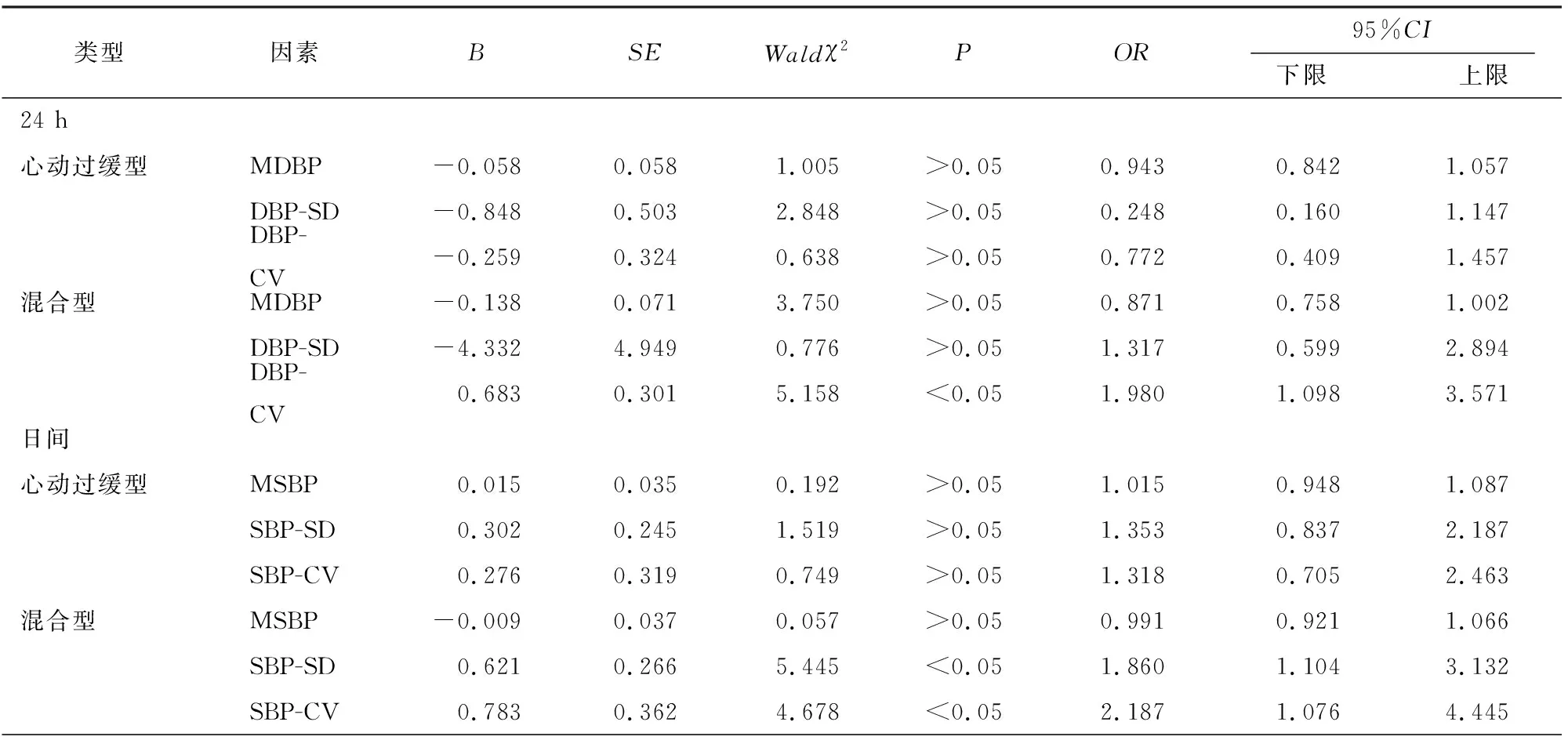
表5 CSR 3个亚组间的多元logistic回归分析
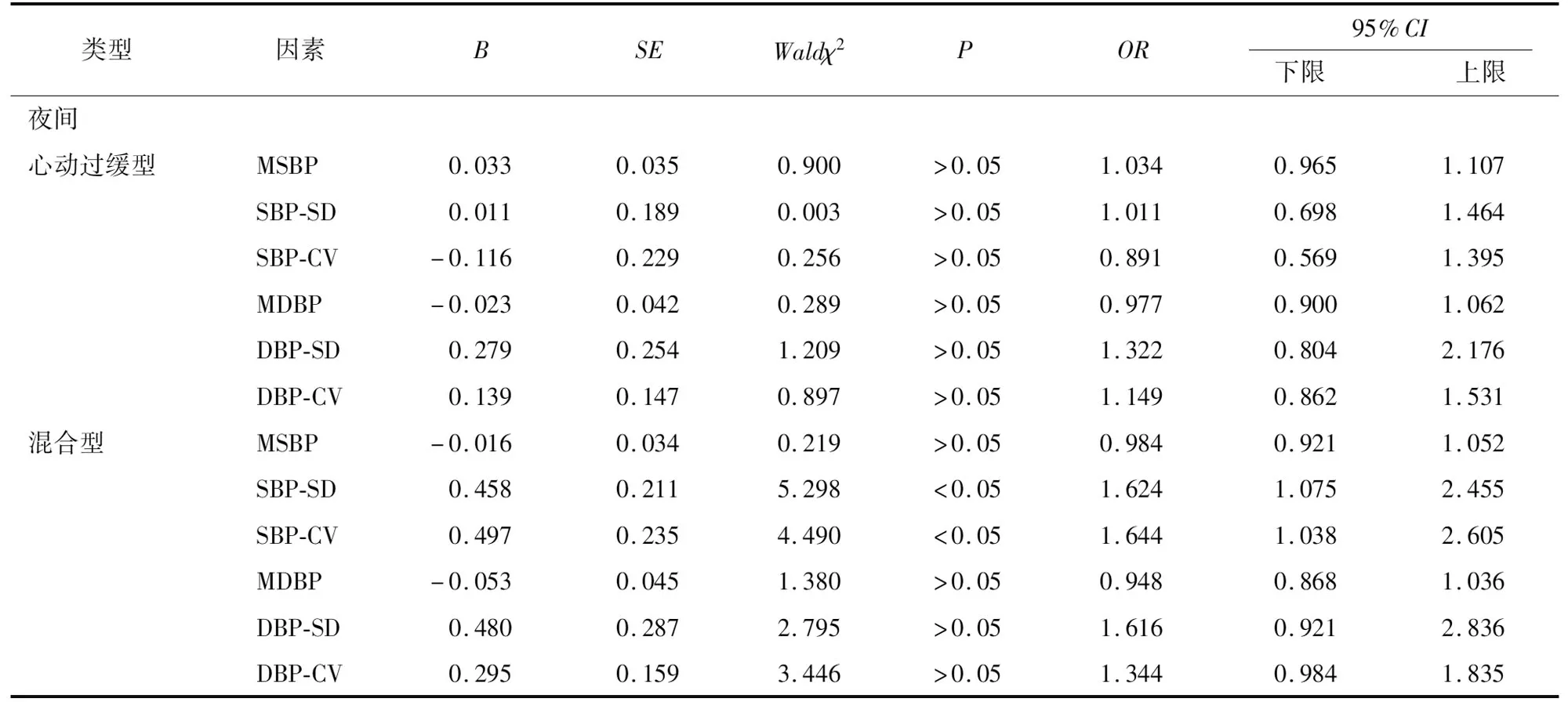
续表5
3 讨论
CSR是CAS术中及术后常见的并发症,主要表现为低血压及心动过缓。位于颈动脉起始部的颈动脉窦是人体压力感受器的重要组成部分,主要感受颈动脉血管扩张的刺激。病人接受球囊扩张或支架植入手术时会对颈动脉窦压力感受器进行压迫,当颈动脉狭窄解除后血流会大量涌入,这将增加了对术中颈动脉压力感受器的刺激,这会引起短暂性的颈动脉窦反应[8]。目前多采用的自膨式支架通过逐渐膨胀,对颈动脉窦压力感受器产生长时间的持续刺激。植入后会引起血管内膜和粥样斑块表面撕裂,改变颈动脉壁顺应性及受体敏感性,产生持续性低血压,多发生在术后[9]。因此,CSR危险因素包括球囊或支架手术中扩张压力、持续时间、结构特点、扩张次数以及颈动脉狭窄程度等。
研究显示颈动脉窦调节全身血压的作用是短暂的,但仍有不少病人在接受CAS后出现相对长时间的低血压症状。这可能是由于进行CAS术后自膨式支架扩张呈状态,从而对颈动脉窦压力感受器产生持续刺激作用,引起的反射性低血压症状会持续一段时间[10]。由于术后持续低血压是CAS预后不良的危险因素,SBP变化大于50 mmHg时会引起脑卒中等神经并发症,因此预防CSR具有重要意义。在进行CAS前要对病人血压、狭窄程度、球囊或支架型号进行全面评估,以做好术后颈动脉窦反应的预防措施[9]。目前已有研究显示增加的BPV是心血管病发生和死亡的重要危险因素[11],且与颈动脉窦反应发生相关[12]。本研究旨在通过对接受颈动脉支架手术病人前24 h BPV 分析与术后颈动脉窦反应的相关性,从血压变化方向寻找可以预测颈动脉窦发病的风险因素。
本研究结果显示,仅发现高血压是颈动脉窦发生的风险因素,提示高血压病人接受CAS后有着更高的CSR发病率,这与李雯等[13]临床研究结论保持一致。高血压升高时血管的牵张作用增强,通过迷走神经和窦神经传至心血管中枢,从而使心率下降及心输出量下降。损伤弹性大动脉,增厚其管壁促进弹性大动脉硬化斑块形成。通过对病人术前24 h血压的持续监测,发现CSR病人的术前MDBP及其SD和CV,以及SBP的SD和CV均显著高于非CSR病人,提示CSR病人血压基本参数和变异性会在术前表现出显著异常升高,与RYU等[12]研究观点类似。我们进一步细分了CSR病人分别在日间和夜间血压参数和变异性的差异,发现不论在日间或夜间CSR病人收缩压和舒张压的SD及CV均高于非CSR病人,然而未见MDBP或SBP间的差异。周茂松等[14]研究发现高血压病人24 h、白天及夜间收缩压SD均高于非高血压人群,提示单高血压因素即可改变收缩压变异性,进一步提示血压对心血管疾病的重要作用。BPV作为血压波动参数指标,可以反映机体迷走神经及交感神经对心血管系统的调节作用[15],与靶器官损伤的研究备受关注。STERGIOU等[16]的研究指出BPV相比平均血压对靶器官的损伤有着更强的相关性,可直接影响心血管病的预后。同时,ROTHWELL等[17]提出,SBP BPV可以不依赖平均血压而单独预测心血管疾病。本研究也提示更多的SBP和DBP BPV在CSR病人中显著异常,与这些报道论点基本相符。
依据病人颈动脉支架术后的血压及心率较术前的变化,我们将术后发生CSR的病人分为了低血压、心动过缓和混合型三类。并发现24 h DBP的CV在三个亚型间显著异常,同时混合型CSR病人SBP和DBP BPV在24 h、日间和夜间均高于低血压和心动过缓型,且24 h DBP的CV以及日间和夜间SBP的SD和CV均可预测混合型CSR的发生。然而,大多数研究的结果提示SBP比DBP与心血管疾病的发生关系更强,且白天和夜间SBP BPV增加对应不同的血管症状,机制与睡眠期间的血压变化和自主神经的紧张活动有关[18-19]。本研究的结果与之前类似,同时也提出DBP的预测价值,尤其是在混合型CSR类型中,其机制有待进一步分析。这些结果为预测颈动脉支架术后混合型CSR的发生提供了潜在的指标,针对进一步确认病人术后低血压型或心动过缓型,仍需要更精细的数据分析支持。
综上所述,本研究通过对病人颈动脉支架术前24 h BPV的分析,首次展示了与术后颈动脉窦发生的相关指标与风险因素,并对不同的CSR类型进行了区分。提示24 h术前BPV对术后不同类型CSR的发生具有重要的预测价值,为将来使用术前BPV数据作为CSR病人的常规监测指标提供了依据。

