基于SERS-MIT 的食源性毒芹碱快检研究
郭靖雯,辛美果
(1.广州工商学院粤港澳大湾区智慧冷链产业学院,广东佛山 528135;2.佛山科学技术学院 食品科学与工程学院,广东 佛山 528000)
毒芹碱通常以毒芹碱盐的形式存在于毒芹菜等植物中,具有强毒性以及致畸作用[1]。毒芹碱的致死量为60~120 mg,分子式为C8H17N,分子质量为127.23%[2],分子结构如图1 所示。毒芹菜由于外形与芹菜、茴香等可食用植物相似,经常由于误食而引起毒芹碱中毒。古希腊哲学家苏格拉底因饮用毒芹碱混合物而死亡[3]。研究表明,毒芹碱对周围和中央突触传递存在影响,临床表现通常为神经毒性中毒,横纹肌溶解和急性肾小管坏死[4]。Okan 等[5]通过研究毒芹碱在小鼠抗痛活性实验中,得出了毒芹碱可通过烟碱受体作用从而具有抗痛作用的研究结果,提出并验证了关于苏格拉底因食用毒芹碱的混合物而无痛死亡的药理学评估。2009 年,李莲婷[6]报告了5 例急性毒芹中毒。尽管有关误食毒芹中毒的文献报道不多,但在基层医院中,这种情况并不罕见。
目前可查阅文献中针对毒芹碱有效检测的研究相对较少,Lopez 等[7]实验采用薄层色谱法(Thin-LayerChromatography,TLC)对毒芹碱进行检测,定量限为0.8 μ g/mL。Beyer 等[8]的实验检测方法中,首先对毒芹碱使用固相萃取法进行萃取,再用液相色谱-质谱联用方法进行检测和定量。上述检测方法解决了毒芹碱的检出问题,但存在前处理复杂,检测限量低等问题。

图1.1 毒芹碱的分子结构图
表面增强拉曼光谱技术(Surface-Enhanced Raman Spectroscopy,SERS),是利用增强基底以实现对拉曼信号的显著增强的分析方法。基于拉曼光谱技术,可研究不同物质的化学结构、分子振动模式和化学键的性质[9]。相较于其他光谱学技术,拉曼光谱技术可以对样品进行非损坏分析,且不需要对样品进行特殊处理,同时具有高灵敏度、高分辨率、快速测量、不受水分子干扰等优点。分子印迹技术(Molecular Imprinting Technique,MIT)是具有特异性识别能力的高分子材料的技术,这些高分子材料通常被称为分子印迹聚合物(Molecularly Imprinted Polymers,MIPs)[10]。基于分子印技术所制备的分子印迹聚合物具有模板预定性,即在聚合物制备过程中使用的模板分子可以确定所制备聚合物的结构和空穴。分子印迹技术具备高特异性吸附能力和良好的化学稳定性,与SERS 技术联用进行检测,不仅可以避免其他污染物的干扰,还可以提高SERS 的检测灵敏度,并为痕量生物碱的检测提供了一条新的途径。目前国内关于分子印迹技术联合表面增强拉曼光谱技术检测的相关研究涉及环境污染物检测[11]、医学药品[12]、农药残留检测[13]等领域,LIKUN 等[14]通过制备新的便携式分子印迹聚合物SERS-MIT 纳米探针,并成功用该探针检测出茶饮料中的可可碱和咖啡因的类似物模板茶碱,其回收率为99.0~102.0%。Hu 等[15]采用分子印迹聚合物颗粒加载银纳米颗粒(AgNPs),开发了基于高性能表面增强拉曼散射的水生基质中咖啡因的快速和单步检测技术。因此本文在已有研究的基础上,运用SERS-MIT 技术对毒芹碱建立快速检测方法,希望能为后续研究提供技术参考和文献支持。
1 实验方法
1.1 实验材料与试剂
本实验所用到的实验试剂如表1 所示,实验用水均为超纯水。实验主要仪器如表2 所示。实际样品包括芹菜、苹果和毒芹碱菜均购于佛山市南海区大沥镇颜峰市场。
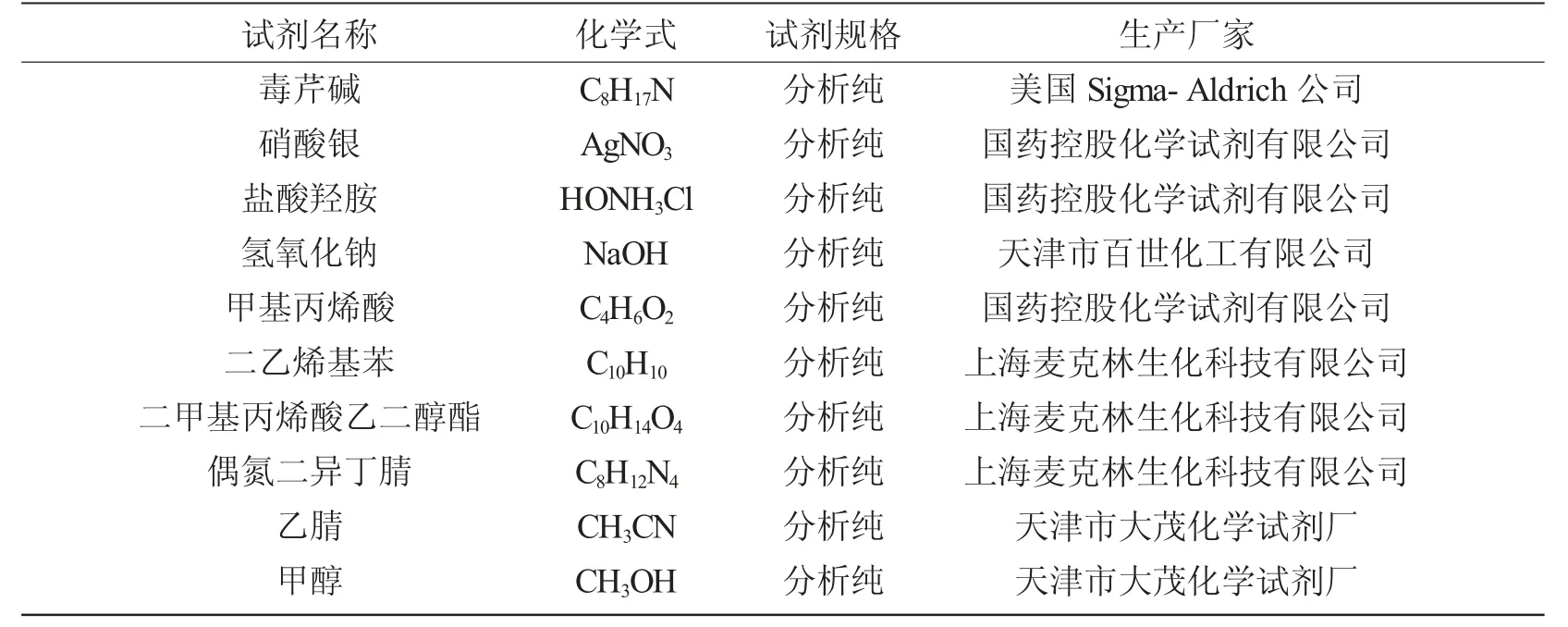
表1 实验试剂
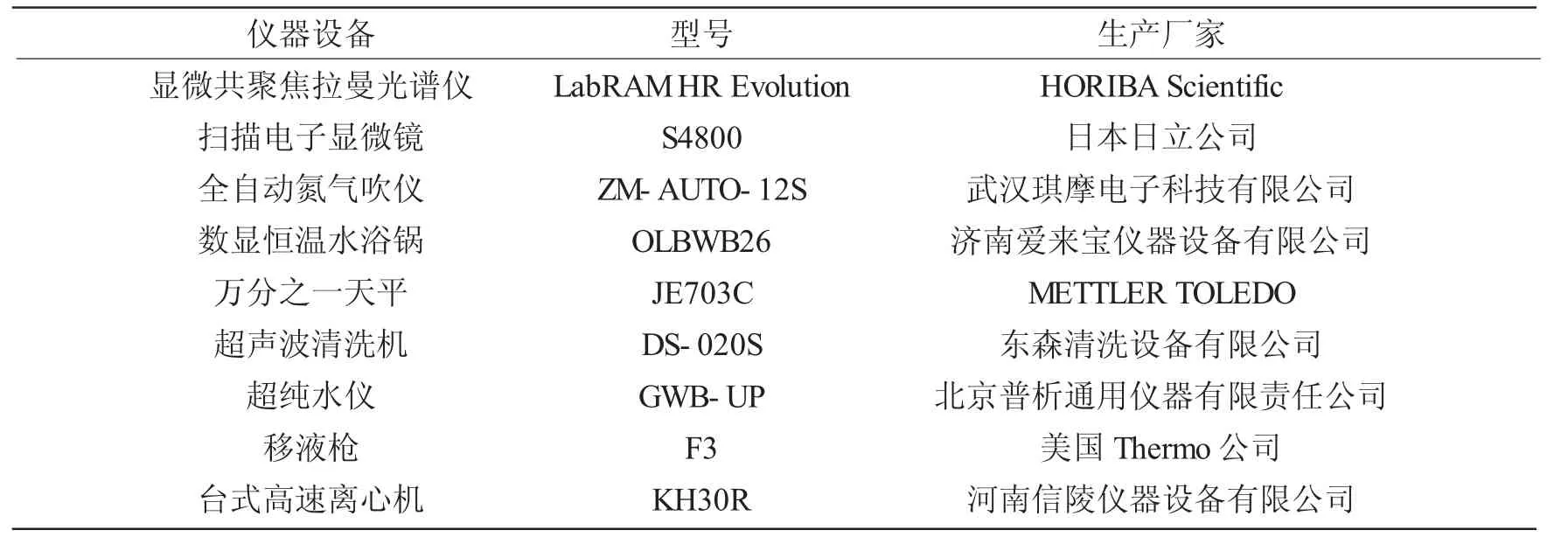
表2 实验仪器
1.2 实验过程
1.2.1 纳米银溶胶的配置
分别准确称取0.169 9±0.000 1 g 硝酸银固体,0.069 5±0.000 1 g 盐酸羟胺固体,0.400 0±0.000 1 g氢氧化钠固体,后转移至不同棕色容量瓶中加超纯水定稀释容至100 mL,从而获得0.01 mol/L 的硝酸银溶液,0.01 mol/L 的盐酸羟胺溶液以及0.1 mol/L 的氢氧化钠溶液。将上述配置所得的硝酸银溶液与盐酸羟胺溶液1∶1 混合,加入1 滴氢氧化钠溶液,摇匀后避光密封保存,注意纳米银溶胶应现配现用。
1.2.2 毒芹碱标准溶液的配置
毒芹碱1×10-1mol/L 标准溶液的配置:由于毒芹碱易溶于水,因此采用超纯水作为溶剂。使用万分之一天平准确称取0.012 7±0.000 1 g 毒芹碱固体,转移至洁净的带盖棕色试剂瓶内,加入1 ml 的超纯水,摇匀。继续用超纯水依次稀释至1×10-2mol/L~1×10-8mol/L,分别获得毒芹碱各浓度梯度标准溶液,密闭保存于棕色试剂瓶内,并放置于2~8 ℃冰箱内保存待用。
1.3 样品处理
将芹菜和苹果等样品洗净、擦干、破碎;继续在不同食品基质中分别加标5 μL 毒芹碱各浓度梯度标准溶液,充分混合后,用离心机以2 000 rpm 离心5 min,取上清液,密封避光保存待用。原始样品毒芹菜直接破碎,过滤后取汁液,密封避光保存,检测时直接使用即可。
1.4 分子印迹聚合物的制备
采用预组装共价印迹法,以0.01 mol/L 的毒芹碱为模板分子,加入10 mL 致孔剂(乙腈)和314 μL功能单体(甲基丙烯酸),振荡摇匀并超声分散15 min。随后加入配比为4∶1 的混合交联剂(二乙烯基苯、二甲基丙烯酸乙二醇酯)。然后加入6.2 mg 的引发剂(偶氮二异丁腈),充分混合并经5 min 超声分散,通入高纯氮气并后密封。在60~65 ℃恒温水浴中进行24 h 恒温热聚合反应。反应完成后,在4 000 rpm转速下离心2 min,再经0.45 μm 有机滤膜过滤,在60 ℃真空干燥箱中干燥8 h,得到白色粉末状的聚合物。继而,使用醋酸和甲醇(1∶9)作为索氏提取剂,对得到的聚合物进行索氏提取24 h,从聚合物中洗脱模板分子。并通过SERS 技术对已洗脱的聚合物进行拉曼信号检测,以确定其不含模板分子。采集已洗脱的高分子微粒,置于真空干燥箱中60 ℃干燥24 h,最终获得白色粉末状的毒芹碱分子印迹聚合物(Coniine-MIPs)。非分子印迹聚合物(Non-Molecularly Imprinted Polymers,NIPs)的合成过程相同,但未加入2 种模板分子。
1.5 扫描电镜表征
将分子印迹聚合物白色粉末制备成合适大小的样品,并在室温下干燥。将样品放置于扫描电镜(SEM)采样台上,使用金属导电胶将样品固定在SEM采样台上,使样品与SEM采样台接触并获得导电性。在观察过程中,可以适当调整SEM参数,以获取最佳的SEM图像。根据SEM图像和观察结果,对样品的形貌和结构进行分析。
1.6 表面增强拉曼光谱的采集
称取0.5 mg 所制得的Coniine-MIPs 溶于0.5 mL 各目标待检溶液,如毒芹碱各浓度梯度标准溶液,以及食品基质加标目标溶液和原始样品汁液等。将样品在室温下恒温振荡吸附1 h。然后将样品放入离心机中,并将转速设置为4 500 rpm,离心2 min,然后取底部的MIPs。使用超纯水将聚合物清洗3 次,以去除其表面的毒芹碱。继而将MIPs 置于干净的载玻片上,滴加足量的纳米银溶胶以完全覆盖样品,混合,避光反应1 h 后,使用拉曼仪进行检测,选择532 nm 激光波长,将激光强度设置为50%,激光照射光斑的直径为200 μm,光栅直径为500 nm,同时选用50 倍物镜共聚焦显微镜。在聚合物的10 个不同位置进行测量,并取平均值。
1.7 分子印迹聚合物吸附性能研究
1.7.1 静态吸附实验
配制一系列不同浓度的(0.0、0.3、0.6、0.9、1.2、1.5、1.8、2.1 mg·mL-1)毒芹碱溶液,准确称取3 mg 的MIPs 或NIPs 加入3 mL 上述标准溶液中,使用恒温振荡摇床在常温下避光振荡1 h。在4 500 rpm 转速下离心2 min,取上清液。使用紫外分光光度计对毒芹碱标准溶液在300~750 nm 波长下进行紫外扫描,记录毒芹碱的最大吸收波长为235 nm。并对吸附前一系列浓度溶液进行吸光度测量,绘制标准曲线,用于计算样品溶液中目标物质的浓度。测量吸附后溶液的吸光度,并计算出吸附前后溶液中目标物质的浓度差,通过公式(1)对吸附量进行计算,分析吸附实验前后溶液中目标物质量的变化。
式中,Qe为平衡时的吸附量(mg·g-1),C0为标准溶液的初始浓度(mg·mL-1),Ce为标准溶液的平衡浓度(mg·mL-1),V 为溶液体积(L),m 为吸附剂质量(g)。
1.7.2 动态吸附实验
配制3 mL 浓度为1.5 mg·mL-1的毒芹碱溶液,将3 mg 的Coniine-MIPs 分散到上述溶液中。样品在室温下避光振荡0、10、20、30、40、60、90 和120 min,然后在4 500 rpm 转速下离心2 min,取上清液。使用紫外分光光度计在235 nm 处测定目标生物碱的含量。根据公式(2)和(3)采用准一级动力学方程和准二级动力学方程,进一步对Coniine-MIPs 和Ricinine-MIPs 的吸附动力学进行研究。
式中,Qe为平衡时的吸附量(mg/g),Qt为时间t 的吸附量,K1和K2分别为伪一阶和二阶吸附过程的速率常数。
1.7.3 重复利用实验
准确称取3 mg 毒芹碱聚合物粉末,分散于3 mL 的毒芹碱1.5 mg·mL-1溶液中。置于恒温摇床在室温下避光摇匀1 h,在4 500 rpm 转速下离心2 min,取上清液,检测其吸附量。继而进行解附实验,即使用索氏提取法对已完成吸附实验的分子印迹聚合物进行目标模板分子洗脱24 h,通过SERS 技术检测已洗脱目标分子的聚合物,确定其不含模板分子。继续进行下1 次的吸附实验。对以上吸附-解附实验重复5 次,从而观察分子印迹材料的吸附变化情况及判断其使用稳定性。
2 结果讨论与分析
2.1 毒芹碱的理论拉曼光谱计算
基于密度泛函理论,采用B3LYP/6-31++G(d,p)基组对其结构进行优化,并计算了毒芹碱分子的振动频率[16]。优化后的毒芹碱空间结构如图2a 所示,毒芹碱分子主要由C-C、C-N、C-H 和N-H 等基团组成。无产生虚频现象,则优化后的毒芹碱分子结构为稳定结构[17]。运用密度泛函理论计算优化后的毒芹碱理论拉曼图谱与实际毒芹碱的SERS 图谱如图2b 所示。本研究在毒芹碱检测过程中发现,物质拉曼特征峰的拉曼强度过低或噪声过高都容易导致毒芹碱拉曼特征峰无法被有效的检出,因此本实验分析针对实验获得的SERS 图谱,运用KnowItAll 光谱解析软件中的拉曼光谱数据库,选择图谱中拉曼强度大于5%,噪声小于2%的拉曼峰作为毒芹碱的拉曼特征峰进行分析,有效确保了在后续实验及实际检测应用中毒芹碱的高检出率及高准确率。使用VEDA4 结合PED 对毒芹碱的分子振动归属进行计算,分析结果如表3 所示,毒芹碱分子振动模式主要包括3 种,分别为:伸缩振动(Stretching Vibration,STRE)、弯曲振动(Bending Vibration,BEND)以及扭转振动(Torsion Vibration,TORS)。确定毒芹碱的拉曼特征峰为:796 cm-1、1 012 cm-1、1037 cm-1、1 455 cm-1、2 869 cm-1、2 904 cm-1、2 935 cm-1和2 959 cm-1。分别 对 应理论特征峰808 cm-1、1 012 cm-1、1 037 cm-1、1 496 cm-1、3 000 cm-1、3 016 cm-1、3 032 cm-1和3 064 cm-1。实际峰与计算峰的峰型基本相符,但峰位和峰强度略有差异。产生该现象的原因为:在理论计算中,分子被认为是气态分子,忽略了分子间的作用力。然而,在实际实验中,纳米银颗粒会与样品相互吸附,引发诱导性反应,改变了样品分子内的电荷分布,从而导致分子振动模式和峰位的变化。

表3 毒芹碱分子振动归属计算结果
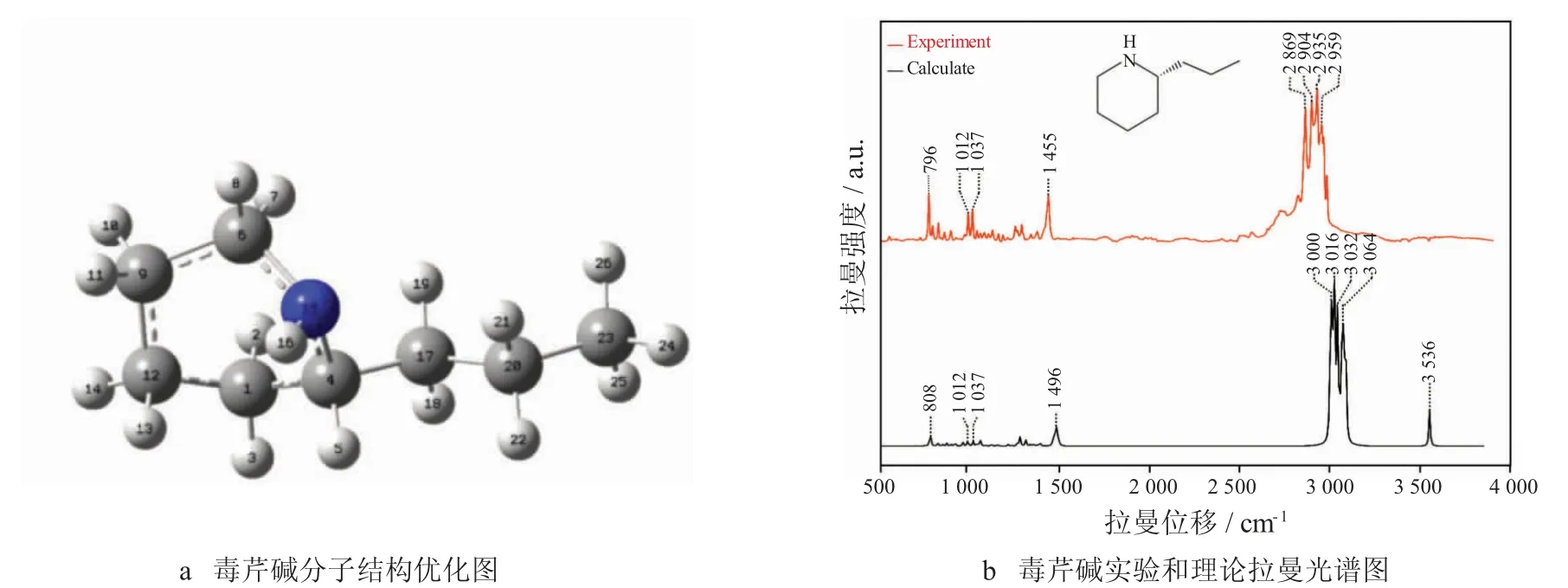
图2 芹碱分子结构优化图与毒芹碱实验和理论拉曼光谱图
2.2 分子印迹聚合物的表征
图3a 和3b 分别展示了毒芹碱分子印迹聚合物和空白非分子印迹聚合物在扫描电镜下的表面形貌。其中Coniine-MIPs 呈凹凸不平的粗糙球状,这可能与物质表面存在大量与模板分子的结合位点有关。NIPs 呈表面光滑球状。

图3 Coniine-MIPs 与NIPs 的扫描电镜图
2.3 分子印迹聚合物吸附性能研究
2.3.1 静态吸附实验结果
为了解吸附材料对目标吸附物质的亲和力,对Coniine-MIPs 以及NIPs 进行吸附容量及吸附率分析。吸附量通过公式(1)进行计算。图4 展示了Coniine-MIPs 和NIPs 的静态吸附曲线。实验结果显示,Coniine-MIPs 吸附量Qe 随着目标化合物的初始浓度增加而增加,当初始浓度达到1.5 mg·mL-1时,到达吸附平衡状态。最大吸附容量为1.4 mg·g-1,吸附率为95.3%。NIPs 随着目标化合物的初始浓度的增加,吸附量Qe缓慢增加,当浓度到达0.9 mg·mL-1时,到达吸附平衡状态,最大吸附容量为0.06 mg·g-1,吸附率为6.7%。说明Coniine-MIPs 具有良好的吸附能力,而NIPs 吸附能力极弱。
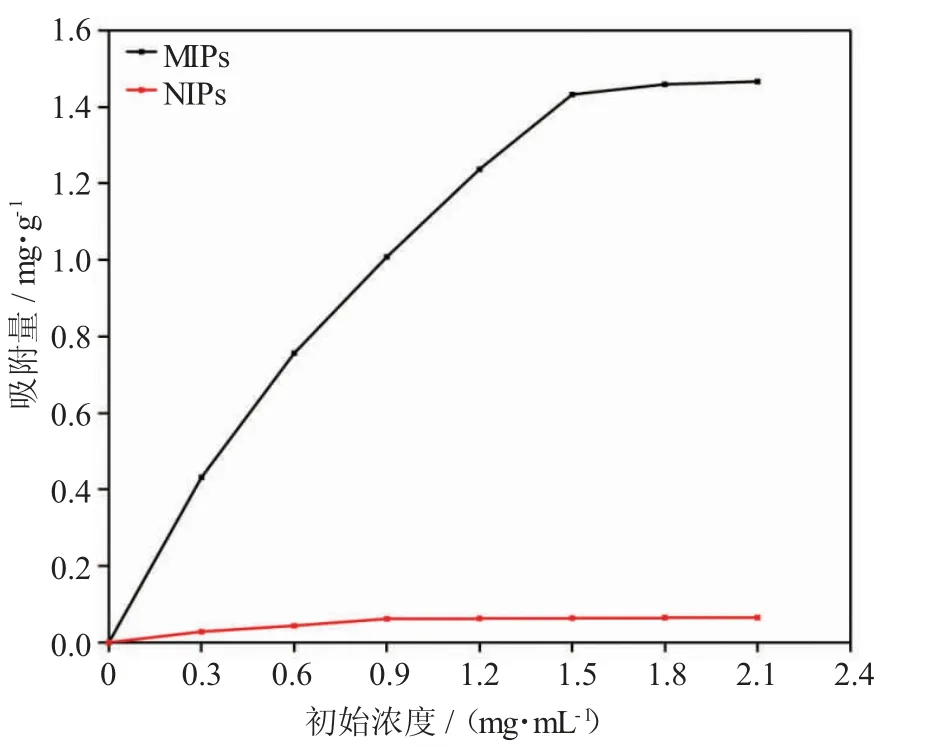
图4 Coniine-MIPs 的静态吸附曲线
2.3.2 动力学吸附分析
物质的吸附动力学可以反映待检分子在聚合物材料表面上的吸附速率、覆盖度等动力学参数。分子印迹聚合物的动态吸附曲线如图5a 所示,Coniine-MIPs 的吸附量均随溶液浓度的增加而增加,当时间到达60 min 时,吸附速率减缓,基本达到吸附平衡。继续使用准一级(2)和准二级(3)动力学方程式,进一步模拟Coniine-MIPs 对毒芹碱分子的吸附动力学过程。如图5b 所示,Coniine-MIPs 的准一级动力模型的R2值0.842 8,吸附速率常数K1为0.29 mg/g/min。准二级动力模型的R2分别为0.9245,吸附速率常数K2为0.25 mg/g/min。与准一级动力模型相比,准二级动力模型的Qe值更接近实验测量的吸附量。综上所述,准二级动力学模型更好地对实验数据进行了拟合,因此Coniine-MIPs 的吸附过程遵循准二级动力学机理,聚合物对目标模板分子的吸附是基于化学吸附的速率限制过程,更有效地预测了整个吸附行为。
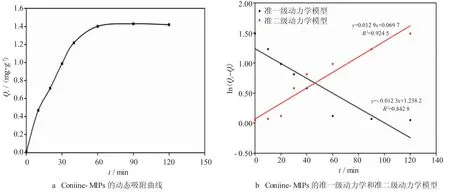
图5 Coniine-MIPs 的动态吸附曲线及准一级动力学和准二级动力学模型图
2.3.3 重复利用实验
Coniine-MIPs 的重复利用实验结果如图6 所示。以初次目标待检物的吸附量为标准对比,经5 次吸附-解附循环后,Coniine-MIPs 的吸附量虽然略微下降,但到达第5 次循环时,Coniine-MIPs 对目标待检物的吸附率仍有初始值的85%。意味着这种分子印迹聚合物的可重复使用次数至少在5 次以上,聚合物具备较高的使用稳定性。
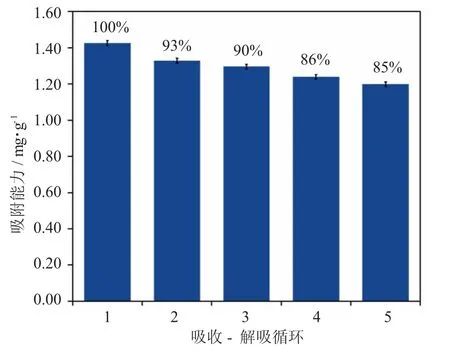
图6 Coniine-MIPs 的重复利用实验
2.3.4 光谱检测重现性结果
使用Coniine-MIPs 对1×10-4mol/L~1×10-8mol/L 各浓度梯度毒芹碱标准溶液进行模板分子的吸附,并进行SERS 检测,实验结果如图7 所示。毒芹碱的最低检出浓度为1×10-8mol/L,检出限为1.27 μg/L。图8 展示了吸附目标物质后的Coniine-MIPs 在2 869 cm-1检测位点的光谱重现性和RSD 值。在这些实验中,Coniine-MIPs 分别吸附了1×10-4mol/L~1×10-8mol/L 各浓度的毒芹碱标准溶液,并收集SERS 光谱。结果表明,2 869 cm-1检测位点的拉曼峰强的RSD 值在2.08%~6.47%之间。结果表明,吸附后的Coniine-MIPs 的拉曼光谱具有良好重现性。
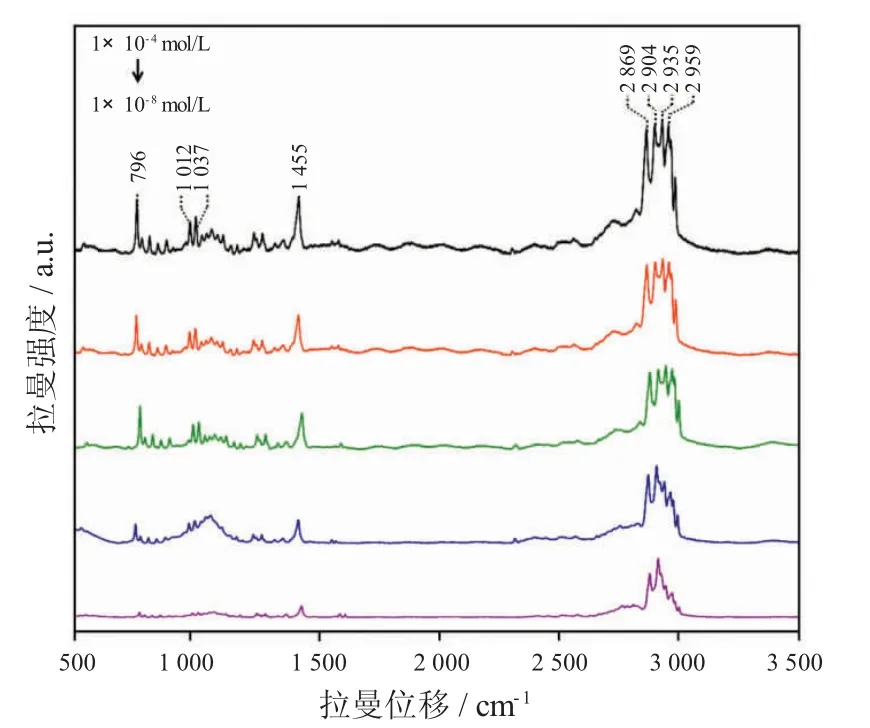
图7 Coniine-MIPs 吸附毒芹碱的标准溶液SERS 光谱
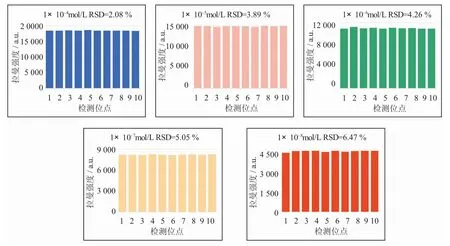
图8 计算吸附各浓度溶液的Coniine-MIPs 在2 869 cm-1 检测位点的拉曼峰强度和RSD 值
2.3.5 实际检测中的应用
为了验证SERS-MIT 技术的检测稳定性,分别对加入毒芹碱标准溶液的苹果和芹菜样品以及毒芹菜样品进行检测。结果如图9a~9c 所示,从图中可明显的看出Coniine-MIPs 能有效吸附苹果和芹菜基质中的毒芹碱分子,且通过SERS 技术能采集到毒芹碱分子位于796 cm-1、1 012 cm-1、1 037 cm-1、1 455 cm-1、2 869 cm-1、2 904 cm-1、2 935 cm-1和2 959 cm-1处的8 个拉曼特征峰,并能有效采集加标1×10-6mol/L 毒芹碱标准溶液的苹果和芹菜样品的SERS 光谱Coniine-MIPs 对毒芹菜中目标分子进行了有效的特异性吸附,并通过SERS 技术分别准确检出了归属于毒芹碱的8 个拉曼特征峰。
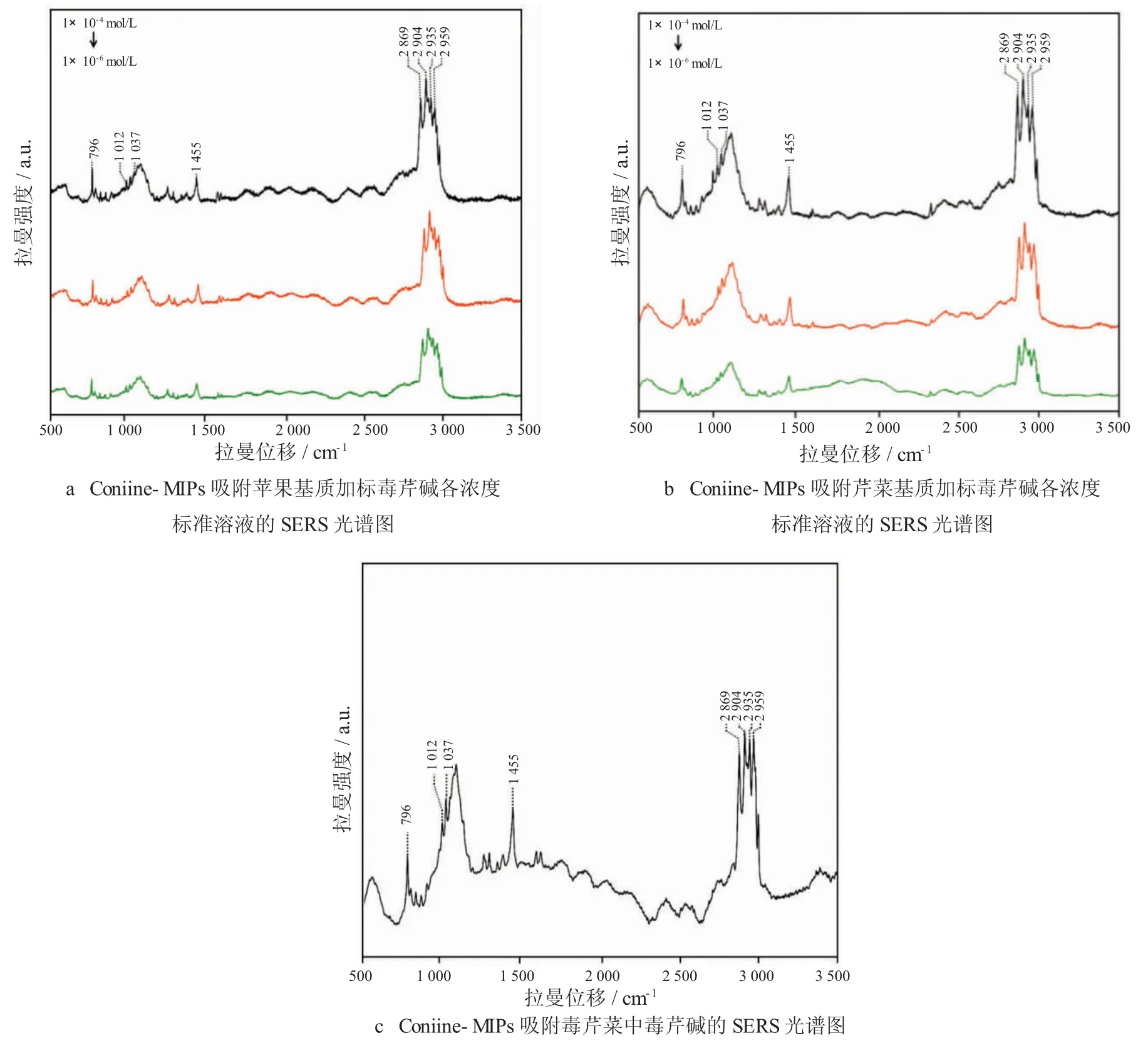
图9 Coniine-MIPs 吸附苹果基质和芹菜基质加标毒芹碱各浓度标准溶液的SERS 光谱图以及Coniine-MIPs 吸附毒芹菜中毒芹碱的SERS 光谱图
3 结论与展望
有毒生物碱引起的食源性疾病是全球性的卫生安全问题。由于有毒生物碱在检测中具有含量低、毒性大的特点,加之食品基质组分复杂,给准确检测带来了困难。因此目标生物碱的有效分离和灵敏检测逐渐成为研究的热点和难点。本研究就上述问题,以毒芹碱为例,构建SERS-MIT 联用检测法。使用盐酸羟胺还原硝酸银法制备高灵敏度SERS 增强基底。采用预组装共价印迹法制备毒芹碱的分子印迹聚合物及非分子印迹聚合物,通过SEM表征获悉了MIPs 为表面具有大量与模板分子结合位点的粗糙球状物质,NIPs 为较为光滑的球状体;Coniine-MIPs 对毒芹碱的最大吸附容量为1.43 mg·g-1,吸附率为95.3%;而NIPs 的最大吸附容量为0.06 mg·g-1,吸附率为6.7%,表明NIPs 吸附能力极弱。动态吸附实验结果显示,Coniine-MIPs 吸附过程遵循准二级动力学机理,聚合物对目标模板分子的吸附是基于化学吸附的速率限制过程;重复利用实验结果显示,到达第5 次循环时,Coniine-MIPs 的吸附率仍有初始值的85%,至少可重复使用5 次以上。实际应用检测结果显示,Coniine-MIPs 对毒芹碱标准溶液的最低检出浓度为1×10-8mol/L。2 869 cm-1检测位点的拉曼峰强的RSD 值在2.08 %~6.47 %之间。表明SERS-MIT 联用技术检测毒芹碱分子的拉曼光谱具备良好灵敏度及重现性;SERS-MIT 联用检测技术能有效地对毒芹菜中的毒芹碱进行效吸附,并能通过SERS 检测采集到完整的毒芹碱分子拉曼特征峰。以上实验结果表明,SERS-MIT 联用技术检测毒芹碱具有较好的吸附和检测能力以及良好的灵敏度和准确性。SERS-MIT 联用技术实现了对复杂基质中目标生物碱的特异性吸附以及稳定性检测。解决了有毒生物碱检测的安全性及高效性问题。这项技术的成功应用,将有助于提高含有毒生物碱植物的检测和鉴别能力,对于保障食品安全和人们健康具有重要的意义。

