高温胁迫下陆地棉GhCIPK6转基因后代生理生化分析
王 辉,郭金成,宋 佳,张庭军,何良荣
(1.塔里木大学农学院,新疆阿拉尔 843300;2.新疆生产建设兵团第六师农业科学研究所,新疆五家渠 831300)
0 引 言
【研究意义】高温胁迫造成作物的经济损失越来越严重[1]。预计全球气温每10年将上升0.2℃[2]。植物的生长和发育过程受到高温(HT)胁迫的严重影响[3,4]。高温会导致作物的光合作用等生理活动受到严重影响,并影响植株的正常生长和发育,是作物减产的主要影响因素[5]。【前人研究进展】在高温胁迫下,一般先受到破坏的是细胞质膜的结构和功能[6]。高温影响细胞膜的稳定性,气体交换(光合作用、光呼吸作用、蒸腾作用、气孔导度)及相关酶的活性[7]。植物细胞在高温逆境下利用多种方式产生活性氧造成氧化胁迫,但一定程度的高温胁迫往往会促使产生较高水平的耐热性,但当高温胁迫超出一定范围后,活性氧生成速率加快,与此同时非酶性清除剂含量不断减少、活性氧酶性消除系统活性也在不断降低,这样就导致大量活性氧不能被有效清除,进而造成氧化伤害[8]。【本研究切入点】植物体内的存在的一类微量植物激素,如脱落酸(Abscisic acid,ABA)、生长素(Auxin,IAA),水杨酸(Salicylic acid,SA)、茉莉酸(Jasmonic acid,JA)等。植物受到逆境胁迫时,体内的激素发生变化,通过影响植物的生理生化活动来产生抵御胁迫的能力[9]。需开展关于植物对热胁迫的响应和防御方面的研究,了解陆地棉在生理生化水平上对高温胁迫的响应机理和抵御机制。【拟解决的关键问题】选择转基因材料超表达和、RNAi和野生型材料,测定3种材料测定不同时间、不同环境下生理生化指标变化,为研究陆地棉抗高温分子机理提供理论基础。
1 材料与方法
1.1 材 料
材料为陆地棉品系YZ1,由华中农业大学育种实验室构建GHCIPK6超表达和RNAi载体,遗传转化棉花品系YZ1,分别得到超表达和干涉的转基因纯系。RN代表正常温度RNA干涉材料,RH代表高温RNA干涉材料;WN代表正常温度野生型材料,WH代表高温野生型材料;ON代表正常温度超表达材料,OH代表高温超表达材料。
1.2 方 法
1.2.1 试验设计
将棉花材料每株系种植90株以上,培养室中培养,培养条件设定为相对湿度RH=80%,光周期14 h/10 h 白天/夜晚,光密度500 μmol/(m2·S),全程充分供水。待植株长大到第6周,将棉花植株转入生长箱中。对照组生长条件保持不变,处理组42℃热胁迫24 h,在26℃恢复24 h,处理及对照组分别于4、12、24和48 h取样,每个时间点分2个生物学重复,每个重复5株幼苗。
1.2.2 测定指标
1.2.2.1 光合特性
使用美国LI-COR公司生产的Li-6400XT便携式光合作用测量系统测定正常温度和高温下不同时间段棉花幼苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、细胞间CO2浓度(Ci),使用SPAD测定仪(SPAD-502PLUS)测定叶绿素相对含量。
1.2.2.2 抗性相关
丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[10],过氧化物酶(POD)活性测定采用愈创木酚显色法,可溶性蛋白含量的测定采用考马斯亮蓝染色法,脯氨酸(Pro)的测定方法采用茚三酮显色法[11],超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)比色法[12]。
1.2.2.3 植物激素
激素测定所用的仪器为液质联用系统4000 Q-TRAR LC-MS(Applied Biosystems,USA)
1.3 数据处理
数据分析用WPS office Excel软件,采用统计软件DPS进行单因素方差分析及数据显著性检验和SPSS 21分析数据。
采用主成分分析对试验中各个时期的14个相关生理指标平均值进行综合评价。根据各主成分的得分,及各主成分的方差贡献率为权数,对所提取的得分进行加权求和,得到各材料高温下的综合得分。
2 结果与分析
2.1 高温胁迫下陆地棉幼苗叶片比较
研究表明,4 h时,在正常温度26℃下,3种材料幼苗叶片正常生长,无任何变化,在高温42℃下,超表达第1片真叶和第2片真叶明显下垂枯萎,第3片真叶也出现下垂,RNAi和野生型第1片真叶和第2片真叶下垂不明显,第3片真叶无变化。在48 h时,取下对照温度和高温的叶片,进行比较,超表达叶片已经发黄,叶片上已出现大量斑点,野生型叶片发黄程度次之,RNAi叶片只轻微发黄。图1

注:A、B分别代表4 h正长温度和高温幼苗,C代表48 h幼苗叶片
2.2 高温胁迫下陆地棉光合特性
2.2.1 高温胁迫下陆地棉净光合速率(Pn)变化
研究表明,光合作用是棉花生长发育必要条件,也是增加产量的必要因素,而净光合速率是光合作用的最直接体现。在4 h,野生型进行光合速率快,而超表达材料较慢;在12 h,三者均在正常温度下进行光合速率快,高温下较慢;在24 h,三者在正常温度下进行光合速率大于三者高温下,其中超表达高温光合速率能力最低,在48 h,野生型正常温度和高温下不显著,RNAi在高温下与正常温度下达到显著,超表达在正常温度和高温下光合速率能力低。超表达相对其他两种材料,光合速率较慢。图2
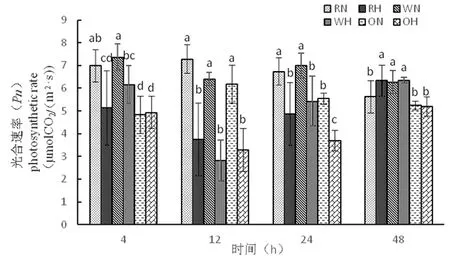
注:不同小写字母表示差异显著(P<0.05),下同
2.2.2 高温胁迫下陆地棉气孔导度(Gs)的变化
研究表明,气孔的保卫细胞受到外界环境的刺激能迅速做出反应,在高温胁迫下,植物气孔的保卫细胞产生应激反应打开气孔,CO2进入植物的量增多,从而导致叶片光合速率增加。超表达材料在整个时期气孔导度能力很低,在12 h时,3种材料气孔导度在高温下达到最低,气孔关闭,随着胁迫时间延长,气孔导度逐渐增大,在胁迫超过一定时间,气孔打开,光合速率增加,光合作用增强。超表达材料相对其他两种材料,气孔导度减弱,超表达材料进行光合作用能力差。图3
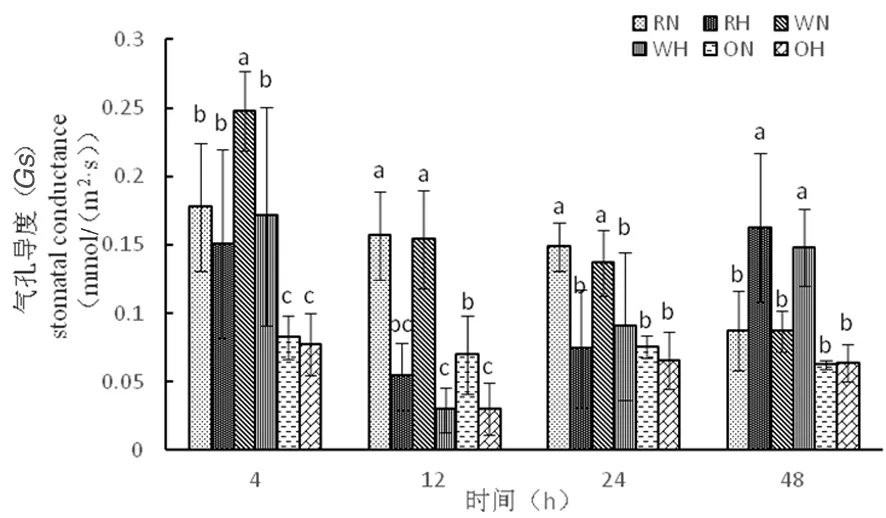
图3 高温胁迫下气孔导度的变化
2.2.3 高温胁迫下陆地棉蒸腾速率(Tr)的变化
研究表明,蒸腾作用能够对外界环境做出反应来进行自我保护,在一定温度下,蒸腾作用可降低叶片温度,降低水分散失,增强对矿物质的吸收。在正常温度下12 h时,RNAi株系的蒸腾速率为1.33 mmolH2O/(m2·s),野生型株系蒸腾速率为1.14 mmolH2O/(m2·s),而高温下,RNAi蒸腾速率为0.64 mmolH2O/(m2·s),野生型株系蒸腾速率为0.35 mmolH2O/(m2·s);48 h时,高温处理下各材料蒸腾速率加快,RNAi为1.64 mmolH2O/(m2·s),野生型为1.42 mmolH2O/(m2·s),正常温度下蒸腾速率减慢,RNAi为0.84 mmolH2O/(m2·s),野生型为0.68 mmolH2O/(m2·s)。高温处理下,随着时间延长,蒸腾速率增加,可以降低叶片温度,减少水分散失,增强对矿物质的吸收。超表达株系从4 h到48 h先降低在增加,在整个时期蒸腾速率缓慢。图4
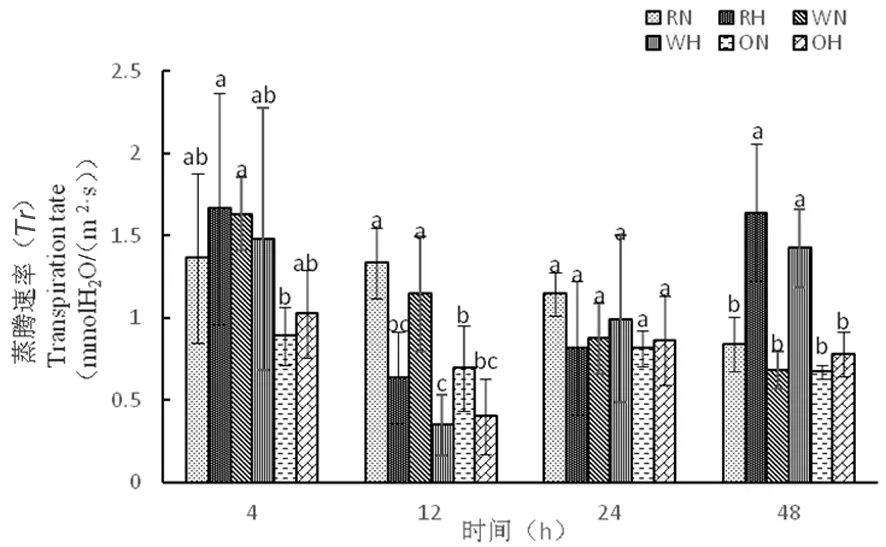
图4 高温胁迫下蒸腾速率的变化
2.2.4 高温胁迫下陆地棉细胞间CO2浓度(Ci)的变化
研究表明,从4 h到12 h时,RH由303 μmol/mol下降到298 μmol/mol,WH由280 μmol/mol下降到262 μmol/mol,RNAi干扰株系和野生型株系胞间CO2浓度在高温下并没有急剧下降,气孔导度下降,净光合速率下降的主要因素并不是气孔闭合,而超表达株系(4 h到12 h时)在高温下急剧下降,OH由248 μmol/mol下降到199 μmol/mol,高温下超表达株系敏感性强。图5
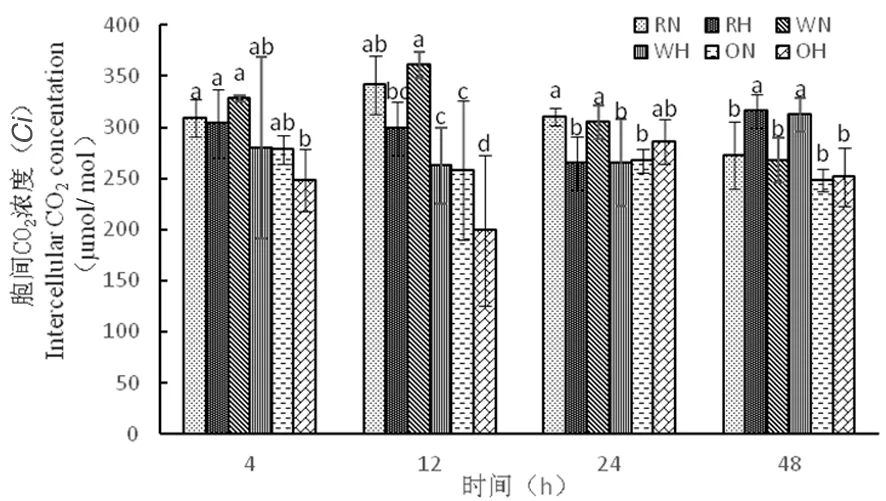
图5 高温胁迫下胞间CO2浓度的变化
2.2.5 高温胁迫下陆地棉叶绿素相对含量(SPAD)的变化
研究表明,随着时间延长,3种株系的叶绿素含量变化较小,其中RH叶绿素含量为30.5、30.1、30.3、34.1,WH叶绿素含量为29.5、30.3、30.3、32.9,OH叶绿素含量为28.2、27.8、27.6、29.3,在高温胁迫下,SPAD值不会受温度影响仍能保持高含量,从而进行光合作用。图6
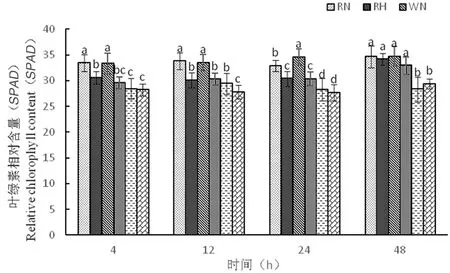
图6 高温胁迫下叶绿素相对含量的变化
2.3 高温胁迫下陆地棉抗性
2.3.1 高温胁迫下陆地棉丙二醛(MDA)的变化
研究表明,在正常温度下,3种株系随着时间延长,丙二醛含量呈先增加再降低后增加。在高温下,随着时间延长,RNAi干扰株系中丙二醛含量呈先增加后下降,野生型株系中丙二醛含量呈逐渐缓慢增加,而超表达株系丙二醛含量逐渐增加,其中48 h时达到最大为0.06 μmol/g,超表达株系在高温胁迫下对膜造成的伤害大,对棉花细胞活力起到抑制作用。图7
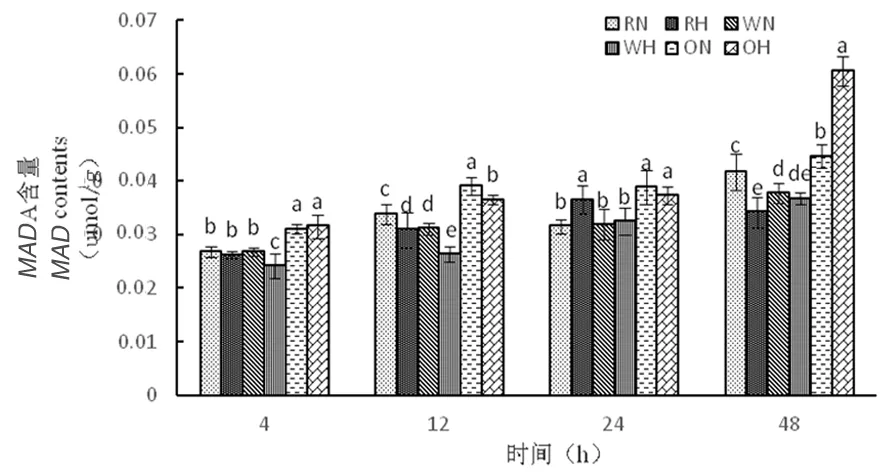
图7 高温胁迫下MDA含量的变化
2.3.2 高温胁迫下陆地棉氧化物酶(SOD)、超氧化物歧化酶(POD)的变化
研究表明,在正常温度下,RNAi干扰株系和野生型株系SOD活性相对较高,超表达株系中SOD活性先降低后增加。在高温下,随着时间延长,RNAi干扰株系中SOD活性呈先增加后下降,野生型株系和超表达株系中SOD活性呈先降低再上升后降低,超表达株系在整个时期都相对较低,分别为3.1、1.8、2.9、2.3 μ/mg,在正常温度下,RNAi干扰株系和野生型株系中SOD活性对于清除自由基能力较强保护膜质过氧化,在高温下,超表达株系中SOD活性对于清除自由基能力较差,未能减轻细胞膜的损坏。图8

图8 高温胁迫下SOD活性的变化
在正常温度下,3种株系POD活性随时间延长逐渐增加,其中超表达株系POD活性在整个时期含量较高。在高温下,RNAi干扰株系和野生型株系随着时间延长,SOD活性趋于平衡,而在超表达株系在整个时期都达到最大值,分别为222、239、199、220 μ/(mg·FW),超表达株系通过提高POD活性来应对热胁迫。受到高温胁迫,在整个时期超表达株系SOD活性较低,而POD活性较高,在应对高温环境SOD、POD表现出不同的变化,发挥自身功能,应对高温胁迫表现出不同的作用。图9
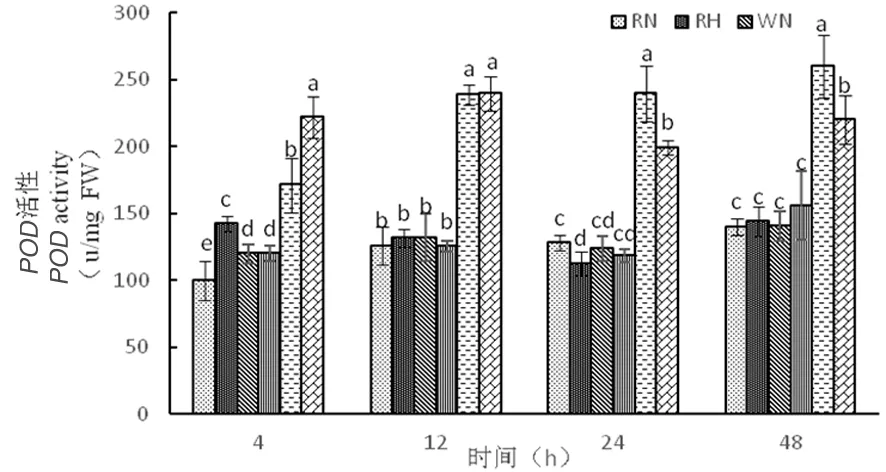
图9 高温胁迫下POD活性的变化
2.3.3 高温胁迫下陆地棉可溶性蛋白的变化
研究表明,3种株系在正常温度下可溶性蛋白含量相对较低,在48 h达到了最低,RN为0.71 mg/g,WN为0.88 mg/g,ON为1.38 mg/g。而在高温下,随着时间延长,RNAi干扰株系中可溶性蛋白含量呈先降低后增加,分别为5.87、3.95、2.87、4.49 mg/g,野生型株系可溶性蛋白含量先增加再降低后增加,分别为5.02、7.28、2.40、6.70 mg/g,超表达株系中可溶性蛋白含量呈先增加后降低,分别为4.99、5.15、6.30、5.68 mg/g,在高温诱导下,可溶性蛋白含量较高。图10
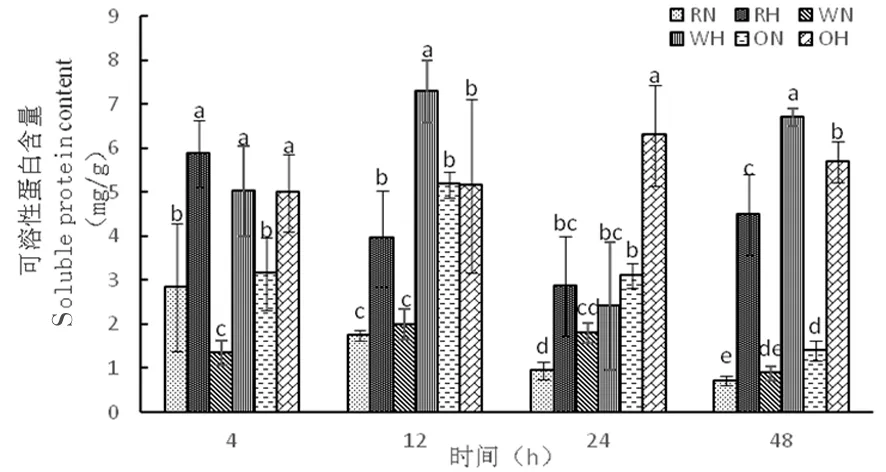
图10 高温胁迫下可溶性蛋白含量的变化
2.3.4 高温胁迫下陆地棉脯氨酸(Pro)的变化
研究表明,在正常温度下,3种株系的脯氨酸含量随着时间延长逐渐增加,而在高温下,野生型株系和超表达株系脯氨酸含量从4~12 h缓慢上升,12~48 h下降,RNAi干扰株系的脯氨酸含量随着时间逐渐降低,超表达株系在整个时期脯氨酸含量相对较高,分别为34.32、36.39、34.91、30.97 μg/g,热胁迫对超表达株系造成严重伤害,从而通过脯氨酸含量的积累应对逆境。图11
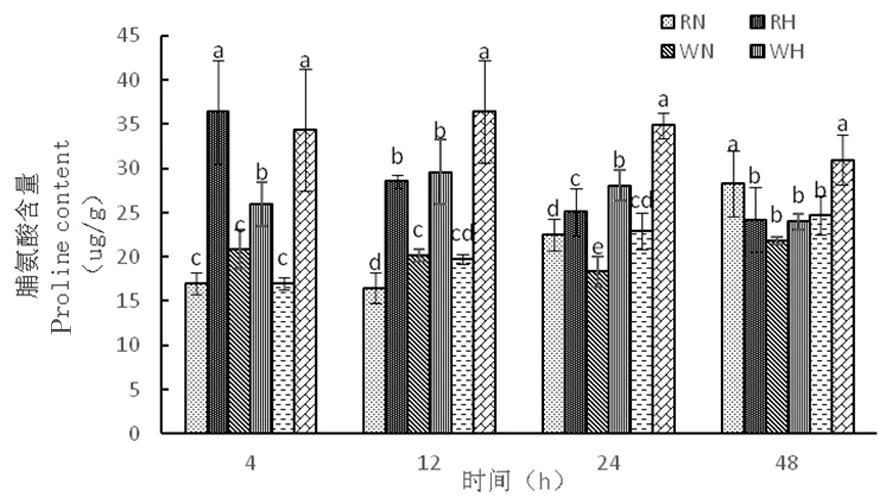
图11 高温胁迫下脯氨酸含量的变化
2.4 高温胁迫下陆地棉植物激素
2.4.1 高温胁迫下陆地棉生长素(IAA)的变化
研究表明,在正常温度下,RNAi干扰株系和野生型株系随着时间延长生长素含量趋于平衡,超表达株系中生长素含量逐渐上升。在高温下,RNAi干扰株系中生长素含量呈先下降后上升,变化为7.59、7.02、9.20、10.31 ng/g,野生型株系W中生长素含量呈先上升后下降,变化为6.77、7.06、10.53、7.86 ng/g,超表达株系OE中生长素含量逐渐升高,变化为6.83、8.19、9.28、9.70 ng/g。随着时间延长,生长素不受高温影响,能够抵御高温环境。RNAi干扰株系和超表达株系随着时间延长体内生长素含量逐渐增加。图12
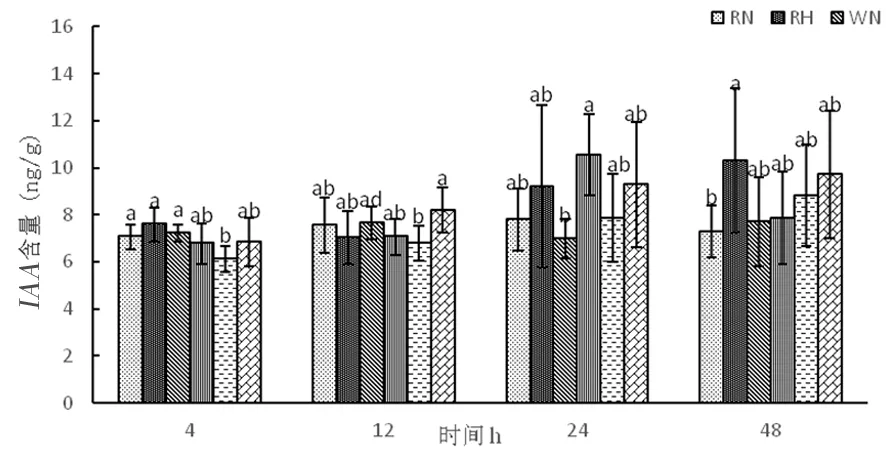
图12 高温胁迫下生长素含量的变化
2.4.2 高温胁迫下陆地棉脱落酸(ABA)的变化
研究表明,正常温度下,3种株系在整个时期脱落酸含量呈现先增加在下降。高温下,超表达株系和野生型株系随着时间延长,脱落酸含量先增加再下降后上升,野生型株系上升的幅度较大,超表达株系则上升幅度较小,而RNAi干扰株系脱落酸含量先增加后下降。超表达株系在整个时期脱落酸含量相对较低,常温处理4个时间段分别为84.80、148.68、94.45、126.64 ng/g,而高温处理时分别为165.71、195.34、147.47、162.46。高温胁迫时,超表达株系OE中的脱落酸因未能迅速做出反应来提高植物抗性。图13
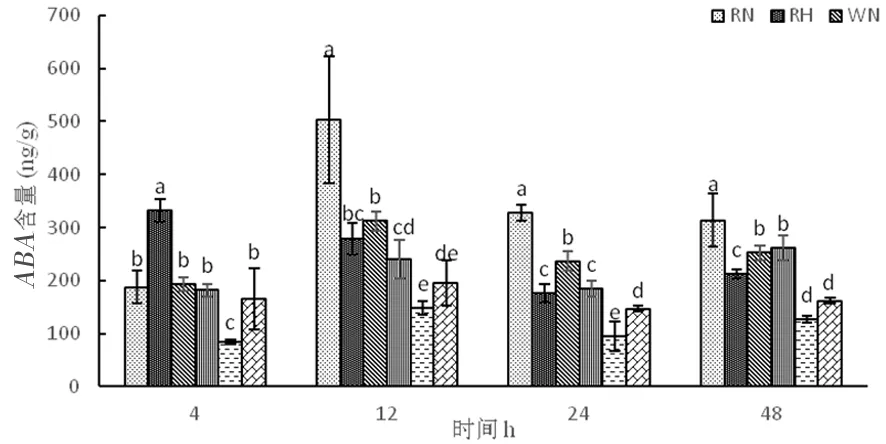
图13 高温胁迫下脱落酸含量的变化
2.4.3 高温胁迫下陆地棉茉莉酸(JA)的变化
研究表明,正常温度下随着时间延长,野生型株系中茉莉酸含量呈先增加后下降,RNAi干扰株系中茉莉酸含量逐渐增加,超表达株系茉莉酸含量先增加再下降后上升。高温下,3种株系随着时间延长体内茉莉酸含量呈现先增加后下降。图14
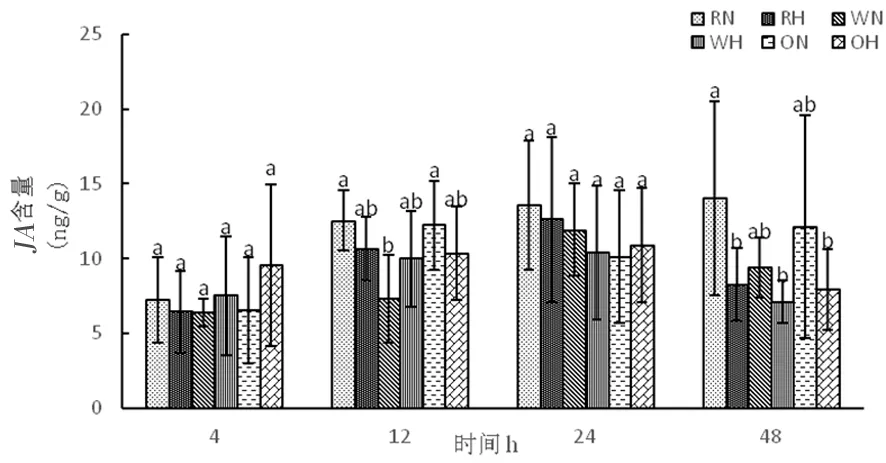
图14 高温胁迫下茉莉酸含量的变化
2.4.4 高温胁迫下陆地棉水杨酸(SA)的变化
研究表明,正常温度下,3种株系随着时间延长水杨酸含量呈先上升再下降后上升,在整个时期,超表达株系OE中水杨酸变化幅度较为明显,分别为22.56、94.16、31.54、37.60 ng/g,其中在12 h达到最大值。高温下,RNAi干扰株系和野生型株系中水杨酸含量呈先下降再上升后下降,RNAi分别为19.10、12.41、53.33、23.24 ng/g,野生型W分别为18.50、13.91、37.93、19.10 ng/g,超表达株系高温胁迫中水杨酸含量呈先上升后下降,分别为33.19、40.51、48.42、20.21 ng/g。高温胁迫前期,超表达株系可以通过增加水杨酸含量来实现对植物抗逆保护,但48 h下降为20.21 ng/g,保护作用下降。图15
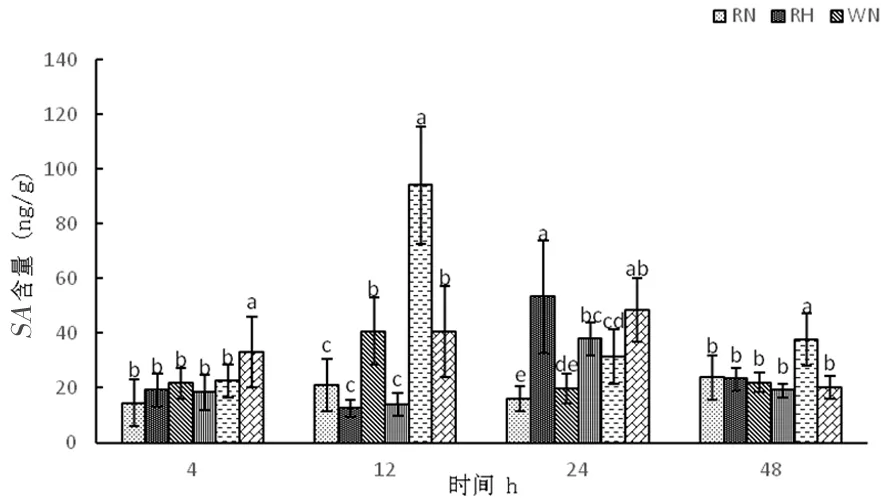
图15 高温胁迫下水杨酸含量的变化
2.5 高温胁迫下陆地棉综合评价
研究表明,得到各植物种测定指标成分的特征值、贡献率和累计贡献率,得到4个主成分可以解释全部方差的84.587%,提取前4个主成分可以代表14个高温下指标信息的84.94%。在第1主成分分析中,光合作用指标的贡献率较大,其中蒸腾速率最大,过氧化物酶最低;第2主成分分析中,生长素的贡献率较大,水杨酸次之;在第3主成分分析中,丙二醛含量的贡献率最大;第4主成分分析中,脯氨酸含量的贡献率最大。蒸腾速率可视为反映植物抗高温性能的最重要生理生化指标,其次是生长素含量、丙二醛含量和脯氨酸含量。表1
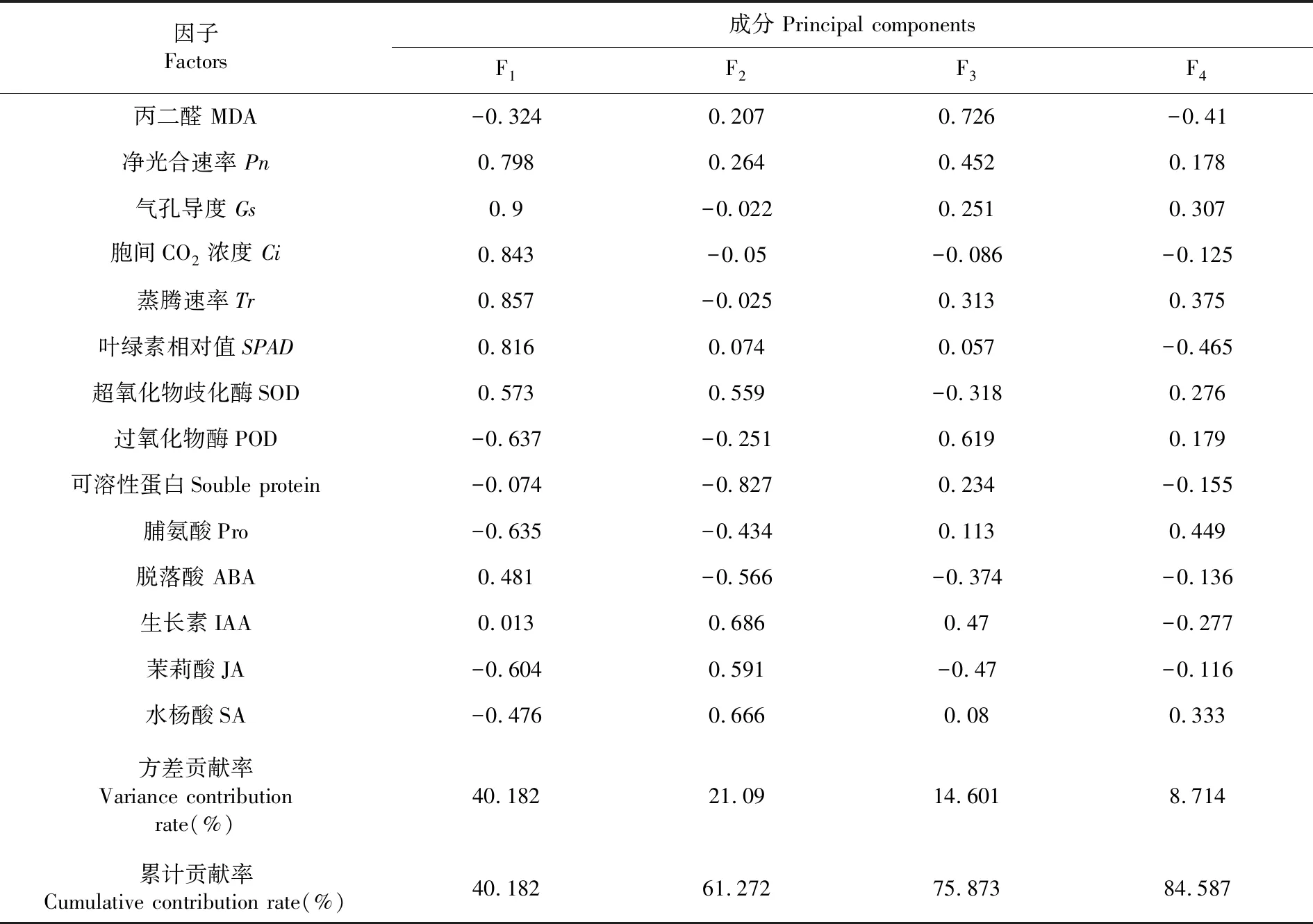
表1 主成分因子载荷矩阵及主成分特征根
排序排在前3的是RNAi中的48 h,野生型的48 h和4 h,3种材料抗高温能力由强到弱为:RNAi,野生型,超表达,RNAi综合得分为0.201,野生型综合得分为0.135,超表达综合得分为-0.337。表2
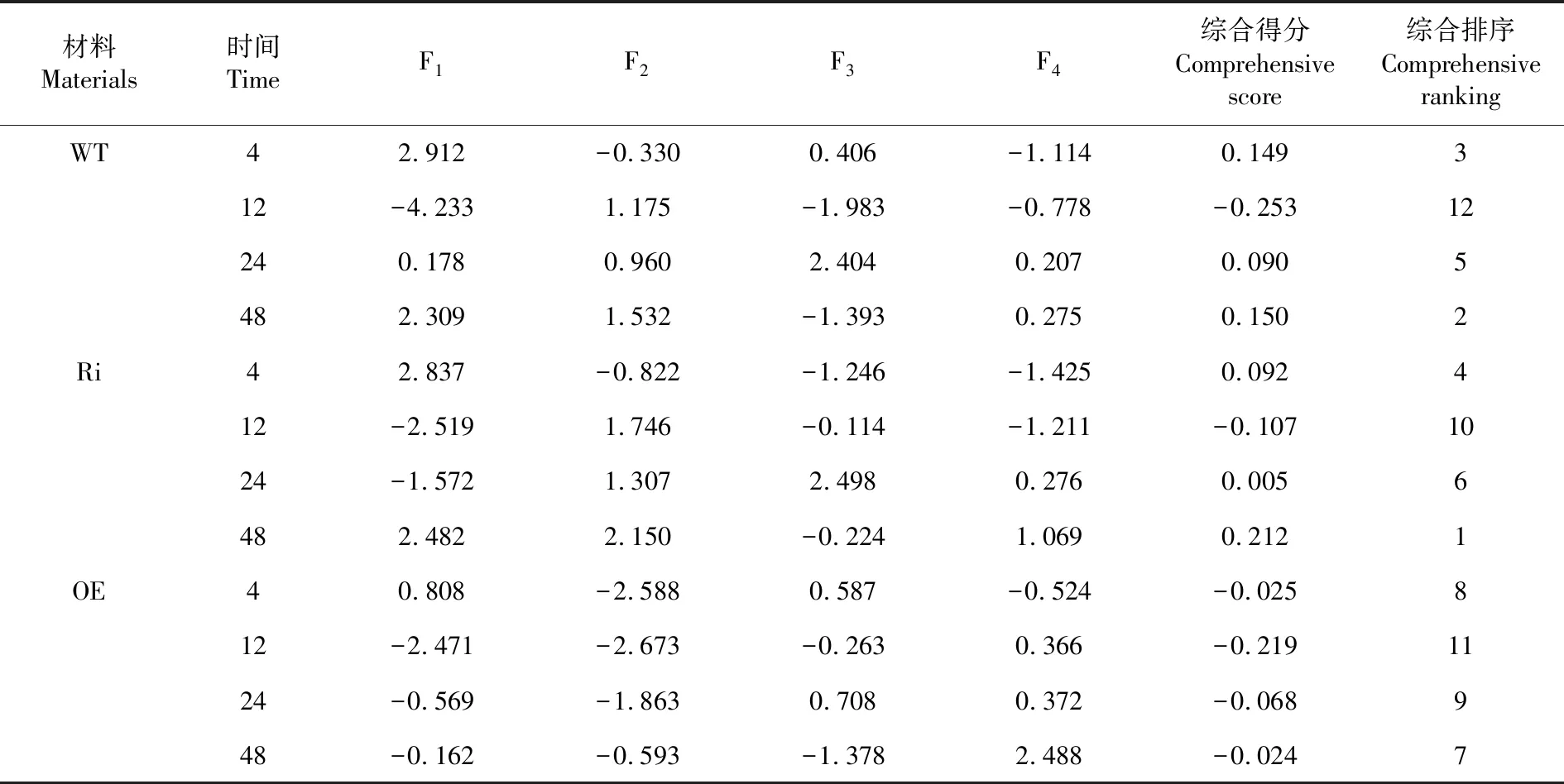
表2 主成分得分及综合评价
3 讨 论
3.1 高温胁迫对陆地棉光合特性的影响
气孔是植物与环境进行物质交换的通道,气孔通过调节其开闭状态,控制着CO2进入植物体内及水分从体内的散失[13]。可溶性蛋白具有渗透调节的作用,还能够在一定程度防止细胞质脱水[14]。脯氨酸具有调节渗透及保护细胞结构稳定的作用[15]。脱落酸具有促进植物休眠、抑制生长、促进气孔关闭和增加抗逆的作用[16]。茉莉酸作为一种重要的新型植物内源激素,通过信号传递来调控植物防御反应和抗逆发挥着重要作用[17]。水杨酸作为植物产生系统获得性抗性的内源信号, 当植物受到非生物因素影响时, 植物体局部水杨酸含量增加,促进抗逆蛋白合成、提高渗透调节能力和抗氧化能力,并伴有一些防卫相关蛋白的表达[18]。光合作用是一切生物直接或间接的能量来源,是植物进行物质转换和能量代谢的关键[19]。引起植物净光合速率下降的原因主要分为气孔因素和非气孔因素,气孔限制因素引起的Pn下降表现为Gs、Ci、Tr的下降,非气孔限制因素引起的Pn下降表现为Tr、Gs下降的同时Ci升高[20,21]。研究中随着时间延长净光合速率Pn呈先下降后上升的同时气孔导度Gs、蒸腾速率Tr、细胞间CO2浓度Ci均也呈先下降后上升,Pn的变化是由气孔限制因素所导致的,与窦飞飞[22]结论一致。
3.2 高温胁迫对陆地棉光抗性相关的影响
在高温下,RNAi氧化物酶呈先上升后下降,而超表达和野生型材料先下降再上升后下降,随着时间延长,体内的氧化物酶都在下降,可能导致酶活性下降,也有相关研究在马铃薯和大白菜中发现同样的规律[23,24]。超氧化歧化酶活性与氧化物酶活性不同,RNAi和野生型材料在高温下大致趋于平衡,可能由于超氧化歧化酶活性不受环境影响,在高温下对植物进行保护,而超表达材料超氧化歧化酶活性异常显著,敏感性材料会大量产生超氧化歧化酶。3种材料随着时间延长,体内丙二醛含量逐渐增加,其中超表达材料在48 h丙二醛含量达到最大值,且不同材料耐热性存在显著差异,与王倩[25]研究结论相似。脯氨酸具有阻止细胞膜透性的作用,在高温胁迫下,随着时间延长,脯氨酸含量逐渐降低,与前人研究结果相反,随着时间延长,脯氨酸调节细胞渗透的功能下降,抗热胁迫能力减弱。在温度胁迫下,植物体内通过提高可溶性蛋白含量来增强本身的抗逆性[26],研究3种材料在高温下,可溶性蛋白含量在整个时期相对较高,可溶性蛋白遇到高温诱导产生热激蛋白来增加植物的的抗逆性。
3.3 高温胁迫对陆地棉植物激素的影响
植物内源激素在植物应对环境变化时起重要作用,内源激素水平、合成和分布会受温度的影响而发生改变,多种植物内源激素参与植物应对逆境胁迫时的信号转导[27]。在高温下,RNAi和超表达材料生长素含量相对呈上升趋势,提升植物耐受性,与王日明[28]研究结果相似,野生型材料生长素含量随着时间延长呈现先上升后下降,说明野生型抗热性差。杨长琴等[29]研究结果显示高温胁迫下棉花叶片中ABA含量随着时间的延长呈先升后降的趋势,研究在高温下,超表达和野生型材料随着时间延长脱落酸含量呈先上升再下降后上升,RNAi材料随着时间延长,脱落酸含量先上升后下降,植物不一定总是通过提高ABA水平来抵抗高温胁迫。随着高温胁迫时间的延长,3种材料茉莉酸含量先升后下降,与宋悦[30]研究结果相似。RNAi和野生型材料在高温下,随着时间延长水杨酸含量呈先下降再上升后下降,超表达随着时间延长先上升后下降,可能由于前期水杨酸促进抗逆蛋白合成来增加抗逆性,但随着时间延长,植物需求水杨酸逐渐增大,致使水杨酸含量逐渐降低。
3.4 高温胁迫下陆地棉综合评价
植物响应高温是由体内各种机制共同制约环,仅凭一个指标来评价植物耐热性是有很大的局限性[31]。研究结果表明,RNAi耐热性最强,其次野生型,超表达耐热性最差。
4 结 论
3种材料抗高温能力由强到弱为RNAi,野生型材料,超表达材料。在高温下可通过提高蒸腾速率来减弱逆境胁迫的危害,提高生长素含量来积极调控植物生长,提高细胞的渗透调节能力来减轻细胞遭受的损伤。

