肝细胞肝癌组织中A1CF、UPF1的表达及临床意义*
甄茂川,刘平果,苏永杰,周剑寅,黎蕴通,李鹏涛,赵一麟
厦门大学附属中山医院:1.肝胆胰外科;2.肿瘤与血管介入科,福建厦门 361000
肝细胞肝癌(HCC)是常见的消化道恶性肿瘤,全球范围内,每年新发病例达91万例,死亡例数达36万例,其发病率和死亡率呈上升趋势[1]。HCC患者早期症状隐匿,明确诊断时已为中期或晚期阶段,失去了最佳手术时机,患者病死率较高。因此,有必要深入研究HCC的疾病机制,寻找新的HCC诊治靶点。APOBEC1互补因子(A1CF)编码基因位于10q11.23,其能够与APOBEC-1结合形成复合酶,诱导哺乳动物载脂蛋白B mRNA位点特异性胞嘧啶(C)脱氨形成尿嘧啶(U)[2]。有研究表明,A1CF作为一种促癌基因,其能够通过激活丝裂原活化蛋白激酶的激酶/胞外信号调节激酶信号通路,促进肾癌[3]、子宫内膜癌[4]等恶性肿瘤的增殖和转移,导致肿瘤进展。上移码蛋白1(UPF1)基因位于19p13.11,其作为一种RNA解旋酶ATP酶,参与 mRNA 核输出,可启动无义介导的mRNA衰减[5]。近年来有研究发现,结直肠癌[6]、甲状腺癌[7]等恶性肿瘤中存在UPF1表达下调的现象,UPF1的表达下调能够通过促进转录因子ZEB1的表达,促进肿瘤细胞发生上皮间质转化,促进肿瘤侵袭和迁移。本研究通过检测HCC中A1CF和UPF1的表达,探讨二者与临床病理特征的关系及临床意义。
1 资料与方法
1.1一般资料 选取2017年1月至2020年1月本院诊治的118例HCC患者。纳入标准:(1)经病理检查明确诊断为HCC;(2)初次诊断和治疗;(3)临床资料完整。排除标准:(1)合并急性病毒性肝炎、肝脓肿等疾病;(2)合并其他恶性肿瘤;(3)合并系统性红斑狼疮等免疫性疾病。纳入的118例患者中男70例,女48例;年龄33~78岁,平均(62.4±5.1)岁;肿瘤最大径:≤3 cm者72例,>3 cm者46例;肿瘤分期:Ⅰ~Ⅱ期79例,Ⅲ期39例;组织学分级:Ⅰ~Ⅱ级65例,Ⅲ级53例;甲胎蛋白(AFP)水平:<400 μg/L 80例,≥400 μg/L 38例;血管侵犯41例;乙型肝炎表面抗原(HBsAg)阳性60例。本研究经本院伦理委员会批准并通过,患者和家属对本研究知情同意并签署书面文件。
1.2方法
1.2.1材料 RNAiso Plus 试剂购自日本Takara公司。Narodrop2000微量分光光度计购自美国赛默飞公司。PrimeScript RT Reagent及SYBR Premix Ex Taq Ⅱ试剂盒购自日本Takara公司。ABI 7500 StepOnePlus系统购自美国Applied Biosystems公司。引物由上海生工公司设计合成。
1.2.2荧光定量PCR检测 应用荧光定量PCR法检测癌及癌旁组织中A1CF、UPF1 mRNA的表达。用RNAiso Plus提取组织中总RNA,检测RNA的浓度和纯度。将1 μg总RNA逆转录为cDNA。引物序列:A1CF的正向引物为5′-ACCGACTTTACTCTTCCTAGCC-3′,反向引物为5′-AGGTCCTTCGTGTAATAGGTGTC-3′;UPF1的正向引物为5′-ACCTATTACACGAAGGACCTCC-3′,反向引物为5′-ACGTCCGTTGCAGAACCAC-3′;内参GAPDH的正向引物为5′-CTGCAACGGACGTGGAAATAC-3′,反向引物为5′-ACAGCCGCAGTTGTAGCAC-3′。PCR反应条件:95 ℃ 5 min,95 ℃ 30 s,62 ℃ 1 min,72 ℃,30 s,共40个循环。反应体系为10 μL,模板1 μL,正、反向引物各1 μL,SYBR Green premix 5 μL,双蒸水2 μL。采用2-ΔΔCt法计算UPF1 mRNA的相对表达量。
1.2.3免疫组化检测 10%中性甲醛固定过夜,石蜡包埋后切片,按照常规免疫组化染色步骤进行染色。A1CF,UPF1兔抗人单克隆抗体购自Abcam公司(货号:ab231614、ab109363)。应用日本OLYMBUS,BX53显微镜观察染色情况,并进行免疫组化染色评分。免疫组化评分为染色强度(0分:无染色;1分:浅黄色;2分:棕褐色)和染色面积(0分:≤25%;1分:25%~50%;2分:≥50%)乘积,总评分<2分为阴性,≥2分为阳性[8]。
1.3随访 所有研究对象自确诊日起开始进行定期随访,第1年每3个月电话随访一次,第2~3年每半年随访1次,随访内容为患者生存情况,随访终点为患者发生死亡或随访时间结束。随访截至2022年2月1日。
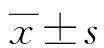
2 结 果
2.1癌与癌旁组织中A1CF、UPF1 mRNA表达 癌组织中A1CF mRNA的相对表达量(1.831±0.472)显著高于癌旁组织(0.314±0.116),差异有统计学意义(t=33.904,P<0.001)。癌组织中UPF1 mRNA相对表达量(1.161±0.273)显著低于癌旁组织(2.314±0.316),差异有统计学意义(t=29.993,P<0.001)。
2.2癌与癌旁组织中A1CF、UPF1蛋白表达 HCC癌组织中,UPF1、UPF1蛋白阳性表达主要位于细胞质和细胞膜。HCC癌组织中A1CF、UPF1蛋白表达阳性率分别为66.10%(78/118)、29.66%(35/118),癌旁组织中分别为16.95%(20/118)、71.19%(84/118)。HCC癌组织中A1CF蛋白表达阳性率明显高于癌旁组织(χ2=58.703,P<0.001),HCC癌组织中UPF1蛋白表达阳性率明显低于癌旁组织(χ2=40.698,P<0.001)。见图1。

图1 HCC癌及癌旁组织中A1CF、UPF1蛋白表达(200×)
2.3癌组织中A1CF、UPF1 mRNA及蛋白表达的相关性 经Pearson相关分析,HCC癌组织中A1CF与UPF1 mRNA表达呈显著负相关(r=-0.713,P<0.001)。经Spearman秩相关分析,A1CF与UPF1蛋白表达亦呈显著负相关(rs=-0.782,P<0.001)。
2.4A1CF、UPF1蛋白表达与HCC临床病理特征的关系 不同肿瘤分期、组织学分级癌组织中A1CF、UPF1蛋白表达阳性率之间差异有统计学意义(P<0.05);不同性别、年龄、血管侵犯、HBsAg、肿瘤最大径及AFP癌组织中A1CF、UPF1蛋白表达阳性率之间差异均无统计学意义(P>0.05)。见表1。

表1 A1CF、UPF1蛋白表达与临床病理特征的关系[n(%)]
2.5A1CF、UPF1蛋白表达对HCC患者生存预后的影响 118例HCC患者随访4~36个月,平均生存时间为(28.41±3.72)个月,随访期间死亡53例,失访1例。A1CF阳性组的平均生存时间为(26.52±3.46)个月,A1CF阴性组平均生存时间为(32.23±4.17)个月;A1CF阳性表达组患者累积生存明显低于A1CF阴性组,差异有统计学意义(χ2=4.754,P=0.029)。UPF1阳性组的平均生存时间为(33.20±4.26)个月,UPF1阴性组平均生存时间为(25.68±4.35)个月,相比于UPF1阳性组,UPF1阴性组患者累积生存明显较低,差异有统计学意义(χ2=10.747,P=0.001)。
2.6单因素及多因素COX比例风险模型分析影响HCC患者预后的因素 以HCC患者生存预后为因变量(1=死亡,0=存活,t=生存时间),以年龄(1=≥60岁,0=<60岁)、性别(1=男,0=女)、HBsAg(1=阳性,0=阴性)、肿瘤最大径(1=>3 cm,0=≤3 cm)、组织学分级(1=Ⅲ级,0=Ⅰ~Ⅱ级)、肿瘤分期(1=Ⅲ期,0=Ⅰ~Ⅱ期)、AFP(1=>400 μg/L,0=≤400 μg/L)、血管侵犯(1=有,0=无)、A1CF(1=阳性,0=阴性)、UPF1(1=阴性,0=阳性)为自变量,经单因素及多因素COX比例风险模型分析,结果表明,肿瘤分期Ⅲ期、组织学分级Ⅲ级、A1CF蛋白阳性、UPF1蛋白阴性是影响患者不良生存预后的独立危险因素。见表2、3。

表2 单因素COX比例风险模型分析影响HCC患者预后的危险因素

表3 多因素COX比例风险模型分析影响HCC患者预后的危险因素
3 讨 论
原发性肝癌是严重影响人类健康的消化道恶性肿瘤。HCC是原发性肝癌最常见的类型,占所有病例的80%[9]。影响HCC发生因素包括慢性病毒性肝炎、黄曲霉毒素B1及饮酒等。虽然目前手术是HCC的最佳治疗手段,但由于肿瘤异质性较大,术后可发生复发、转移,导致不良生存预后[10]。深入研究HCC的疾病机制,寻找能够预测HCC患者临床预后的肿瘤标志物,对于实现肿瘤个体化治疗及改善患者临床预后具有重要意义。
肿瘤代谢改变是肿瘤的基本特征之一。HCC肿瘤发生与脂代谢重编程密切相关,涉及载脂蛋白B(ApoB)、白蛋白等多种基因突变或甲基化等表观遗传学修饰异常[11]。A1CF是一种富含AU的RNA结合蛋白,其作为一种胞苷脱氨酶,介导ApoB RNA的C转换为U,对APOB的表达发挥表观遗传或转录后基因调控的作用。近年来有研究发现,肿瘤中A1CF表达升高能够通过抑制P53/P21信号通路,促进肿瘤细胞的增殖、侵袭和迁移,导致肿瘤进展[4]。本研究中,HCC癌组织中A1CF mRNA和蛋白表达均明显升高,提示A1CF可能与HCC的发生有关。A1CF表达可能与miRNA的表达调控有关。有研究表明,miR-590-3p能够结合A1CF mRNA,降低mRNA的稳定性,抑制A1CF的表达,肿瘤中miR-590-3p的表达下调导致A1CF mRNA稳定性增加,促进A1CF的表达[12]。本研究中,A1CF的表达与肿瘤分期、组织学分级有关,提示A1CF促进HCC的恶性进展。有研究发现,A1CF能够通过活化轴抑制蛋白2,激活Wnt/β连环蛋白通路,促进肿瘤细胞的迁移和侵袭,导致肿瘤恶性进展[13]。有学者发现,肿瘤中A1CF的表达升高通过与信号转导分子SMAD3相互作用,促进SMAD3细胞核易位,上调Snail和间质性标志N-钙黏蛋白的表达,促进肿瘤细胞的迁移和侵袭,体外实验中也证实敲低A1CF的表达能够抑制肿瘤的侵袭能力[14]。因此,HCC中A1CF可能作为一种促癌因子,促进肿瘤的恶性进展。本研究中,A1CF阳性表达的HCC患者生存预后较差,是影响HCC患者不良预后的独立危险因素,表明HCC癌组织中A1CF可能作为新的肿瘤标志物,有助于判断HCC患者的预后。有研究发现,A1CF具有EIYMNVPV模体,该结构能够促进肿瘤细胞中白细胞介素6的表达[15],而白细胞介素6能够通过激活信号转导子、转录激活子3、增强缺氧诱导因子1的表达及核转位,提高肿瘤细胞对顺铂的耐药性,导致患者预后不良[16]。
UPF1作为一种ATP依赖性RNA解旋酶,是一种进化上保守的磷蛋白,在无义介导的 mRNA 衰变和RNA降解中起关键作用。近年来有研究发现,UPF1作为一种肿瘤抑制因子,其能降低周期抑制蛋白的mRNA的衰变,抑制G1期/S期的转换,抑制肿瘤的发生[17]。本研究中,HCC癌组织中UPF1的mRNA及蛋白表达降低,提示UPF1表达下调可能参与HCC的发生。分析其原因,可能是UPF1表达受长链非编码RNA调控。研究表明,肿瘤中长链非编码RNA DLX6-AS1表达升高,其能够作为分子支架,结合UPF1 mRNA,并抑制UPF1的表达,促进肿瘤细胞的迁移和侵袭[7]。本研究中,UPF1蛋白表达与肿瘤分期、组织学分级有关,提示UPF1的表达降低可能参与促进HCC的肿瘤进展。有研究报道,肿瘤组织中UPF1的表达降低可导致双特异性磷酸酶1的激活,肿瘤增殖相关基因RNA稳定性增加,从而促进肝肿瘤细胞过度增殖[18]。有研究发现,长链非编码RNA SNHG6可通过靶向抑制UPF1的表达,激活下游转化生长因子β/信号转导因子Smad信号通路,上调转录因子ZEB1的表达,诱导肿瘤细胞发生上皮间质转化,促进肿瘤细胞的迁移和侵袭[6]。因此,UPF1在HCC中作为一种肿瘤抑制因子,其表达降低可能影响HCC患者的临床预后。本研究中,UPF1蛋白阴性的HCC患者生存预后较差,是患者不良预后的独立危险因素。有学者发现,UPF1的表达下调能通过促进肿瘤细胞DNA拓扑异构酶Ⅱα的表达及肿瘤细胞干性的维持,增强肿瘤细胞对奥沙利铂等化疗药物的耐药性,导致患者预后不良[19]。本研究发现,HCC中A1CF与UPF1表达呈显著负相关,提示二者在HCC中可能存在相互作用的关系,其原因可能是UPF1的表达下调导致微小RNA(miRNA)如miR-342、miR-485等的稳定性降低[20],进而引起A1CF mRNA稳定性增加,促进A1CF的蛋白表达[12]。但HCC患者中二者的具体作用机制有待深入研究。
综上所述,HCC中A1CF mRNA及蛋白表达升高,UPF1 mRNA及蛋白表达降低,二者表达呈显著负相关,HCC中A1CF、UPF1蛋白表达与肿瘤分期、组织学分级有关。A1CF蛋白阳性表达、UPF1蛋白阴性表达HCC患者生存预后较差,是影响HCC患者不良生存预后的独立危险因素,是新的HCC预后相关肿瘤标志物。但本研究尚存在一定的不足,如未对HCC中A1CF、UPF1具体作用机制进行研究,二者是否能够成为HCC中治疗的新靶点,有待今后进行验证。

