ERO1L、MUC16在非小细胞肺癌组织中的表达及临床价值*
赖其廷,李敏菁
佛山市第一人民医院呼吸与危重症医学科,广东佛山 528000
肺癌是最常见的肿瘤相关死亡的病因,全球范围内,每年新发患者例数达209万例,死亡达176万例[1]。非小细胞肺癌(NSCLC)是肺癌最常见的类型。目前,NSCLC的治疗包括手术、化疗及分子靶向治疗等。NSCLC的治疗结果具有较大的个体差异,临床治疗中发现,不同患者治疗敏感性不同,预后差异较大[2]。因此,深入研究NSCLC的发生机制,寻找用于临床预后判断的分子标志物,意义较大。内质网氧化还原酶1α(ERO1A)基因位于14号染色体,编码的蛋白质定位于位于内质网,作为伴侣辅因子参与蛋白折叠过程的调节[3]。近年研究发现,ERO1A在胰腺癌等恶性肿瘤中表达升高,其能够促进细胞周期的进展,促进肿瘤细胞增殖[4-5]。细胞表面相关黏蛋白16(MUC16)基因编码蛋白属于黏蛋白家族成员,是一种膜束缚黏蛋白,包含氨基端细胞外结构域、串联重复结构域和短的跨膜结构域,在细胞表面形成屏障、保护上皮细胞免受病原体侵害方面发挥作用[6]。研究表明,在卵巢癌、胰腺癌等恶性肿瘤中MUC16表达水平升高,MUC16可激活表皮生长因子受体,促进肿瘤细胞增殖及转移,导致患者预后不良[7-8]。本研究通过分析NSCLC患者组织中ERO1A、MUC16的表达情况,探讨其临床意义。
1 资料与方法
1.1一般资料 选取2018年2月至2019年2月本院收治的94例NSCLC患者作为研究对象。其中,男60例,女34例;年龄33~78岁,平均(62.5±5.2)岁;合并淋巴结转移32例;肿瘤最大径:<5 cm者57例,≥5 cm者37例;病理类型:腺癌58例,鳞癌36例;肿瘤分期:Ⅰ~Ⅱ期63例,Ⅲ期31例;肿瘤分级:中高分化61例,低分化33例;手术方式:开胸手术56例,腔镜手术38例;术后辅助化疗78例。纳入标准:(1)接受肺癌根治术治疗,并经病理学检查明确诊断为NSCLC;(2)首次诊治,既往无肿瘤治疗病史;(3)临床病理及随访资料完整,患者及家属能够配合相关治疗及随访。排除标准:(1)合并其他恶性肿瘤;(2)合并肝、肾等脏器功能障碍;(3)合并急性肺炎、肺脓肿及肺结核等肺部疾病。本研究经本院伦理委员会审核通过。所有患者或家属签署知情同意书。
1.2荧光定量PCR法检测ERO1A、MUC16 mRNA表达 Trizol法提取组织中总RNA,逆转录为cDNA,并进行PCR反应。SYBR Premix Ex TaqTM荧光定量PCR试剂盒购自日本TAKARA公司。反应体系:SYBR Premix 10 μL,引物2 μL,cDNA 1 μL和双蒸水7 mL。反应条件:95 ℃ 5 min,95 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,共35个循环。引物由上海生工公司合成。ERO1A:上游引物为5′-CCAGTCCTACATCTTCGGTTGT-3′,下游引物为5′-AGGGTAGTTCCTAGAGGGAGTT-3′;MUC16:上游引物为5′-AGCCACCTCATCTATTACCACA-3′,下游引物为5′-TGTTGCTGCATTGCTTAGGGT-3′;内参GAPDH:上游引物为5′-GGAGCACACGCTAGTTCAGAA-3′,下游引物为5′-GGTCTCTATTGAGGGGAAGGT-3′。ERO1A、MUC16的mRNA相对表达量采用2-ΔΔCt法计算。根据ERO1A、MUC16 mRNA表达的平均值将NSCLC患者分为ERO1A mRNA高表达组和低表达组,以及MUC16 mRNA高表达组和低表达组。
1.3免疫组织化学(免疫组化)法检测组织中ERO1A、MUC16蛋白表达 取术中获取的癌组织和癌旁组织(距癌组织边缘2 cm以上),常规石蜡包埋切片,常规进行免疫组化染色。ERO1A、MUC16兔多克隆一抗购自美国Abcam公司(货号:ab177156、ab110640)。采用日本OlymbusDM500显微镜观察染色强度和染色面积并评分。染色强度评分标准:0分,无染色;1分,浅黄色;2分,棕褐色;染色面积评分标准:0分,染色面积≤25%;1分,25%<染色面积<50%;2分,染色面积≥50%。染色强度评分和染色面积评分的乘积为免疫组化染色评分,<2分为阴性,≥2分为阳性。
1.4术后辅助治疗及随访 对肿瘤分期Ⅰb~Ⅲa期的NSCLC患者,术后予以含铂两药方案一线辅助化疗,多西他赛75 mg/m2(上海创诺药业公司,国药准字H20113165),顺铂75 mg/m2(锦州久泰药业公司,国药准字H21020212),21 d为1个疗程,共治疗4个疗程。所有研究对象出院后进行定期随访,每3个月电话随访1次,随访内容为患者生存情况等,随访截至2022年3月1日,随访终点为随访时间结束或患者死亡。
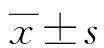
2 结 果
2.1ERO1A、MUC16 mRNA相对表达水平比较 NSCLC癌组织中ERO1A、MUC16 mRNA相对表达水平分别为6.31±0.98、1.75±0.52,均明显高于癌旁组织的2.61±0.35、0.51±0.12,差异均有统计学意义(t=34.472、22.528,均P<0.05)。Pearson相关分析显示,NSCLC患者ERO1A与MUC16 mRNA表达呈正相关(r=0.610,P<0.001)。
2.2组织中ERO1A、MUC16蛋白表达 ERO1A和MUC16蛋白棕褐色阳性染色位于细胞膜和细胞质。NSCLC癌组织中ERO1A和MUC16蛋白阳性率分别为91.49%(86/94)、95.74%(90/94),明显高于癌旁组织的4.26%(4/94)、5.32%(5/94),差异均有统计学意义(χ2=143.323、153.741,均P<0.001)。见图1。

图1 NSCLC中ERO1A、MUC16蛋白表达(免疫组化法,200×)
2.3ERO1A、MUC16蛋白表达与临床病理参数的关系 ERO1A mRNA表达与肿瘤分期、淋巴结转移有关(P<0.05),肿瘤分期Ⅲ期、伴淋巴结转移的NSCLC癌组织中ERO1A mRNA表达明显高于肿瘤分期Ⅰ~Ⅱ期、无淋巴结转移的NSCLC癌组织(P<0.05)。MUC16 mRNA表达与肿瘤分期、病理分级及淋巴结转移有关(P<0.05),肿瘤分期Ⅲ期、低分化及伴淋巴结转移的NSCLC癌组织中MUC16 mRNA表达明显高于肿瘤分期Ⅰ~Ⅱ期、中高分化及无淋巴结转移的癌组织(P<0.05)。见表1。

表1 ERO1A、MUC16 mRNA表达与临床病理参数的关系
2.4ERO1A、MUC16 mRNA表达对NSCLC患者预后的影响 根据ERO1A、MUC16 mRNA表达的平均值将NSCLC患者分为ERO1A mRNA高表达组(n=45)和低表达组(n=49)、MUC16 mRNA高表达组(n=46)和低表达组(n=48)。所有研究对象随访时间为3~36个月、平均(30.24±5.1)个月,其中死亡36例,失访4例。ERO1A mRNA高表达组和低表达组平均生存时间分别为(27.82±5.18)、(32.47±5.32)个月。ERO1A mRNA高表达组患者累积生存明显低于低表达组(Log-rankχ2=8.776,P=0.003)。MUC16 mRNA高表达组和低表达组平均生存时间分别为(27.34±5.29)、(32.94±5.54)个月。MUC16 mRNA高表达组患者累积生存明显低于低表达组(Log-rankχ2=8.003,P=0.005)。见图2。

图2 ERO1A、MUC16 mRNA表达对NSCLC患者预后的影响
2.5单因素及多因素COX回归分析影响NSCLC患者生存预后的因素 以NSCLC患者随访结束时的生存状态为因变量(赋值:1=死亡,0=存活,t=时间),纳入年龄(赋值:1=≥60岁,0=<60岁)、性别(赋值:1=男,0=女)、肿瘤最大径(赋值:1=>5 cm,0=≤5 cm)、病理类型(赋值:1=腺癌,0=鳞癌)、淋巴结转移(赋值:1=有,0=无)、肿瘤分期(赋值:1=Ⅲ期,0=Ⅰ~Ⅱ期)、病理分级(赋值:1=低分化,0=中高分化)、ERO1A mRNA(赋值:1=高表达,0=低表达)、MUC16 mRNA(赋值:1=高表达,0=低表达)为自变量。单因素COX回归分析结果显示,肿瘤分期、淋巴结转移、ERO1A及MUC16 mRNA表达情况是影响NSCLC患者生存预后的因素。多因素COX回归分析结果,肿瘤分期Ⅲ期、伴淋巴结转移、ERO1A及MUC16 mRNA高表达影响NSCLC患者生存预后的独立危险因素。见表2、3。

表2 单因素COX回归分析

表3 多因素COX回归分析
3 讨 论
我国肺癌疾病负担重,每年新增病例达78.7万例,死亡病例达63.1万例,占所有恶性肿瘤的首位[1]。NSCLC病因及机制尚不清楚,目前认为其与吸烟、职业暴露及遗传易感性等有关。近年来,基于NSCLC基因突变的分子靶向治疗在临床中显示出较好的治疗效果,但部分患者仍然存在治疗抵抗或治疗后耐药性的形成,患者的临床预后仍然不理想[9]。因此,深入研究NSCLC肿瘤发生发展的机制,寻找新的NSCLC治疗靶点,有助于NSCLC的个体化治疗,改善患者预后。
ERO1A是一种内质网腔内定位糖蛋白,其能够选择性氧化促进蛋白质二硫键的形成,与肿瘤、自身免疫性疾病等关系密切。研究发现,肿瘤中ERO1A作为一种促癌基因,其过表达能够通过促进肿瘤细胞发生上皮间质转化,促进肿瘤的侵袭和迁移能力,导致肿瘤的发生发展[10]。本研究中,NSCLC癌组织中ERO1A mRNA和蛋白表达均明显升高,提示ERO1A可能参与NSCLC的肿瘤发生,ERO1A表达上调可能与转录后调控异常有关。研究发现,miR-218-5p能够结合ERO1A mRNA的3′非编码区,降低ERO1A mRNA的稳定性,抑制ERO1A的表达,而肺腺癌细胞中miR-218-5p往往异常下调,导致ERO1A mRNA稳定性升高,ERO1A蛋白表达升高[11]。本研究中,ERO1A mRNA表达与肿瘤分期、淋巴结转移有关,表明ERO1A的表达参与促进NSCLC的肿瘤进展。研究发现,ERO1A能够通过增加缺氧诱导因子1α的表达,促进程序性死亡配体1的蛋白折叠,减少蛋白酶体的降解,促进程序性死亡配体1的表达,进而导致肿瘤细胞的免疫逃逸[12]。此外,ERO1A作为蛋白质折叠过程中的关键酶,能够与蛋白质二硫键异构酶相互作用,其表达升高可促进细胞间质性标志物,如N钙黏素的表达,导致肿瘤细胞侵袭和迁移能力增强,促进肿瘤的转移[13]。本研究中,ERO1A mRNA高表达的NSCLC患者生存预后较差,并且ERO1A mRNA高表达是NSCLC患者不良生存预后的独立危险因素,表明通过检测NSCLC中ERO1A的表达情况,有助于判断患者的生存预后。缺氧是肿瘤的基本特征之一。研究表明,缺氧可通过上调肿瘤细胞中ERO1A的表达,促进肿瘤细胞化疗耐药性的形成,导致患者的不良预后[14]。
MUC16是Ⅰ型跨膜黏蛋白家族成员,表达于正常极化状态细胞的顶端膜上,在细胞癌变过程中,由于细胞极性丧失,MUC16可表达在整个细胞表面表达,并与细胞基底外侧表面的生长因子受体相互作用,促进下游信号传导,促进卵巢癌、胰腺癌等恶性肿瘤的进展[15]。本研究中,NSCLC中MUC16 mRNA及蛋白表达均明显升高,提示MUC16的表达参与NSCLC的肿瘤发生。肿瘤中MUC16的表达升高可能与基因突变有关。研究表明,肿瘤中存在普遍的MUC16基因激活型突变的现象,与肿瘤较高的突变负荷有关[16]。本研究中,MUC16 mRNA的表达与肿瘤分期、分化程度及淋巴结转移有关,提示MUC16表达升高促进NSCLC的肿瘤进展。体外细胞实验发现,MUC16能够激活肺肿瘤细胞中Jacus相关激酶2/信号转导因子3通路的表达,促进肿瘤细胞的增殖和迁移,导致肿瘤进展[17]。此外,有学者发现,MUC16可以通过诱导肿瘤细胞中的葡萄糖转运蛋白1的表达来促进葡萄糖的摄取,促进糖原的合成,导致肿瘤细胞的过度增殖[18]。因此,MUC16作为一种促癌基因,参与NSCLC肿瘤的发生发展。本研究发现,MUC16 mRNA高表达患者生存预后较差,是不良预后的独立因素,表明MUC16可作为NSCLC预后判断的肿瘤标志物,有助于患者的临床预后评估。LAKSHMANAN等发现[17],在肺肿瘤细胞中过表达MUC16,能够抑制抑癌基因p53的表达,进而增强肿瘤细胞对顺铂和吉西他滨耐药性的形成。因此,MUC16的表达可能通过影响肿瘤细胞对化疗药物的敏感性,进而影响患者的生存预后。有学者发现基于MUC16的肿瘤免疫治疗,也取得了良好的治疗疗效,其可能是新的肿瘤治疗靶点[19]。
本研究中,相关性分析发现,NSCLC中ERO1A与MUC16 mRNA的表达呈显著正相关,提示NSCLC中二者可能存在相互作用的关系,共同影响NSCLC的肿瘤进展。研究发现,ERO1A通过影响二硫键的形成来促进肺肿瘤细胞中白细胞介素(IL)-6的分泌,IL-6与相应受体结合并激活核因子-κB信号通路,促进MUC16的转录,进而上调 MUC16的表达[20]。此外,MUC16的胞外片段被切割形成CA125,而MUC16的C端促进上皮间质转化表型和IL-6的释放,形成正反馈通路,进一步促进肺癌的发展。
综上所述,NSCLC癌组织中ERO1A、MUC16较癌旁组织表达均明显升高,二者的表达呈显著正相关,共同参与NSCLC的肿瘤发生发展过程。ERO1A、MUC16表达升高是影响NSCLC患者不良生存预后的独立因素。临床医生可根据NSCLC中ERO1A、MUC16的表达,对NSCLC患者的预后进行评估,对于不良预后的高危患者采取相应的治疗方式和密切随访,以改善NSCLC患者的临床生存预后。但由于本研究未对二者在NSCLC中的确切分子机制进行研究,有待今后在分子水平探讨二者在NSCLC中的作用机制并研发针对该机制的新的治疗药物。

