OMA1、OPA1在结直肠癌组织中表达及临床意义研究*
陈佳锦,董明明,罗海平,李新明△
1.武汉科技大学医学院,湖北武汉 430081;2.黄石市中心医院/鄂东医疗集团市中心医院胃肠肛肠外科,湖北黄石 435000
结直肠癌(CRC)是全球常见的恶性肿瘤,每年新发200万例,死亡90万例[1]。CRC的治疗方式包括手术切除、放化疗及免疫治疗等,但晚期CRC患者临床疗效不佳,生存获益有限[2]。金属蛋白酶相关蛋白1(OMA1)是位于线粒体内膜的锌金属蛋白酶,在细胞应激、活性氧刺激等条件下被激活,导致线粒体碎片化,加重细胞损伤等[3]。近年来有研究发现,在胃癌等消化道恶性肿瘤中存在OMA1表达上调的现象,其能够增加肿瘤细胞氧化应激水平,促进肿瘤细胞增殖及侵袭,导致患者不良预后[4]。线粒体融合蛋白1(OPA1)是一种线粒体蛋白,定位于线粒体内膜,结构上与动力蛋白相关的GTP酶相似,参与调节线粒体稳定性和能量输出[5]。有研究发现,恶性肿瘤中OPA1表达增加,其通过激活核因子-κB(NF-κB)基因增强子,促进肿瘤血管生成基因表达,导致肿瘤血管新生,促进肿瘤生长和转移[6]。目前,CRC患者中OMA1、OPA1中的表达及意义尚不清楚。本研究通过分析CRC组织中OMA1、OPA1的表达情况,探讨二者的临床预后价值。
1 资料与方法
1.1一般资料 选取2018年2月至2019年2月在黄石市中心医院就诊的86例CRC患者作为研究对象。其中,男48例,女38例;年龄31~79岁,平均年龄(62.5±5.6)岁;肿瘤位置:直肠33例,结肠53例;合并淋巴结转移36例;肿瘤最大径:≤3 cm者49例,>3 cm者37例;肿瘤TNM分期:Ⅰ~Ⅱ期50例,Ⅲ期36例;肿瘤分化程度:中高分化40例,低分化46例。纳入标准:(1)经术后病理检查明确诊断为CRC;(2)首次诊治,无肿瘤手术及化疗治疗史;(3)临床病理和随访资料完整。排除标准:(1)合并其他恶性肿瘤;(2)合并炎性肠病,自身免疫性疾病等;(3)合并严重的心肺功能障碍;(4)妊娠哺乳期女性。本研究符合《赫尔辛基宣言》原则,经黄石市中心医院院伦理委员会审核通过。所有患者和家属知情同意并在知情同意书上签字。
1.2方法 采用免疫组织化学检测组织中OMA1、OPA1蛋白表达,将术中获取的癌和癌旁组织用10%中性甲醛固定,石蜡包埋切片,进行免疫组化染色,实验步骤按照试剂盒说明书进行(PV6000,北京中杉金桥)。OMA1、OPA1兔单克隆抗体一抗(美国Abcam公司,货号:ab154949、ab157457)稀释比均为1∶100。DAB显色,苏木素复染,梯度乙醇脱水,中性树脂封片后镜检(CX300,日本奥林巴斯)。镜下进行染色面积评分(<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分)和染色强度评分(淡黄色为1分,黄或深黄色为2分,褐色为3分)。染色面积评分和染色强度评分乘积即为最终评分:<2分为阴性,≥2分为阳性。
1.3随访 所有患者出院后定期进行随访,以门诊或电话方式进行,第1年每3个月随访1次,第2~3年每6个月随访1次,随访内容为患者生存状态,记录生存时间,随访截至2022年3月,随访终点为随访时间结束或发生死亡。
1.4统计学处理 应用SPSS22.0统计软件进行数据分析。计数资料用率或构成比表示,组间比较采用χ2检验。相关性分析采用Spearman秩相关分析。采用Kaplan-Meier生存曲线(Log-rank检验)分析OMA1、OPA1表达对CRC患者预后的影响。采用单因素及多因素COX回归分析影响CRC患者预后的因素。以P<0.05为差异有统计学意义。
2 结 果
2.1组织中OMA1、OPA1蛋白表达 CRC癌组织中OMA1、OPA1蛋白棕黄色阳性染色主要位于细胞质和细胞膜,OMA1、OPA1蛋白表达阳性率分别为72.09%(62/86)、69.77%(60/86),分别高于癌旁组织OMA1、OPA1蛋白表达阳性率11.63%(10/86)、13.95%(12/86),差异均有统计学意义(χ2=64.596、55.040,均P<0.001),见图1。
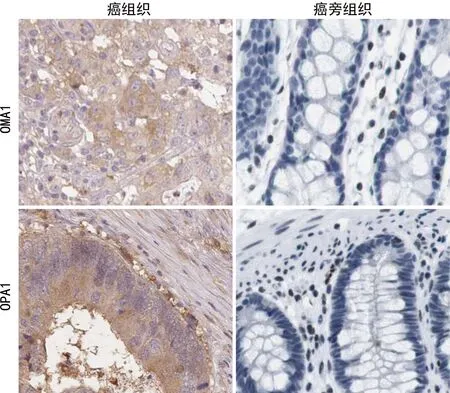
图1 CRC癌与癌旁组织中OMA1、OPA1蛋白表达(200×)
2.2CRC中OMA1、OPA1蛋白表达相关性 Spearman秩相关分析结果显示,CRC癌组织中OMA1与OPA1蛋白表达呈正相关(r=0.703,P<0.001)。
2.3不同临床病理参数CRC癌组织中OMA1、OPA1蛋白表达 肿瘤TNM分期Ⅲ期、伴淋巴结转移癌组织中OMA1、OPA1蛋白表达阳性率分别高于Ⅰ~Ⅱ期、无淋巴结转移癌组织中OMA1、OPA1蛋白表达阳性率,差异均有统计学意义(P<0.05)。见表1。
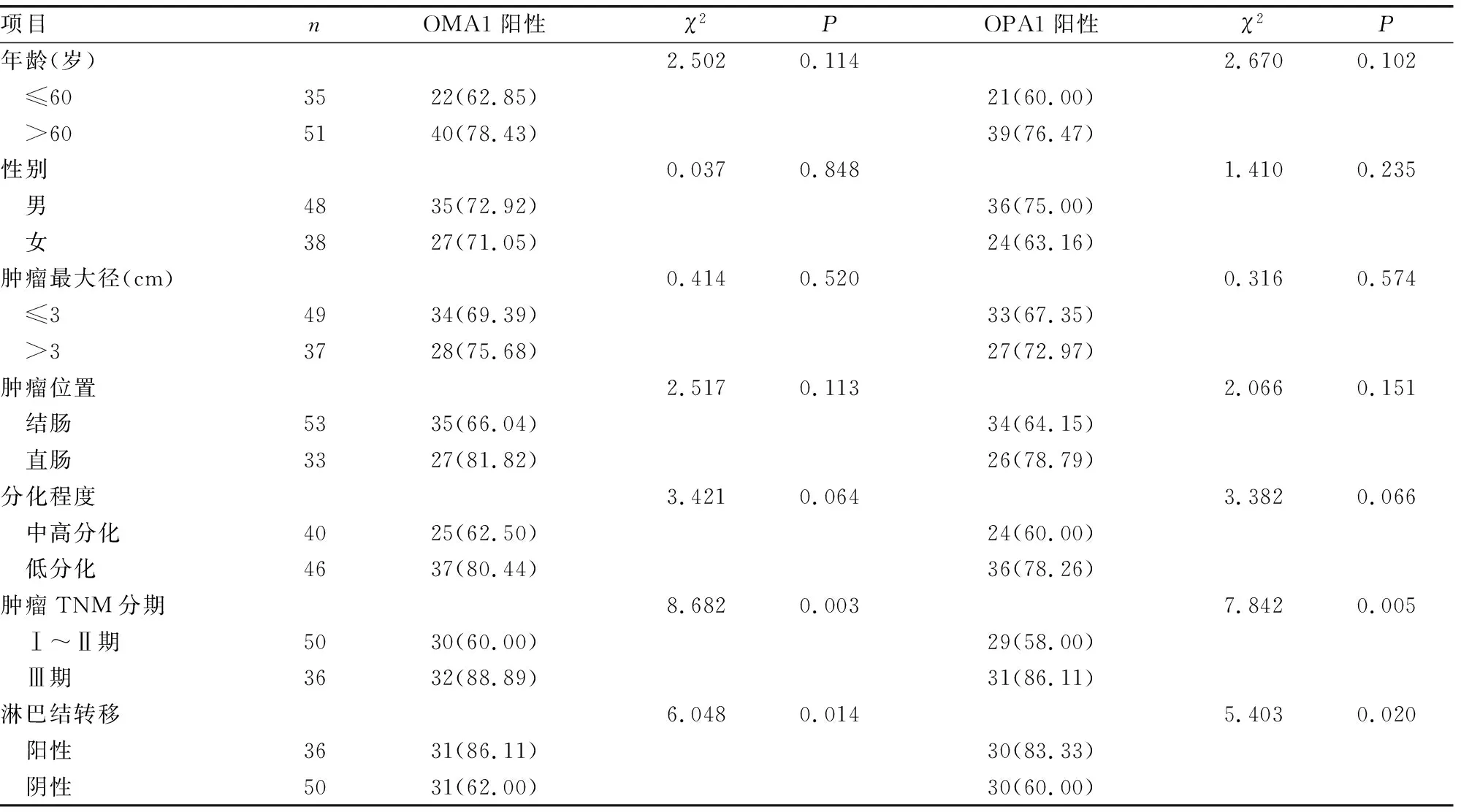
表1 CRC癌组织中OMA1、OPA1蛋白表达在不同临床病理特征中比较[n(%)]
2.4OMA1、OPA1蛋白表达与CRC患者预后的关系 86例CRC患者随访中,失访1例,死亡28例,3年总体生存率为67.44%(58/86)。OMA1阳性和阴性表达组患者3年总体生存率分别为61.29%(38/62),83.33%(20/24)。Kaplan-Meier生存曲线(Log-rank检验)分析结果,OMA1阳性表达组患者累积生存显著低于阴性表达组患者(Log-rankχ2=4.784,P=0.029)。OPA1阳性和阴性表达组患者的3年总体生存率分别为56.67%(34/60),92.31%(24/26)。 OPA1阳性表达组患者累积生存显著低于阴性表达组患者(Log-rankχ2=10.380,P=0.001)。
2.5单因素及多因素COX回归分析影响CRC患者生存预后的因素 以CRC患者预后为因变量(1=死亡,0=存活,t=时间),将年龄、性别、肿瘤最大径、肿瘤位置、肿瘤分化程度、肿瘤TNM分期及淋巴结转移纳入单因素COX回归分析,将单因素分析结果中差异有统计学意义(P<0.05)的指标作为自变量,进行多因素COX回归分析,结果显示,肿瘤TNM分期Ⅲ期、淋巴结转移、OMA1阳性、OPA1阳性是影响CRC患者预后的独立危险因素。见表2、3。
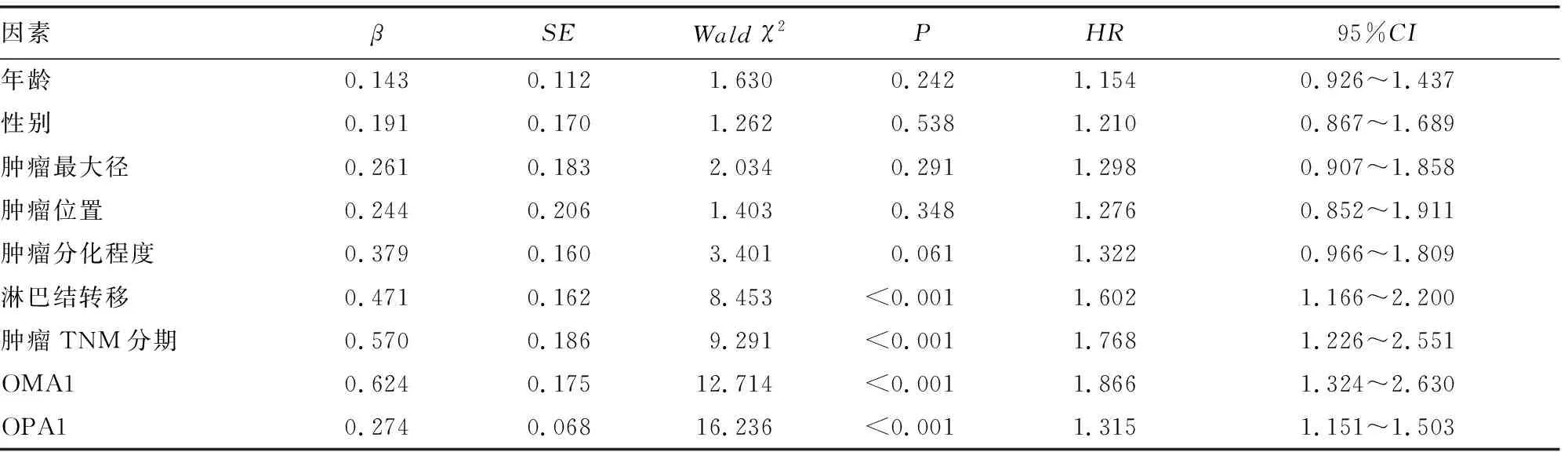
表2 单因素COX比例风险模型
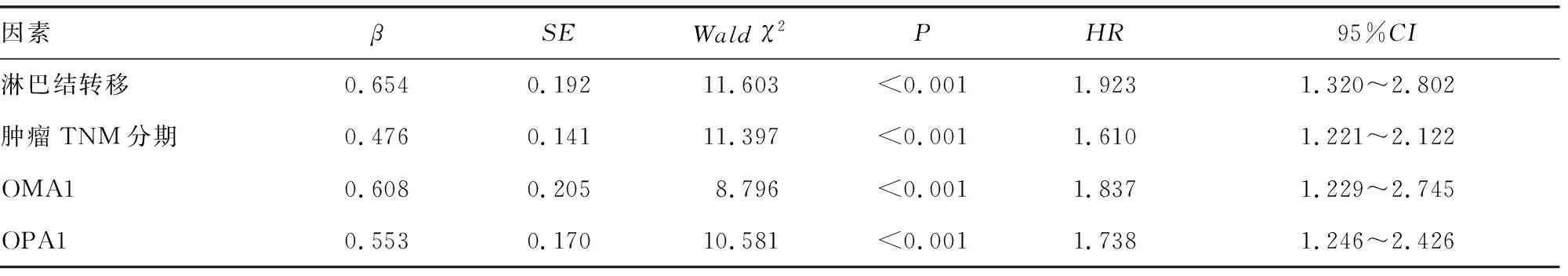
表3 多因素COX比例风险模型
3 讨 论
我国每年CRC新发病例数38.76万例,死亡18.71万例[7]。CRC的发生、发展是一个多阶段多步骤的由正常黏膜、腺瘤到癌逐渐演变的过程。血清肿瘤标志物是恶性肿瘤中早期发现、协助肿瘤分期及预后评估的重要手段。临床上,常用的CRC的血清标志物包括癌胚抗原、糖类抗原125及糖类抗原19-9等,但临床实践中发现其在诊断的灵敏度及特异度上仍然存在一定的局限[8]。因此,有必要深入研究CRC的病因及疾病机制,寻找新的CRC肿瘤标志物。有研究表明,线粒体功能的改变和随后的代谢重编程现在被认为是恶性肿瘤和转移的重要标志[8]。肿瘤基因组突变影响线粒体完整性,导致线粒体功能障碍,肿瘤细胞进行代谢适应,如Warburg效应,即葡萄糖或丙酮酸通过无氧糖酵解途径快速产生三磷酸腺苷(ATP),为肿瘤细胞增殖提供能量支持。
OMA1是一种保守的金属肽酶,是细胞代谢稳态、有丝分裂和细胞凋亡的关键调节因子。有研究发现,OMA1在乳腺癌等恶性肿瘤中发挥能量代谢调节作用,其通过调控糖代谢,促进肿瘤的增殖及转移[9]。本研究中,CRC癌组织中OMA1蛋白表达升高,与既往学者在体外细胞实验中结果一致[10]。OMA1表达与肿瘤TNM分期及淋巴结转移有关,提示OMA1促进CRC的发生发展。分析其原因,CRC肿瘤发生时由于肿瘤细胞过度增殖,肿瘤微环境处于缺血缺氧状态,同时伴有大量活性氧产生,OMA1作为线粒体蛋白,在缺氧、氧化应激等条件下表达显著升高并激活,下游缺氧诱导因子1α蛋白稳定性增加,激活下游血管内皮生长因子等靶基因的表达,促进肿瘤增殖及转移[10]。此外,尚有学者报道,T细胞急性白血病中,活性氧能够上调肿瘤细胞中OMA1的表达,在应用活性氧抑制剂NS1619或用siRNA敲低OMA1后,磷酸戊糖途径受到抑制,肿瘤细胞的凋亡显著增加[11]。因此,CRC中OMA1作为一种致癌因子,促进CRC的肿瘤进展。本研究生存分析发现,OMA1阳性表达CRC患者生存预后较差,是影响患者不良预后的独立因素,表明OMA1是一种潜在CRC预后相关标志物。笔者分析,OMA1可能参与促进CRC肿瘤耐药性形成,导致CRC患者的不良预后。CHENG等[12]报道,卵巢癌中OMA1表达升高引起线粒体能量代谢失调,其能与线粒体中磷酸化的p53蛋白相互作用,促进肿瘤细胞对顺铂等化疗药物耐药性形成。因此,以OMA1为靶点的临床治疗可能有助于改善CRC肿瘤化疗敏感性,改善患者临床预后[13]。
线粒体稳态是细胞存活的必要条件,而线粒体融合和分裂的动态平衡是维持线粒体稳态的重要条件[14]。线粒体内膜的融合和分裂由OPA1调控,OPA1包括a、b、c、d、e 5种亚型[15]。近年有研究发现,OPA1在乳腺癌等癌症中表达上调,其能够在体内外促进肿瘤细胞的增殖、迁移和侵袭,与患者的预后不良相关[16]。本研究中,CRC癌组织中OPA1表达上调,并与肿瘤TNM分期及淋巴结转移有关,提示OPA1促进CRC的发生发展。分析其机制,CRC中OPA1表达升高与肿瘤缺氧微环境有关。有研究发现,肿瘤缺氧微环境能够激活OMA1的表达,OMA1能够激活并上调OPA1的表达,进而抑制肿瘤细胞凋亡的发生[10]。此外,OPA1的表达升高还能通过促进肿瘤血管和淋巴管生成,促进肿瘤侵袭及转移。有研究表明,肿瘤细胞中OPA1水平增加能够增强核转录因子-κB(NF-κB)的表达,进而促进血管内皮生长因子及相应受体等血管或淋巴管生成基因的表达,促进血管及淋巴管内皮细胞的增殖,促进肿瘤细胞转移[6,17],这与本研究中合并淋巴结转移患者癌组织中OPA1蛋白表达阳性率较高的研究结果一致。本研究中,OPA1阳性表达的CRC患者生存预后较差,表明OPA1可能是新的CRC预后评估的肿瘤标志物。有学者在顺铂耐药的卵巢癌患者的癌组织中发现线粒体氧化磷酸化过程受到抑制,OPA1蛋白表达明显升高,线粒体形态上表现为数量增加、长度增加、线粒体嵴宽度减小等,体外实验证实,敲低OPA1表达后癌细胞化疗敏感性明显增加[18]。因此,OPA1作为一种肿瘤促进因子,可促进CRC患者肿瘤进展,导致CRC患者预后不良。本研究结果显示,CRC患者癌组织中OMA1与OPA1表达呈正相关(r=0.703,P<0.001)。OMA1作为一种内肽酶能够激活OPA1的表达,已被多项研究证实[19-20]。但目前OMA1与OPA1在CRC中的具体作用机制及其是否能够成为新的CRC治疗靶点,有待深入的基础及临床研究证实。
综上所述,CRC患者癌组织中OMA1、OPA1表达升高,二者与肿瘤TNM分期和淋巴结转移相关,均参与促进CRC患者肿瘤进展。OMA1、OPA1阳性表达是影响CRC患者生存预后的独立危险因素,是潜在的评估CRC患者生存预后的肿瘤标志物,有助于指导临床医生对于高危患者予以积极随访观察及治疗,以改善患者临床预后。但本研究也有局限性,因样本量有限,研究结果可能存在一定的偏倚,有待今后扩大样本量并进行前瞻性随机对照研究进行深入探索。

