血清LRG1、SDF-1联合检测对早期胃癌内镜黏膜下剥离术后复发的预测价值*
石 干,李丽平,赵 琪,雷 蓓,王冠怡,刘 芳,卢广荣,石文瑶
武汉市新洲区人民医院消化内科,湖北武汉 430499
胃癌是临床第五大常见的恶性肿瘤,致死率较高[1]。近年来随着胃镜检查的普及,越来越多的胃癌患者在病灶处于黏膜层或黏膜下层时被检出[2]。目前临床针对早期胃癌患者常采用的治疗方式为内镜黏膜下剥离术(ESD),有研究表明,ESD治疗对早期胃癌患者的病变组织切除率高,治疗效果好,然而,仍有部分患者行ESD治疗后存在复发的现象,影响患者健康甚至危及生命[3-4]。针对这种情况,若能在临床实践中通过相关指标预测ESD术后复发状况,及早预防,将有助于改善胃癌患者的预后和临床结局。因此,寻找特异性指标预测早期胃癌患者ESD术后状态对患者的生命健康具有重要意义。
富亮氨酸α-2糖蛋白-1(LRG1)基因定位于人第19号染色体,有研究表明,LRG1不仅能够参与机体内炎症反应的发生与发展、促进新血管的生成[5],还可以通过调控相关生物学过程来促进卵巢癌、直肠癌等多种恶性肿瘤的分化、转移[6-7]。基质细胞衍生因子-1(SDF-1)是一类趋化因子,既能参与、影响、调控机体的免疫反应,还与恶性肿瘤的浸润转移等多种生物学过程密切相关[8]。目前关于LRG1和SDF-1对早期胃癌ESD术后复发的影响研究较少。基于此,本研究将探讨早期胃癌ESD术后复发患者血清LRG1和SDF-1的水平,并分析二者对ESD术后复发的预测价值。
1 资料与方法
1.1一般资料 选取2018年1月至2021年10月在本院行ESD治疗的317例早期胃癌患者作为研究对象,年龄50~70岁,平均(62.17±3.48)岁。根据术后1年内复查情况,分为复发组(32例)和未复发组(285例)。纳入标准:(1)CT检查未见淋巴结转移;(2)内镜超声检查显示病变组织仅局限于黏膜层或黏膜下层;(3)符合早期胃癌的诊断[9];(4)符合ESD治疗标准[10];(5)临床资料齐全。排除标准:(1)在同一部位二次接受ESD;(2)同时切除多个病灶;(3)术前或术后有放化疗史;(4)有其他部位恶性肿瘤或恶性肿瘤史;(5)伴有严重心、肺、脑等重要器官功能不全。本研究经医院伦理委员会审批通过,所有患者签署知情同意书。
1.2方法
1.2.1治疗方法 患者行ESD术前8 h内行禁食、禁饮,静脉麻醉后采用胃镜检测,结合碘染色和放大内镜寻找并确定病变位置,明确病变交界。采用点状电凝在距离病变边缘10 mm处进行标记,将配置好的10%甘油果糖混合液沿标记点外侧进行黏膜下注射至整块黏膜突起。使用TT刀于标记点外侧约5 mm处以环形走向切开黏膜下层,并经开口处对病变黏膜进行剥离,直至剥离完全。术中出现小血管出血时,使用TT刀或Dual刀止血,若为较大血管出血则需采用电热止血钳进行凝固止血,确保全程操作视野清晰。术后收集患者的肿瘤最大径、分化程度、肿瘤部位、淋巴结转移及手术时间等临床资料。
1.2.2血清LRG1和SDF-1水平检测 采集两组研究对象ESD术前晨起空腹静脉血5 mL置于真空采血管中,在室温下静置30 min后以3 000 r/min的转速给予10 min离心处理,留取血清保存于-80 ℃冰箱,待测。采用LRG1 酶联免疫吸附试验(ELISA)试剂盒(武汉华美生物科技公司)和SDF-1 ELISA试剂盒(美国贝克曼库尔特公司),检测血清LRG1和SDF-1水平,具体操作按照试剂盒步骤说明进行。
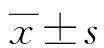
2 结 果
2.1两组血清LRG1、SDF-1水平比较 与未复发组相比,复发组患者血清LRG1和SDF-1水平均显著升高(P<0.05)。见表1。

表1 两组血清LRG1和SDF-1水平比较
2.2ESD术后复发组患者血清LRG1和SDF-1水平的相关性 Pearson法分析结果显示,复发组患者血清LRG1和SDF-1水平呈显著正相关(r=0.962,P<0.05)。
2.3影响早期胃癌患者ESD术后复发的单因素分析 两组患者年龄、性别、肿瘤最大径、分化程度、肿瘤部位及手术时间比较差异无统计学意义(P>0.05),而复发组发生淋巴结转移的患者所占比例显著高于未复发组(P<0.05)。见表2。
2.4早期胃癌患者ESD术后复发的多因素Logistic回归分析 以早期胃癌患者行ESD后是否发生术后复发为因变量(赋值:复发=1,未复发=0),淋巴结转移(赋值:是=1,否=0)、LRG1和SDF-1为自变量,对影响早期胃癌患者ESD术后复发的相关因素行Logistic回归分析,结果显示淋巴结转移、LRG1和SDF-1升高均为早期胃癌患者ESD发生术后复发的危险因素(P<0.05)。见表3。

表3 Logistic回归分析早期胃癌患者ESD术后复发的影响因素
2.5血清LRG1和SDF-1对早期胃癌患者ESD术后复发的预测价值 ROC曲线分析结果显示,血清LRG1和SDF-1预测早期胃癌患者ESD术后复发的曲线下面积(AUC)分别为0.888、0.841,而二者联合预测的AUC为0.936,二者联合优于血清LRG1和SDF-1各自单独预测(P=0.015、0.018)。见图1、表4。
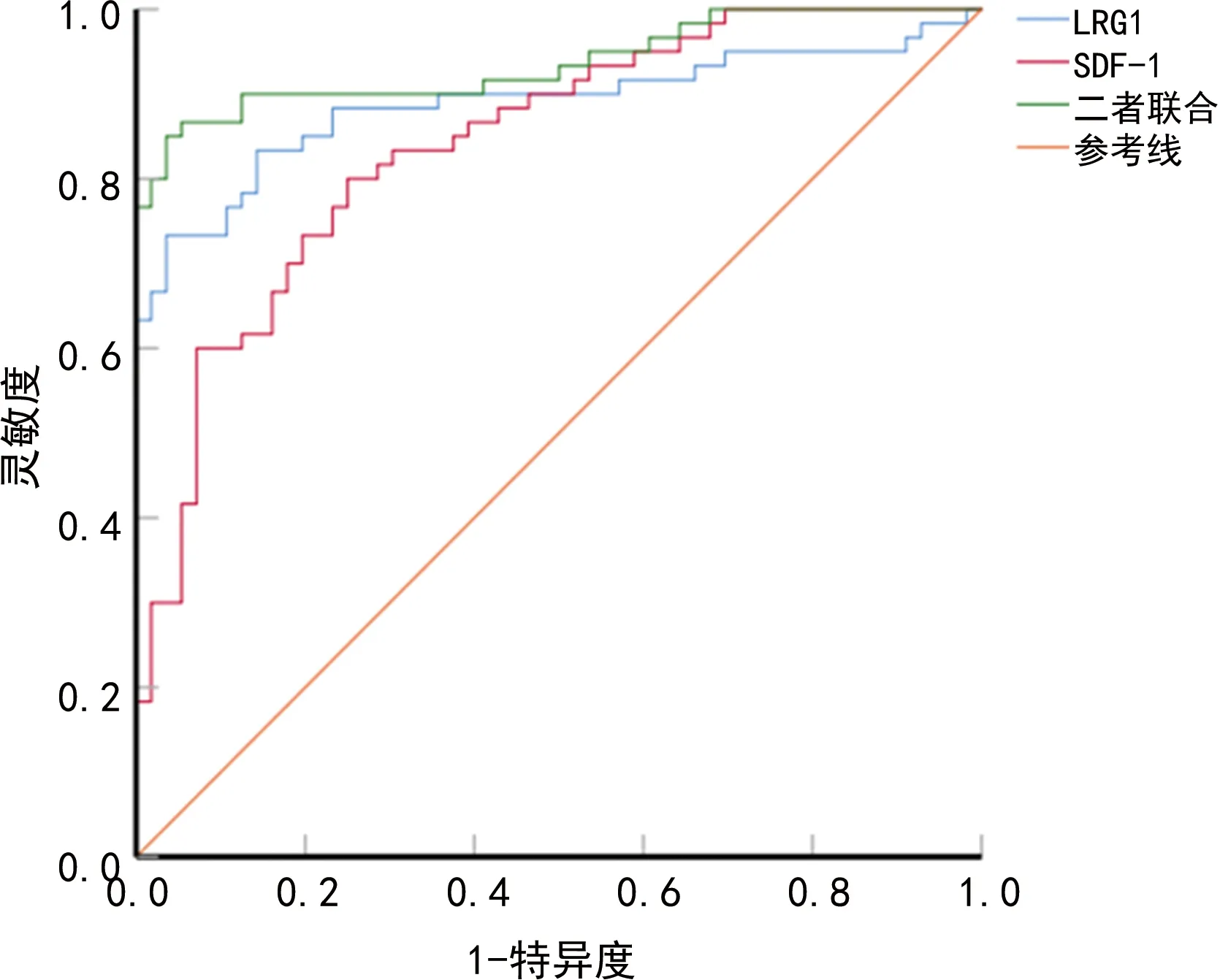
图1 血清LRG1和SDF-1水平预测早期胃癌患者ESD术后复发的ROC曲线

表4 血清LRG1和SDF-1水平对早期胃癌患者ESD术后复发的预测价值
3 讨 论
胃癌是较为常见的消化道恶性肿瘤之一,据统计,我国胃癌的发病及病死率均居于世界前列。临床上根据癌组织浸润面积的大小等指标,将胃癌分为早期胃癌和进展期胃癌,其中癌组织浸润区域只存在于黏膜层及黏膜下层的称为早期胃癌,早期胃癌患者由于诊断及时、治疗效果显著通常预后良好,生存率较高[11-12]。ESD是治疗早期胃癌的一种方法,由于ESD具有治疗效果显著,术后患者恢复速度快等特点,目前是临床针对早期胃癌最常用的治疗方法[13]。但由于ESD无法处理伴有淋巴结转移的癌组织,导致部分患者行ESD后发生术后复发[14]。因此,寻找能够预测ESD术后复发的特异性指标,尽早采取相应治疗措施,对改善早期胃癌患者的预后状态具有重要意义。
LRG1是一种蛋白类活性物质,有研究表明,LRG1能够参与并影响细胞间的信号传递、调控细胞黏附、分化等生理过程[15]。本研究中,ESD术后复发组血清LRG1水平相较于未复发组显著升高(P<0.05)。田薇等[16]的研究表明,相较于癌旁组织,LRG1在胃癌组织中呈高表达,这与本研究结果一致。乔海霞等[17]研究显示,LRG1能够通过Smad等途径促进生长因子之间的信号传导,从而参与肿瘤细胞的分化、转移、凋亡等生理过程。上述结果初步提示,LRG1的高表达能够促进早期胃癌患者行ESD后发生术后复发,可能是预测早期胃癌患者ESD术后复发的特异指标。
SDF-1是一种具有趋化作用的细胞因子,有研究表明,SDF-1在多种恶性肿瘤转移、分化等生理过程中发挥着重要作用[18]。WEI等[19]的研究表明,SDF-1能够促进胰腺癌的发展,WANG等[20]也表示SDF-1与肺癌、乳腺癌、胃癌等恶性肿瘤的生长均密切相关。本研究结果表明,与未复发组相比,复发组血清SDF-1水平显著升高(P<0.05)。张伟等[21]研究表明,SDF-1在胃癌组织中呈现出高表达,其对癌变组织的分化、转移等过程均有影响,这与本研究结果一致。分析原因可能为,SDF-1的高表达可以通过激活SDF-1α/CXC趋化因子受体7(CXCR7)通路来参与并调控多种恶性肿瘤的发生与发展,导致术后复发的可能性增大[22]。上述结果提示,早期胃癌患者血清中SDF-1的高表达与ESD术后复发的发生密切相关。相关性分析结果显示,ESD术后复发患者血清LRG1和SDF-1水平呈正相关(r=0.962,P<0.05),表明LRG1和SDF-1水平升高均可促进早期胃癌患者ESD术后复发,并且淋巴结转移、LRG1和SDF-1水平升高均为早期胃癌患者ESD术后复发的危险因素(P<0.05),而血清LRG1和SDF-1联合预测早期胃癌患者ESD术后复发的AUC为0.936,高于血清LRG1和SDF-1单独预测,AUC分别为0.888、0.841。
综上所述,血清LRG1和SDF-1的水平与早期胃癌患者ESD术后复发密切相关,二者联合检测对早期胃癌患者ESD发生术后复发具有较好的预测价值。

