大豆苷元调节SIRT1/AMPK信号通路对非酒精性脂肪肝大鼠自噬反应的影响
吴德建,杨 秋,谢桂丹,彭 鑫
儋州市人民医院:1.消化内科;2.检验科,海南儋州 571799
近年来,肥胖和2型糖尿病患病率上升,非酒精性脂肪肝(NAFLD)发病率亦持续上升且呈低龄化趋势,并随着病程延长,非酒精性单纯性脂肪肝可能发展为非酒精性脂肪肝炎,甚至发展成肝硬化、肝细胞癌[1-2]。目前,由于NAFLD诊断困难、发病机制复杂、缺乏标准的治疗方法,其仍是世界范围内的公共卫生问题[3]。因此,寻找安全、高效的早期干预措施阻滞或延缓NAFLD病情进展具有重要意义。大豆苷元(DAI)是一种大豆异黄酮,具有抗炎和抗氧化作用,已有研究表明DAI预处理可减轻刀豆球蛋白A诱导的肝损伤小鼠氧化应激和肝细胞凋亡[4]。自噬作为一种通过溶酶体吞噬降解自身组分的细胞内分解代谢途径,在调节胰岛素抵抗、脂质代谢和改善NAFLD的肝细胞脂肪变性中发挥重要作用[5]。激活沉默信息调节因子1(SIRT1)/腺苷酸活化蛋白激酶(AMPK)信号通路增强自噬,可减轻高脂饮食喂养的NAFLD大鼠脂质沉积[6]。此外,DAI治疗糖尿病大鼠可升高AMPK和SIRT1表达水平,降低血糖并调节血脂水平,减轻氧化应激,缓解心肌组织损伤[7]。基于此,笔者推测DAI可能通过调节SIRT1/AMPK信号通路激活自噬反应,减轻NAFLD大鼠肝脏损伤。为验证上述猜测,本研究着重观察DAI在改善NAFLD大鼠肝脏损伤时对自噬及SIRT1/AMPK信号通路的影响,以期为NAFLD的药物治疗提供实验依据。
1 材料与方法
1.1实验动物 60只健康雄性SD大鼠,无特定病原体(SPF)级,6~7周龄,体重(200±10)g,由中国科学院上海药物研究所提供,生产许可证号:SCXK(沪)2020-0005。大鼠饲养环境:温度(23±2)℃,湿度(50±5)%,12 h光/暗循环,自由饮水摄食。本研究遵循《实验动物保护条例》相关规定,符合动物实验学“3R”原则(即减量化原则、再使用原则、再循环原则)。
1.2试剂与仪器 DAI(上海源叶生物科技有限公司,货号:B20227-20 mg);SIRT1抑制剂(EX-527,美国MCE公司,货号:HY-15452);天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆固醇(TC)、甘油三酯(TG)测定试剂盒(南京建成生物工程研究所);苏木素-伊红(HE)染色试剂盒、原位末端标记法(TUNEL)凋亡检测试剂盒(北京索莱宝科技有限公司,货号:G1120-100、T2130-50T);免疫组化试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-IR-R215);SYBR Green Realtime PCR Master Mix(日本TOYOBO公司,货号:QPK-201);微管相关蛋白1轻链3(LC3)、Beclin-1、p62、SIRT1、AMPK、磷酸化的AMPK(p-AMPK)、GAPDH抗体(兔抗)及辣根过氧化物酶(HRP)标记羊抗兔IgG(美国Abcam公司)。cobas c 311全自动生化分析仪(德国罗氏诊断);Sunrise酶标仪(上海帝肯贸易有限公司);E100生物显微镜(日本尼康公司);ABI 7500 RT-qPCR仪(美国Thermofisher公司);ZF-268全自动凝胶成像分析系统(上海金鹏分析仪器有限公司)。
1.3分组、造模与给药 60只大鼠适应性饲养1周后按照随机数表法分为对照组、NAFLD组、DAI低剂量组(DAI-L组)、DAI高剂量组(DAI-H组)和DAI-H+EX-527组,每组12只。对照组大鼠给予普通饲料,其余组大鼠给予高脂饲料(普通饲料+10%猪油+1%胆固醇+0.5%胆酸钠等)以构建NAFLD模型,连续喂养12周[8-9]。造模结束后每组随机取2只大鼠处死,通过观察大鼠肝脏外部形态、肝组织病理学改变等判断是否造模成功。确定造模成功后,每组剩余的10只大鼠进行后续实验。参照文献[7,10]并结合预实验结果进行相应处理,DAI-L组、DAI-H组大鼠分别灌胃50、100 mg/kg DAI;DAI-H+EX-527组大鼠灌胃100 mg/kg DAI同时腹腔注射5 mg/kg EX-527;NAFLD组和对照组给予等量生理盐水。其中,DAI每天灌胃1次,EX-527每3天腹腔注射1次,连续6周。
1.4样本收集与肝脏指数检测 末次给药后大鼠禁食12 h,称取体重。随后腹腔注射50 mg/kg戊巴比妥钠麻醉大鼠,腹主动脉取血,血样4 ℃静置1 h后以3 000 r/min离心15 min,取上层血清,保存于-20 ℃冰箱。处死大鼠,摘取肝脏组织,使用4 ℃预冷的生理盐水清洗干净,并用滤纸吸除多余水分,称量肝脏湿重,计算每只大鼠肝脏指数[肝脏指数(%)=大鼠肝脏湿重(g)/大鼠体重(g)×100%][11]。称量肝脏湿重后立即将每只大鼠的肝脏组织分成4份,1份置于4%多聚甲醛中固定,1份使用生理盐水制备10%组织匀浆液,剩余2份置于-80 ℃冰箱保存。
1.5全自动生化分析仪检测血清肝功能指标及血脂水平 严格参照全自动生化分析仪及各自试剂盒操作说明,检测大鼠血清肝功能指标(AST、ALT)及血脂(TC、TG)水平。
1.6HE染色观察肝组织病理形态学 将固定24 h后的肝组织制成常规石蜡切片(厚度4 μm),切片经脱蜡、水化后进行苏木素、伊红染色,显微镜下观察大鼠肝组织病理形态学改变。采用NAFLD活动度积分(NAS)评价大鼠肝组织脂肪变性(0%~5%、>5%~33%、>33%~66%、>66%分别记为0、1、2、3分)、气球样变(无、不明显且少量、显著且大量分别记为0、1、2分)和肝小叶炎症程度(无、<2、2~4、>4级分别记为0、1、2、3分),计算总评分(即NAS评分,范围:0~8分)[12]。
1.7TUNEL法检测肝细胞凋亡率 4 μm厚的石蜡组织切片经脱蜡、水化后置于枸橼酸盐缓冲液中加热进行抗原热修复,3% H2O2灭活内源性酶后滴加TUNEL反应缓冲液,DAPI染核,荧光显微镜下观察染色结果。凋亡细胞呈绿色荧光,计算细胞凋亡率。
1.8免疫组化法检测肝组织中LC3阳性表达 4 μm厚的石蜡组织切片脱蜡至水、抗原热修复、灭活内源性酶后滴加正常山羊血清进行封闭,滴加一抗(LC3抗体)4 ℃孵育过夜,滴加聚过氧化物酶标记IgG抗体37 ℃孵育30 min,DAB显色、苏木素染细胞核,于显微镜下观察。阳性细胞呈棕黄色或褐黄色,Image ProPlus 6.0半定量软件测定阳性细胞平均光密度(MOD)。
1.9Western blotting检测肝组织中自噬及SIRT1/AMPK信号通路相关蛋白表达 RIPA裂解液充分裂解肝脏组织提取总蛋白,二喹啉甲酸(BCA)法定量蛋白浓度后将各样品蛋白浓度调整一致,取20 μg变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),切胶后转至聚偏氟乙烯(PVDF)膜,5%牛血清白蛋白(BSA)封闭膜2 h,膜与一抗稀释液(Beclin-1、p62、LC3、SIRT1、AMPK、p-AMPK、GAPDH抗体)4 ℃孵育过夜,洗涤后,放入辣根过氧化物酶(HRP)标记的二抗稀释液中,室温孵育1 h,化学发光试剂显色、曝光。Image J软件分析蛋白条带灰度,以GAPDH为内参蛋白。
2 结 果
2.1各组大鼠肝脏指数比较 对照组[(2.43±0.18)%]、NAFLD组[(3.75±0.25)%]、DAI-L组[(3.12±0.24)%]、DAI-H组[(2.71±0.20)%]、DAI-H+EX-527组[(3.42±0.26)%]大鼠肝脏指数比较,差异有统计学意义(P<0.05)。与对照组比较,NAFLD组大鼠肝脏指数升高(P<0.05);与NAFLD组比较,DAI-L组和DAI-H组大鼠肝脏指数降低(P<0.05),且DAI-H组低于DAI-L组(P<0.05);与DAI-H组比较,DAI-H+EX-527组大鼠肝脏指数升高,差异有统计学意义(P<0.05)。结果提示,DAI可减轻NAFLD大鼠肝脏损伤,而EX-527减弱了DAI的作用。
2.2各组大鼠血清AST、ALT、TC、TG水平比较 与对照组比较,NAFLD组大鼠血清AST、ALT、TC、TG水平升高(P<0.05);与NAFLD组比较,DAI-L组和DAI-H组大鼠血清AST、ALT、TC、TG水平降低(P<0.05),且DAI-H组低于DAI-L组(P<0.05);与DAI-H组比较,DAI-H+EX-527组大鼠血清AST、ALT、TC、TG水平升高(P<0.05)。见表1。各组大鼠血清指标比较结果提示,DAI可改善NAFLD大鼠血脂异常,而EX-527减弱了DAI的作用。

表1 各组大鼠血清AST、ALT、TC、TG水平比较
2.3各组大鼠肝组织病理形态学改变及NAS评分比较 对照组大鼠肝细胞排列整齐,大小均匀;NAFLD组大鼠肝组织中出现大量脂肪空泡、明显气球样变及炎性细胞浸润和细胞坏死;DAI-L组和DAI-H组大鼠上述肝组织病理学损伤均有不同程度改善,其中DAI-H组改善更为明显;相比于DAI-H组,DAI-H+EX-527组大鼠肝组织病理学损伤加重。对照组、NAFLD组、DAI-L组DAI-H组、DAI-H+EX-527组NAS评分分别为(0.00±0.00)、(6.54±0.78)、(4.72±0.62)、(2.65±0.54)、(5.48±0.70)分;NAFLD组NAS评分高于对照组,DAI-L组和DAI-H组NAS评分均低于NAFLD组,DAI-H+EX-527组高于DAI-H组(P<0.05)。见图1。结果提示,DAI可改善NAFLD大鼠肝组织病理学损伤,而EX-527减弱了DAI的作用。

图1 各组大鼠肝组织HE染色结果
2.4各组大鼠肝细胞凋亡率比较 与对照组[(6.51±1.12)%]比较,NAFLD组大鼠肝细胞凋亡率[(35.62±3.98)%]升高(P<0.05);与NAFLD组比较,DAI-L组和DAI-H组大鼠肝细胞凋亡率[(24.24±3.27)%、(10.35±2.59)%]降低(P<0.05),且DAI-H组低于DAI-L组(P<0.05);与DAI-H组比较,DAI-H+EX-527组大鼠肝细胞凋亡率[(26.36±3.18)%]升高(P<0.05)。见图2。结果提示,DAI可缓解NAFLD大鼠肝细胞凋亡,而EX-527减弱了DAI的作用。

图2 各组大鼠肝细胞凋亡TUNEL染色结果
2.5各组大鼠肝组织中LC3阳性表达水平比较 LC3主要表达于细胞核中,LC3阳性细胞核内可见棕黄色或褐黄色颗粒。各组阳性表达水平比较:与对照组(0.93±0.10)比较,NAFLD组大鼠肝组织中LC3阳性细胞数量较少,颜色较浅,LC3阳性表达水平(0.48±0.14)降低(P<0.05);与NAFLD组比较,DAI-L组和DAI-H组大鼠肝组织中LC3阳性细胞数量较多,颜色较深,LC3阳性表达水平[(0.66±0.13)、(0.85±0.15)]升高(P<0.05),且DAI-H组变化更为明显(P<0.05);与DAI-H组比较,DAI-H+EX-527组大鼠肝组织中LC3阳性细胞数量减少,颜色变浅,LC3阳性表达水平(0.57±0.12)降低(P<0.05)。见图3。结果提示,DAI可能通过促进LC3表达增强NAFLD大鼠肝组织自噬反应,而EX-527减弱了DAI的作用。
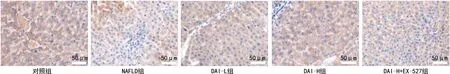
图3 各组大鼠肝组织中LC3免疫组化结果
2.6各组大鼠肝组织中Beclin-1、p62、LC3蛋白表达水平比较 与对照组比较,NAFLD组大鼠肝组织中Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达水平降低(P<0.05),p62蛋白表达水平升高(P<0.05);与NAFLD组比较,DAI-L组和DAI-H组大鼠肝组织中Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达水平升高(P<0.05),p62蛋白表达水平降低(P<0.05),且DAI-H组变化更为明显(P<0.05);与DAI-H组比较,DAI-H+EX-527组大鼠肝组织中Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达水平降低(P<0.05),p62蛋白表达水平升高(P<0.05)。见图4、表2。结果提示,DAI可能通过促进自噬体形成提高NAFLD大鼠肝组织自噬水平,而EX-527减弱了DAI的作用。

表2 各组大鼠肝组织中Beclin-1、p62、LC3蛋白表达水平比较

图4 各组大鼠肝组织中Beclin-1、p62、LC3 Western blotting检测结果
2.7各组大鼠肝组织中SIRT1、AMPK、p-AMPK蛋白表达水平比较 与对照组比较,NAFLD组大鼠肝组织中SIRT1、p-AMPK/AMPK蛋白表达水平降低(P<0.05);与NAFLD组比较,DAI-L组和DAI-H组大鼠肝组织中SIRT1、p-AMPK/AMPK蛋白表达水平升高(P<0.05),且DAI-H组高于DAI-L组(P<0.05);与DAI-H组比较,DAI-H+EX-527组大鼠肝组织中SIRT1、p-AMPK/AMPK蛋白表达水平降低(P<0.05)。见图5、表3。结果提示,DAI可激活NAFLD大鼠肝组织中SIRT1/AMPK通路,而EX-527减弱了DAI的作用。
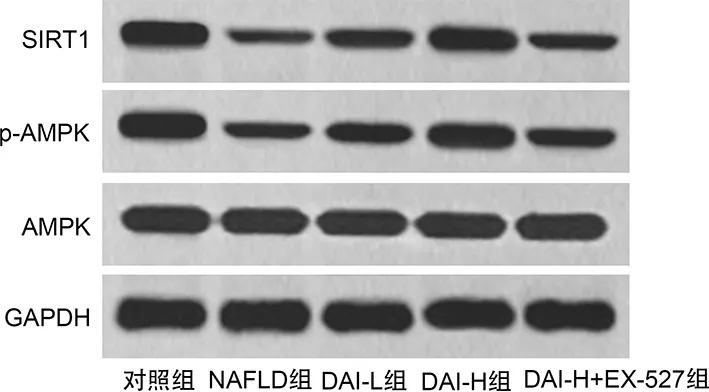
图5 各组大鼠肝组织中SIRT1、AMPK、p-AMPK Western blotting检测结果

表3 各组大鼠肝组织中SIRT1、p-AMPK/AMPK蛋白表达水平比较
3 讨 论
目前,饮食调节、加强体育锻炼等仍是NAFLD的主要干预措施,治疗药物也仅限于吡格列酮和维生素E,但均存在一定不良反应[13]。据报道,自噬参与调节肝脏脂质代谢、炎症和纤维化等病理变化,是代谢相关脂肪肝病的一个新治疗靶点[14]。恩格列净通过激活自噬和减少肝细胞凋亡减轻高脂饮食喂养ApoE-/-小鼠NAFLD进展[15]。卡格列净通过调节脂质代谢和抑制炎症来改善NAFLD的机制与促进自噬有关[16]。故调节自噬反应在NAFLD的药物治疗中可能具有重要意义。
DAI作为大豆异黄酮的主要成分之一,具抗炎、抗氧化应激、抗癌等多种生物学活性[17-18]。DAI预处理不仅通过抑制炎症和氧化应激改善脂多糖诱导的肝细胞损伤[19],而且可减轻刀豆球蛋白A诱导的肝损伤小鼠氧化应激和肝细胞凋亡[4],但DAI对NAFLD是否发挥治疗作用尚有待挖掘。本研究通过高脂饲料喂养成功复制了NAFLD大鼠模型,具体表现在肝脏指数,血清AST、ALT、TC、TG水平,NAS评分,肝细胞凋亡率升高,且肝组织中出现大量脂肪空泡、明显气球样变,以及炎性细胞浸润和细胞坏死。而DAI干预NAFLD大鼠后,肝脏指数,血清AST、ALT、TC、TG水平,NAS评分,肝细胞凋亡率降低,表明DAI治疗NAFLD大鼠同样具有调节血脂水平,减少肝细胞凋亡,改善肝功能,减轻肝脏损伤的功效。
据报道,DAI衍生物X-11-5-27通过促进自噬抑制NLRP3炎性体活性[20]。大豆异黄酮通过刺激BEX2/BNIP3/NIX通路激活线粒体自噬来保护SH-SY5Y神经元[21]。但DAI是否可通过激活自噬减轻NAFLD中肝脏损伤尚不明确。本研究中,NAFLD模型大鼠肝组织中自噬标志物(LC3)阳性表达水平,自噬启动的关键调节因子(Beclin-1)、自噬体成熟标记物(LC3-Ⅱ/LC3-Ⅰ)蛋白表达水平均降低,而自噬的选择性底物(p62)蛋白表达水平均升高。本研究结果表明,高脂饲料诱导的NAFLD大鼠中自噬水平降低。进一步分析发现,DAI干预NAFLD大鼠后肝组织中LC3阳性表达水平,Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达水平均升高,而p62蛋白表达水平降低,表明DAI可增强NAFLD大鼠肝组织中自噬反应。
有研究显示,多条信号通路如AMPK/mTOR、SIRT1/AMPK等均参与自噬调节,并减轻肝损伤[22-23]。但DAI通过调节哪条信号通路增强NAFLD大鼠自噬反应进而减轻肝脏损伤有待进一步探索。SIRT1可以直接与AMPK启动子结合,二者结合后AMPK可以激活SIRT1的表达,SIRT1的表达也可以激活AMPK,进而形成正反馈回路[24]。本研究中,NAFLD模型大鼠肝组织中SIRT1、p-AMPK/AMPK蛋白表达水平降低,而DAI干预NAFLD大鼠后SIRT1、p-AMPK/AMPK蛋白表达水平升高,提示DAI可促进NAFLD大鼠肝组织中SIRT1/AMPK信号通路激活。为了更充分地验证SIRT1/AMPK信号通路的作用,本研究在DAI干预基础上给予SIRT1抑制剂(EX-527),结果显示,EX-527不仅可抑制SIRT1/AMPK信号通路激活,而且能够减弱DAI对NAFLD大鼠肝脏损伤的改善作用。以上研究结果说明,DAI可能通过促进SIRT1/AMPK信号通路激活增强自噬反应,同时调节血脂水平、增强抗氧化能力、减少肝细胞凋亡、改善肝功能,进而减轻NAFLD大鼠肝脏损伤。PANT等[25]研究亦显示,富硒益生菌通过上调AMPK、SIRT1表达激活自噬改善高糖高脂饮食诱导的NAFLD大鼠肝功能、肝脂肪变性等症状。
综上所述,DAI可能通过促进SIRT1/AMPK信号通路激活增强自噬反应,减轻NAFLD大鼠肝脏损伤。本研究为NAFLD的治疗药物选择和治疗靶点设计提供了一定理论基础。但由于受实验经费、实验条件等限制,本研究尚存在一定不足之处:(1)未通过电镜观察肝组织中自噬小体变化;(2)未采用特异性抑制剂直接干预AMPK;(3)DAI是否还可通过其他通路调控NAFLD中自噬反应尚不明确;(4)DAI的最佳给药剂量和给药方式仍不清楚等。本课题组将在后续实验中进一步完善相关研究,从而为DAI用于NAFLD治疗提供更多证据。

