潮汕地区脑梗死患者CYP2C19基因多态性分析*
陈 暖,陈鑑强,彭学宏,肖颖秀
(汕头大学医学院第一附属医院:1.检验科;2.胸外科;3.神经内科,广东汕头 515041)
脑梗死又称缺血性中风,是临床常见的脑部疾病[1],世界卫生组织《全球疾病》数据报告,脑梗死是全球人口死亡的第二大原因,也是导致残疾的主要原因[2-3]。目前,治疗脑梗死的基石是抗血小板治疗[4]。抗血小板治疗可以减少缺血性脑损伤的体积,使脑梗死早期复发的风险降低,从而降低早期的死亡率,改善幸存者的长期预后。然而,抗血小板治疗也可能增加患者致命或致残性颅内出血的风险[5]。脑梗死抗血小板治疗过程中最常用的两种药物是阿司匹林和氯吡格雷。PACIARONI等[6]研究显示,与阿司匹林相比,氯吡格雷单药治疗发生主要不良心脑血管事件、复发性卒中和出血事件的风险更低。实验研究和临床研究表明,氯吡格雷治疗个体反应差异很大,部分接受氯吡格雷治疗的患者对氯吡格雷治疗无反应或不能达到预期的抗血小板效果,在临床上称为氯吡格雷耐药(CR)[7]。合并CR的患者发生复发性缺血性卒中(RIS)或其他血管事件的风险增加[8-10]。氯吡格雷是硫代吡啶类化合物,对P2Y12受体有不可逆的抑制作用[11]。它们是必须在肝脏中代谢的前药物[12]。氯吡格雷的活性代谢物与P2Y12的半胱氨酸残基共价结合,阻止与二磷酸腺苷(ADP)的结合,抑制了血小板的聚集[13]。多项研究表明,氯吡格雷耐药与细胞色素P450基因突变相关。该基因编码的酶是氯吡格雷代谢和催化过程中的关键酶,约45%由CYP2C19蛋白介导,CYP2C19是CYP450酶第二亚家族中的重要成员[14-15],是人体重要的药物代谢酶,而CYP2C19 基因多态性可以部分解释氯吡格雷药效的可变性[16],任何一个环节的突变都会削弱氯吡格雷抑制血小板聚集的作用,从而导致血栓形成。
目前,潮汕地区氯吡格雷的使用较为普遍,氯吡格雷耐药患者并不在少数,但相关研究及报道却不多。本研究旨在对潮汕地区脑梗死患者CYP2C19基因型检测结果进行统计,分析其基因分布情况,从个体基因差异的角度为潮汕地区脑梗死患者的个体化精准治疗提供基因组学的依据。
1 资料与方法
1.1 一般资料
选取 2016 年7月至 2021年8月汕头大学医学院第一附属医院住院的脑梗死患者345例,年龄25~90岁。入组标准:符合中华医学会神经病学分会脑血管病学组制订的脑梗死诊断标准,潮汕籍,汉族,无家族遗传病史,相互之间无血缘关系。根据代谢状态分为快代谢型(extensive metabolizers,EM)、中代谢型(intermediate metabolizers,IM)和慢代谢型(poor metabolizers,PM)3种[17]。研究经过本院伦理委员会审查通过且患者知情同意。
1.2 仪器与试剂
自动核酸提取仪(LabAid820)、GenePro(TC-E)PCR扩增仪、全自动杂交仪(BR-526-24)、生物芯片识读仪(BE-2.0);核酸提取试剂(厦门致善科技有限公司)、CYP2C19基因检测试剂盒(上海百傲科技有限公司)。
1.3 方法
抽取患者静脉血2 mL,放入含有EDTA抗凝剂的采血管中。采用PCR和DNA微阵列芯片法进行CYP2C19基因型检测。步骤:DNA提取、试剂配制、点样、扩增、杂交显色、芯片扫描、基因型图像分析。
1.4 统计学处理
采用SPSS 25.0统计软件进行统计分析,计数资料以例数或百分数表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 CYP2C19基因多态性
345例患者共检出5种CYP2C19基因型:野生型*1/*1 (636GG,681GG)、杂合突变型*1/*2 (636GG,681GA)、杂合突变型*1/*3 (636GA,681GG)、双突变型*2/*2 (636GG,681AA)、双突变型*2/*3 (636GA,681GA)。分别检出124 例(35.94%)、137 例 (39.71%)、19例 (5.51%)、47例(13.62%)、18例(5.22%)。等位基因CYP2C19 *1 404例(58.55%)、CYP2C19 *2 249例(36.09%)、CYP2C19 *3 37例(5.36%)。EM 124例(35.94%)、IM 156例(45.22%)、PM 65例(18.84%)。
2.2 CYP2C19基因频率及Hardy-Weinberg遗传平衡检验
在所有病例中,基因多态性CYP2C19 *2中等位基因(G)频率为63.91%,等位基因(A)频率为36.09%(χ2=0.234,P>0.05);基因多态性CYP2C19 *3中等位基因(G)频率为94.64%,等位基因(A)频率为5.36%(χ2=0.031,P>0.05),以上两个基因频率均符合遗传平衡法则,见表1。
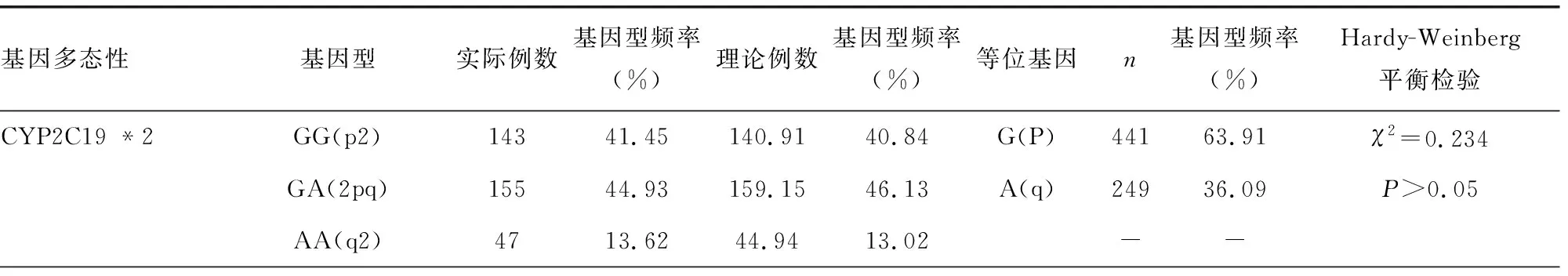
表1 CYP2C19基因频率及Hardy-Weinberg遗传平衡检验[n(%)]
2.3 不同性别病例的基因型、等位基因、代谢型频率分布
本研究将脑梗死患者按性别分为男、女两个组,男、女性脑梗死患者CYP2C19基因型分布差异无统计学意义(χ2=4.732,P=0.316);等位基因频率分布差异无统计学意义(χ2=2.830,P=0.243);代谢型分布差异无统计学意义(χ2=2.467,P=0.291),见表2。
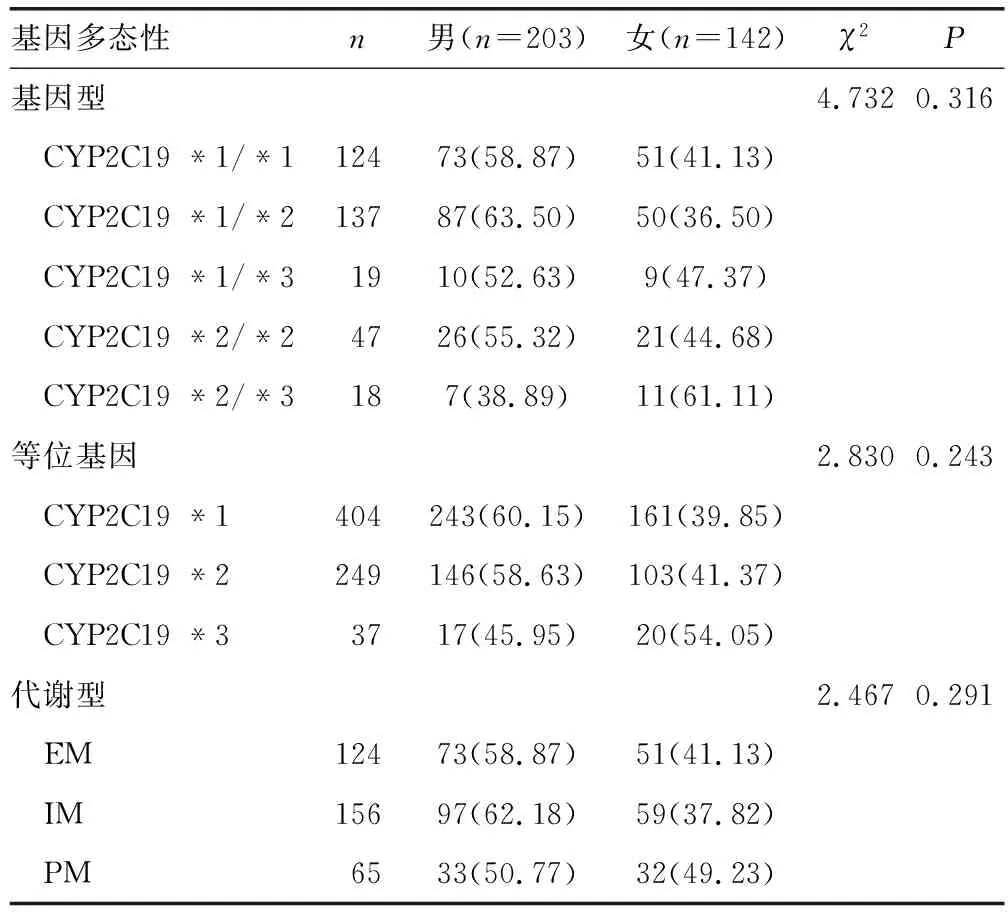
表2 不同性别病例的基因型、等位基因、代谢型频率分布 [n(%)]
2.4 不同年龄段病例的基因型、等位基因、代谢型频率分布
本研究将脑梗死患者按发病年龄分为青年组(25~45岁)10例;中年组(46~69岁)219例;老年组(>69岁)116例。不同年龄的脑梗死患者CYP2C19基因型分布差异无统计学意义(χ2=5.894,P=0.659);等位基因频率分布差异无统计学意义(χ2=3.824,P=0.430);代谢型分布差异无统计学意义(χ2=2.557,P=0.635),见表3。
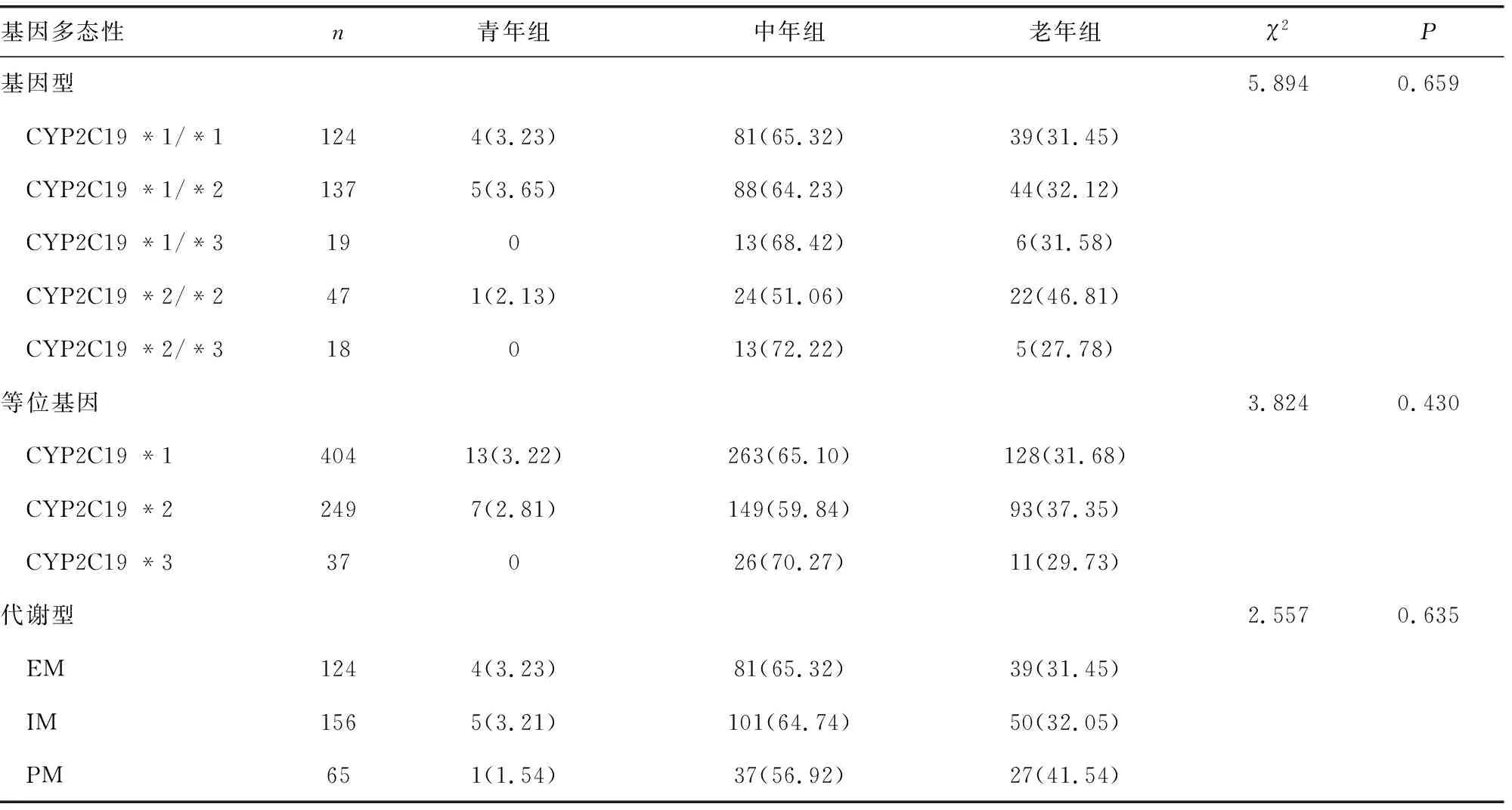
表3 不同年龄段病例的基因型、等位基因、代谢型频率分布 [n(%)]
2.5 不同类型脑梗死患者CYP2C19的基因型、等位基因、代谢型频率分布
本研究对345例脑梗死患者按临床分型分为血栓性脑梗死组261例、腔隙性脑梗死组80例、脑栓塞组4例。不同类型脑梗死患者CYP2C19基因型分布差异无统计学意义(χ2=10.174,P=0.253);等位基因频率分布差异无统计学意义(χ2=7.124,P=0.129);代谢型分布差异无统计学意义(χ2=5.910,P=0.206),见表4。
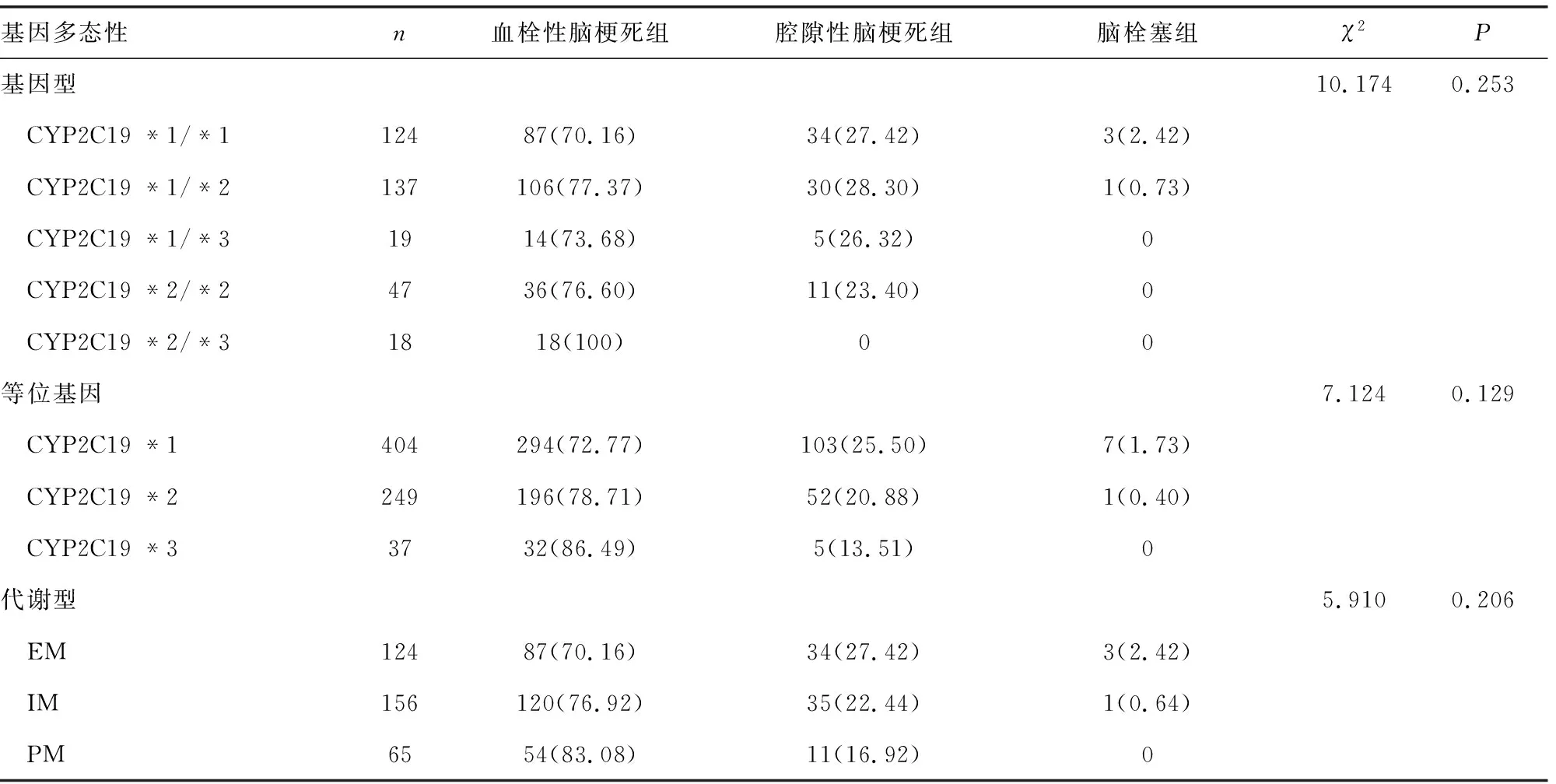
表4 不同类型脑梗死患者CYP2C19的基因型、等位基因、代谢型频率分布[n(%)]
3 讨 论
已知人类CYP超家族包括14个家族26个亚家族,50多个具有催化功能的亚型参与了临床70%以上药物的代谢。CYP1、CYP2和CYP3是参与药物代谢的主要家族,CYP3A4、CYP3A5和CYP2C19共同参与氯吡格雷的代谢,CYP2C19在多种重要药物的代谢中起主导作用[18]。CYP2C19多态性导致多种药物分解的个体间和种族间变异,心脑血管疾病患者对氯吡格雷的临床反应差异较大,也与CYP2C19基因多态性密切相关[19-21]。美国食品和药物管理局在氯吡格雷标签上使用了一种方框警告,描述了CYP2C19的药物遗传学和药物反应之间的关系,特别是注意到该药物在PM患者中的有效性降低[22]。在亚洲人中,最常见的基因型是CYP2C19*1、CYP2C19*2和CYP2C19*3、CYP2C19*5和CYP2C19*6,第1个最重要的非功能等位基因是CYP2C19*2和CYP2C19*3。CYP2C19*2在人群中出现频率高于CYP2C19*3,在上述基因型中,不携带CYP2C19*2和CYP2C19*3等位基因编码的酶的活性最高[23],即CYP2C19*1/*1,它被定义为快代谢型。此外,携带2个非功能等位基因(*2/*2 /*3和*3/*3编码)的酶的活性最低,被定义为慢代谢型[24];携带非功能性等位基因(*1/*2或*1/*3编码)的酶的活性介于这2个之间,被定义为中代谢型。目前,人们对于氯吡格雷耐药的发生机制尚未完全了解,其影响因素可分为内部因素和外部因素[13]。外部因素包括患者的生活习惯、服药依从性、药物相互作用等,内部因素主要包括个体遗传差异,而CYP2C19基因多态性就是一个重要的内部因素。
本研究采用PCR和DNA微阵列芯片法,在345例脑梗死患者中,共检出5种CYP2C19基因型:野生型*1/*1(636GG,681GG) 124 例,占35.94%;杂合突变型*1/*2(636GG,681GA) 137例,占39.71%;杂合突变型*1/*3(636GA,681GG) 19例,占5.51%;双突变型*2/*2(636GG,681AA) 47例,占13.62%;双突变型*2/*3(636GA,681GA) 18例,占5.22%。未检出双突变型*3/*3(636AA,681GG),这在一定程度上说明这种基因型在潮汕地区人群中的分布频率较低。上述结果显示,潮汕地区脑梗死患者CYP2C19 的基因型、等位基因及代谢型分布的差异与性别、年龄无明显相关性(P>0.05)。本文还研究了CYP2C19基因型分布频率与脑梗死的类型的相关性,结果显示,基因型分布频率与脑梗死的类型无明显相关性(P>0.05)。但因收集到的脑栓死患者病例数较少,所以该结果还有待收集更多病例后再做进一步的确认。另外,本研究结果还显示,中代谢型患者例数最多(45.22%),慢代谢型患者例数最少(18.84%),这与我国其他地区的研究结果[25-26]相似,提示可能存在较高抵抗率。临床药物基因学实施联盟(CPIC)指南建议具有CYP2C19 慢代谢型和中代谢型的患者应考虑改变治疗[27],因此在治疗过程中,可以先进行CYP2C19基因多态性检测,再根据基因分型帮助临床医生将患者转向更有效的抗血小板治疗,如普拉格雷或替格瑞洛,以克服其对氯吡格雷的不良反应,使脑梗死患者得到更为个体化的精准用药。
本研究旨在用上述指标为潮汕地区不同类型脑梗死患者提供氯吡格雷用药指导,为个体化抗血小板聚集治疗方案提供基因组学依据。脑梗死患者可根据CYP2C19基因多态性来调整用药,在不增加复发风险和不良反应的前提下最大化治疗效果,这对潮汕地区患者开展个性化抗血小板治疗具有重要意义。

