ABO血型不相容肾移植治疗终末期肾病的关键临床问题探讨
徐小松
(陆军军医大学第一附属医院肾科,重庆 400038)
终末期肾病(end stage renal disease,ESRD)严重危害人类健康,截至2022年底,我国登记透析的ESRD患者984 809例,2022年新增177 445例,患病率呈逐年上升趋势,形势严峻。肾移植是ESRD的最佳治疗手段[1-3],2022年登记等待肾移植的ESRD患者113 272例,同年完成肾移植12 712例,登记等待肾移植的ESRD患者有机会完成肾移植者仅占11.2%,ESRD患者需等待数年才可能有机会完成肾移植[1-2],不少患者在等待中去世[4]。异种移植和人造器官尚未进入临床使用。有意愿进行活体捐献肾移植的ESRD患者中,约1/3因ABO血型不相容,无法进行肾移植[1,5]。ABO血型不相容肾移植(ABO blood group system incompatible kidney transplantation,ABOi-KT)可以让这约1/3的ABO血型不相容的活体捐献肾移植得以完成。2004年美国全国统计数据显示,开展ABOi-KT可让3 500例ESRD患者获得肾移植机会[6],而美国人口仅为中国的1/3,可见ABOi-KT是ESRD治疗过程中缓解器官短缺的一个有效途径[1-2,7]。
1 ABOi-KT发展史
1.1 ABOi-KT国际发展史
ABOi-KT发展史大致分为3个阶段:早期阶段、脾切除方案阶段和非脾切除方案阶段。
早期阶段(1952-1984年),也叫无预处理阶段。自1952年HUME等[8]进行世界上第1例ABOi-KT到1964年,STARZL等[9]、OTA等[10]、SONODA等[11]分别进行了ABOi-KT尝试,多以失败告终。1967年GLEASON等[12]整理过往ABOi-KT研究资料显示ABOi-KT效果并不理想,之后进入停滞。
脾切除方案阶段(1985-2000年)。1985年ALEXANDRE等[13]采用脾切除+血浆置换(plasma exchange,PE)作为预处理方案,1987年BANNETT等[14]采用脾切除+免疫吸附(immunoadsorption,IA)作为预处理方案,1989年SATO等[15]采用脾切除+双重血浆置换(double filtration plasmapheresis,DFPP)+ IA作为预处理方案,ABOi-KT均获得成功。SHIMMURA等[16]总结了单中心67例ABOi-KT长期预后与ABO血型相合肾移植(ABO-compatible kidney transplantation,ABOc-KT)一致。这一阶段的探索,为ABOi-KT的快速发展奠定了坚实的基础并树立了信心。
非脾切除方案阶段(2001年至今)。脾切除方案预处理效果确切,但脾切除毕竟是手术,创伤较大,随着生物技术的发展,单抗等生物制剂不断涌现,2001年,GENBERG等[17]、TYDÉN等[18]开始了非脾切除预处理方案的探索,形成了两种主要方案:美国方案和亚欧方案。美国方案[19]:术前10 d口服免疫抑制剂+PE+静脉丙种球蛋白(intravenous immunoglobulin G,IVIG)+达利珠单抗;亚欧方案:术前2~4周CD20+口服免疫抑制剂+CD25/抗胸腺细胞球蛋白(antithymocyte globulin,ATG)+PE/DFPP。非脾切除方案与脾切除方案疗效相当,避免了脾切除手术创伤,得到了广泛应用,已完全替代脾切除方案,ABOi-KT在全球得到快速发展。
1.2 ABOi-KT中国发展史
我国的ABOi-KT起步较晚,2006年12月王毅等[20]完成国内第1例ABOi-KT,随后发展缓慢,仅有少数肾移植中心开展;2016年《ABO血型不相容亲属活体肾移植临床诊疗指南》发布,推动了我国ABOi-KT快速发展,目前有40余家肾移植中心陆续开展了ABOi-KT,2021年ABOi-KT较2020年增长超过100例,发展势头良好。
2 ABO血型抗体
ABOi-KT和ABOc-KT最大的不同在于ABOi-KT不符合输血原则,受者体内存在攻击供肾的ABO血型抗体,清除ABO血型抗体是保障ABOi-KT成功的关键。
2.1 初始ABO血型抗体滴度
初始ABO血型抗体滴度各中心标准不一,瑞典TYDÉN等[21]、荷兰VAN AGTEREN等[22]将1∶128作为上限;意大利SILVESTRE等[23]将1∶512设为上限;美国MONTGOMERY等[24]研究中显示,初始ABO血型抗体滴度>1∶512也可进行ABOi-KT。另有报道初始抗体滴度>1∶2 048进行ABOi-KT,术后恢复良好[25]。笔者完成病例中,最高初始抗体滴度1∶512,术后随访1.5年,情况良好。初始抗体滴度目前尚无统一标准,抗体滴度高不是绝对禁忌证,但抗体滴度越高,预处理时间越长,PE和(或)DFPP次数越多,花费越高,出血、感染等风险也会增加。初始抗体滴度>1∶512的患者,需进行严格评估和严密观察。
2.2 围手术期ABO抗体滴度
(1)ABO抗体滴度目标值。抗体滴度目标值尚无统一标准,国际、国内差异较大,1∶4~1∶32不等,均能取得良好结果。多数移植中心将抗体滴度≤1∶16作为目标值。笔者所在中心也采用抗体滴度≤1∶16作为目标值。(2)抗体滴度检测。抗体滴度常用检测方法有盐水介质凝集试验和胶体介质凝集试验,不同方法检测结果存在较大差异,胶体介质凝集试验检测结果更为稳定。不同检测人员判读,结果可存在较大差异,建议固定检测人员进行检测。
2.3 ABO血型抗体清除
ABO血型抗体清除方法见表1。4种清除抗体的方法各有优缺点,均能达到很好的效果,可单用其一,也可联合使用,根据所在医院情况,选择熟悉和擅长的方法。一般隔天1次,也可根据需要设定频次。ABO血型抗体特异性吸附在欧洲使用较为广泛,特异性高,费用昂贵,据了解,国内尚未上市。PE、DFPP、蛋白A吸附柱是国内常用方法,PE、DFPP使用尤其广泛,受制于血浆紧缺和过敏发生率较高,笔者多采用DFPP,建议每次DFPP结束后查凝血功能,根据结果补充纤维蛋白原,避免严重的凝血功能障碍、出血。

表1 4种清除ABO血型抗体的方法比较
2.4 围手术期ABO血型抗体监测和处理
(1)术前:建议PE、DFPP、IA后次日检测抗体滴度。(2)术后:第1周建议每日检测,便于判断是否需要给予PE或DFPP或IA治疗,如抗体滴度反弹未超过目标值,移植肾功能恢复良好,一般无须进行抗体清除治疗,定期监测即可。
3 围手术期血液制品使用
红细胞、血小板等有形成分与受者同血型,使用AB型血浆和冷沉淀,避免输入带ABO血型抗体发生排斥反应,导致移植肾功能恢复不良甚至移植肾丢失。有文献报道,30例O型受者使用供者同血型血浆,可以有效解决AB型血浆紧缺问题[3],但病例数较少,仅供参考,不做推荐。
4 抗CD20单抗的应用
抗CD20单抗已完全取代脾切除,成为目前ABOi-KT的标准诱导方案,避免了脾切除的手术创伤,预后优于脾切除方案。用法、用量尚无统一标准[26],使用时间为术前1~5周,大多于术前2~4周用药,剂量100~500 mg,目前多使用100~200 mg[27],CD19+B淋巴细胞计数<10/μL为达标,未达标者可重复使用。BARNETT等[28]根据初始抗ABO抗体滴度采用不同的策略,抗体滴度≤1∶8,仅使用抗CD20单抗;抗体滴度在1∶16~1∶64,使用抗CD20单抗+PE;抗体滴度>1∶64,使用抗CD20单抗+IA,结果62例ABOi-KT与167例ABOc-KT在1年和3年的移植肾和患者存活率及抗体介导的排斥反应(antibody mediated rejection,ABMR)发生率均无差异。YIN等[29]在ABO血型抗体滴度<1∶16时不使用抗CD20单抗,抗体滴度≤1∶8时仅口服免疫抑制剂,不使用单抗[30],取得良好结果,但样本量有限,需进一步观察。总之,术前使用抗CD20单抗更为稳妥。
5 围手术期抗凝
围手术期是否抗凝存在争议,有学者认为常规抗凝是必要的,有学者认为视凝血功能及引流液是否有血凝块决定是否使用抗凝剂,有的中心不常规抗凝。笔者临床采用不常规抗凝,尚未发生血栓等不良事件。是否抗凝,根据各中心经验和习惯而定。抗凝药物一般选择低分子肝素,其半衰期短,如遇活动性出血等情况,便于及时处理。
6 围手术期处理方案
围手术期处理方案总体分为美国方案和亚欧方案。美国方案:术前10 d口服免疫抑制剂+PE+IVIG+达利珠单抗,亚欧方案:术前2~4周CD20+口服免疫抑制剂+CD25/ATG+PE/DFPP。其中,亚欧方案又有多种具体方案。现列举几种常见方案供参考。
6.1 日本大阪医学院方案[31]
见图1。
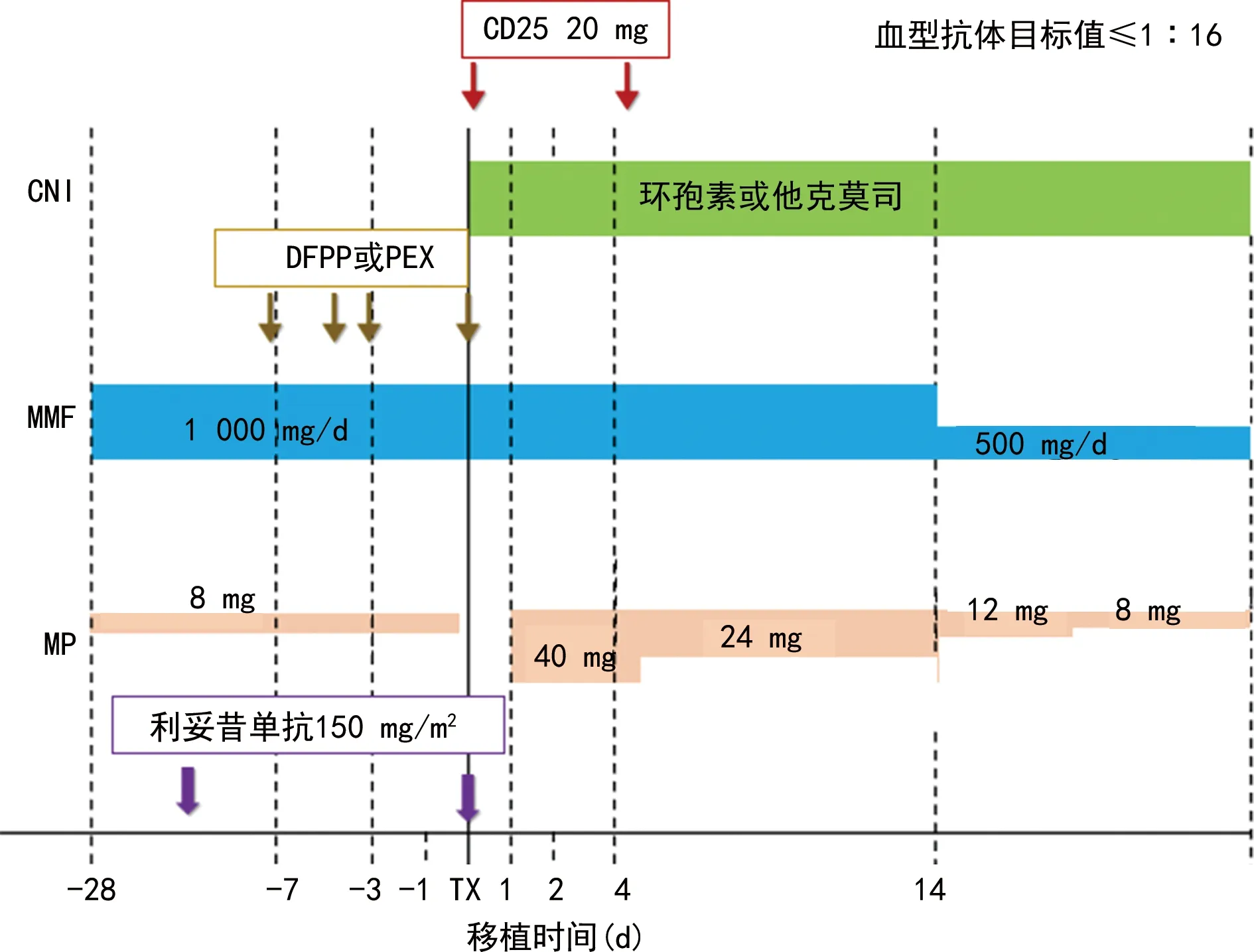
CNI:钙调神经磷酸酶抑制剂;MMF:吗替麦考酚酯;MP:糖皮质激素。图1 日本大阪医学院围手术期处理方案
6.2 美国霍普金斯方案[19]
见图2。
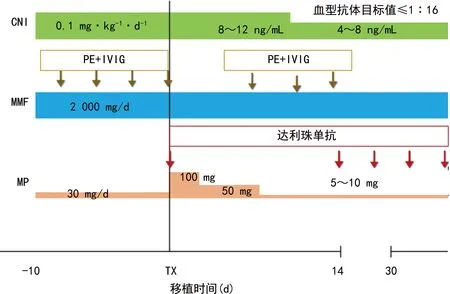
CNI:钙调神经磷酸酶抑制剂;MMF:吗替麦考酚酯;MP:糖皮质激素。图2 美国霍普金斯方案
6.3 德国海方案[19]
见图3。

CNI:钙调神经磷酸酶抑制剂;MMF:吗替麦考酚酯;MP:糖皮质激素。图3 德国海方案
6.4 中国主流方案[19]
见图4。

CNI:钙调神经磷酸酶抑制剂;MMF:吗替麦考酚酯;MP:糖皮质激素。图4 中国主流方案
6.5 陆军军医大学第一附属医院/西南医院肾科方案
见图5。陆军军医大学第一附属医院/西南医院方案住院时间仅需16 d左右,一次住院完成预处理和手术,大幅缩短了患者治疗所需时间,也避免了患者完成诱导治疗后无法如期返院进行手术。有行婴儿ABOi-KT不进行预处理报道,尚无大宗病例报道[32],是否值得推广,尚需进一步研究确定。
7 预后与展望
ABOi-KT已在国内外广泛开展,国内外研究均表明,疗效与安全性与ABOc-KT相当[29,33]。交换移植能解决部分ABO血型不相容问题,但不能完全替代ABOi-KT。在异种移植和人造器官广泛应用于临床之前[34-35],ABOi-KT不失为一个缓解器官严重短缺的有效途径[1,7,33,36-38]。

