对可注射用丝蛋白基三元水凝胶理化特性的验证
高子璐 刘玉增 管娟
丝蛋白也称丝素(silk fibroin,SF),通常指从蚕丝等动物丝中获取的天然蛋白质[1]。蚕丝纤维具备良好的机械强度、韧性、生物相容性,可以直接用作医学植入物或敷料[2-3]。通过溶解蚕丝获得丝蛋白水溶液的方式,可进一步获得水凝胶、薄膜、微球、支架等多种形态的丝蛋白材料[4-7],极大地拓展了丝材料的应用范围[8]。其中水凝胶能够为细胞提供类似生物组织中细胞外基质的环境,有利于细胞黏附、生长和增殖[9-10],为组织工程提供了一类理想的生物材料。丝蛋白水凝胶由丝蛋白分子通过物理或化学交联形成[11]。可注射水凝胶能够配合微创手术方式,不仅减轻了患者的不适感,还缩短了治疗时间,体现更大的经济性[12-13],在关节骨/软骨组织工程体现很大的临床应用潜力。临床应用对可注射水凝胶的要求还包括优异的生物相容性、适宜的粘度、优异的力学性能如韧性和可控的生物降解性等[14]。丝蛋白水凝胶同时具备上述水凝胶的多种性质,在力学性能上其模量可达到MPa级别[15-16],满足骨与软骨组织工程的需求。可注射水凝胶分为原位成型水凝胶和剪切变稀水凝胶[17]。原位成型是指通过注射装置将溶液注入目标生物组织后,溶液发生凝胶化逐渐转变为凝胶[18]。在室温条件下,丝蛋白水凝胶依靠β-折叠构象转变的物理凝胶化时间超过24 h[19],为满足临床要求,需引入可加速凝胶化的分子。本研究制备了一种原位成型丝蛋白基三元复合水凝胶,以丝蛋白作为连续网络或第 一相、羟丙基甲基纤维素(hydroxypropyl methyl cellulose,HPMC)作为体系的第二相、丙三醇(glycerin,G)作为体系的第三相[20],丙三醇的三羟基结构能有效促进丝蛋白凝胶化[21]。本研究关注水凝胶的凝胶化过程和流体性质,初步验证了可注射性和快速凝胶化性质,并表征了构象结构、微观形貌及力学性能,为面向骨、软骨组织工程应用开发可注射水凝胶提供参考。
资料与方法
一、资料
1. 材料:桑蚕茧购自上海复向科技有限公司;碳酸氢钠(NaHCO3)、溴化锂(LiBr)、聚乙二醇(PEG,分子量为100 000)、羟丙基甲基纤维素、透析袋(截留分子量分别为3 500、8 000 ~ 14 000)购自麦克林;丙三醇(glycerin,G)购自现代东方科技发展有限公司。
2. 丝蛋白溶液的制备:在David Kaplan 实验室提出的丝蛋白水溶液制备方法基础上[8],采用碱性更弱、更为温和的NaHCO3取代Na2CO3进行脱胶处理,将家蚕茧浸泡在沸腾0.02 M NaHCO3溶液中去除外层丝胶蛋白,获得仅包含丝蛋白的丝芯纤维。之 后 将10 g 脱胶 丝置 于100 ml 浓度9.3 mol/L 的LiBr 溶液,在40 ℃下进行溶解,得到丝蛋白的LiBr水溶液。经过透析处理及离心去除杂质,可得到清澈透明的浅黄色丝蛋白溶液,初始浓度一般为4 wt%左右。制备好的丝蛋白溶液放入4 ℃冰箱保存,1周之内开展后续实验。标定丝蛋白溶液的浓度使用称重法。取三份丝蛋白溶液滴于玻璃片上,称量溶液初始质量为m0,放入105 ℃烘箱烘干直至恒重mt。依据下式计算浓度,三次测量取平均值。
为获得更高浓度的丝蛋白溶液(如12 wt%、8 wt%),采用聚乙二醇溶液反透析的方式,将丝蛋白溶液浓缩至高浓度。
3. 三元溶液及水凝胶的制备:将10 wt% HPMC溶液分别与12 wt% 、8 wt%、4 wt%的SF 溶液及甘油按照表1 所示的质量比例进行混合,将混合溶液倒入玻璃小瓶内,加入转子,在37 ℃恒温水浴中以500 rpm 转速搅拌10 min,使体系组分充分、均匀混合。在37 ℃恒温水浴中记录溶液的凝胶化进程,采用倒置法判断凝胶终点,记录凝胶时间,观察凝胶宏观形貌。设计5 组三元体系,维持体系总质量相同为3 g,调节体系中SF溶液、HPMC 溶液、G的质量比例。A 组SF 溶液及HPMC 溶液的质量相同,均为1 g;B 组SF 溶液的质量为1.6 g,HPMC 溶液的质量为0.4 g。混合后体系中SF 和HPMC 的质量分数列于表1右侧。
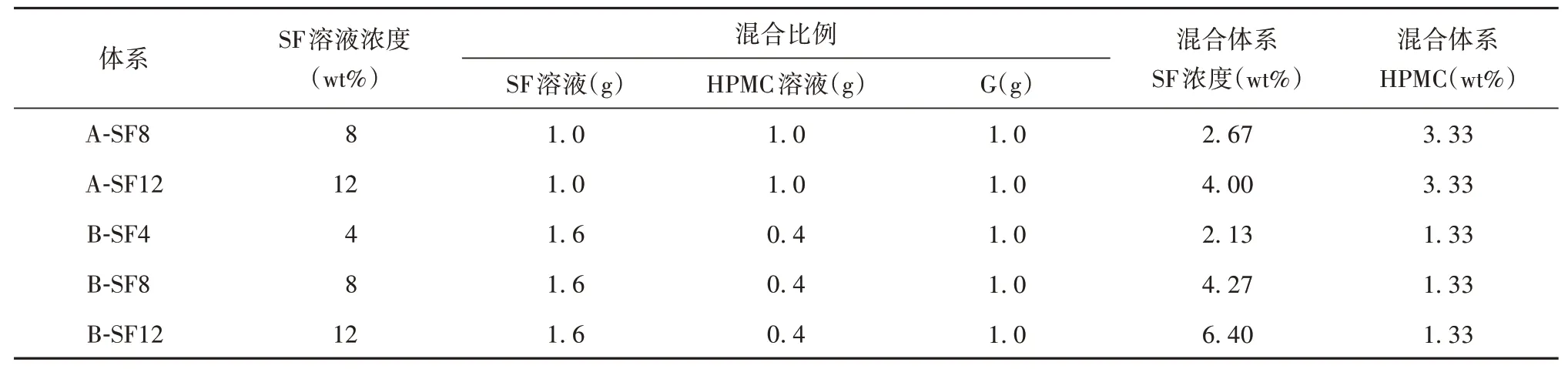
表1 SF-HPMC-G三元水凝胶样品
二、方法
1. 傅立叶变换红外光谱测试(fourier transform infrared,FTIR):采用傅里叶变换红外光谱仪(Nicolet iS20,Thermo Fisher Scientific)在表面衰减全反射(attenuated total refraction,ATR)模式下测试样品的红外吸收光谱。平衡态水凝胶先经冷冻干燥得到块体/薄膜试样后压片。测试时,先扫描并扣除空气背景,然后将样品表面紧贴于ATR 晶体表面采集红外光谱,分辨率为4 cm-1,扫描次数为32 次,测试波数范围为600~4 000 cm-1。用高斯模型对FTIR 曲线进行分峰拟合分析。经过基线校准后,使用PeakFit 分峰软件对酰胺I 区(1 600~1 700 cm-1)的吸收谱进行分峰处理,设定半峰宽为5 cm-1,峰的总数为10,获得的小峰根据文献[22]中所用方法划分为β-折叠、无规线团/螺旋和β-转角三种构象,统计峰的面积计算各构象的具体含量。
2. 扫描电镜表征:扫描电镜表征采用型号为JSM-6010LA 的扫描电镜设备、二次电子模式,电子的加速电压为20 kV。平衡态水凝胶经过冷冻干燥后得到海绵样品,经过表面喷金处理后,在扫描电子显微镜下观察微观形貌。
3. 流变学表征:SF-HPMC-G三元混合溶液的流变行为采用流变仪进行表征,仪器型号为DHR-2。使用帕尔帖板和40 mm 铝平行板夹具,在流动模式下进行剪切粘度测试/剪切速率扫描,剪切速率范围为0.1~1 000 s-1,并在震荡模式下进行动态粘弹性测试/时间扫描,以确定凝胶时间。
4. 力学性能测试:SF-HPMC-G三元水凝胶样品的力学性能测试采用动态热机械分析仪(Q800,TA Instruments,Waters Ltd.)。将8 mm 直径的三元水凝胶切割成高度为5 mm 的圆柱体压缩试样,每组3~5 个。压缩应变速率为20%/min,最大压缩应变设为-80%。每组样品获得3 个有效压缩力学数据。获得压缩应力-应变曲线后,对曲线最初线性段进行直线拟合,获得水凝胶的压缩弹性模量,每组压缩模量以±s表示。
结 果
1. 三元溶液水凝胶的流变行为:流动模式下的剪切速率扫描测试结果为粘度随剪切速率变化的曲线(图1)。震荡模式下的时间扫描测试结果为动态模量随时间变化的曲线(图2)。样品A-SF12 的储能模量G′和损耗模量G″随时间变化的曲线,两条曲线存在一交点,G′和G″的变化可以反映出高分子体系的粘弹性及流动特性变化。在交点前,G″>G′,体系偏向液体性质,表现出更多粘性;在交点后,G′>G″,体系偏向固体性质,表现出更多弹性。因此,体系在整个时间扫描过程中逐渐成胶,曲线交点即为凝胶点。样品A-SF12 凝胶点附近的模量-时间曲线,表明体系凝胶时间为4 150 s,约为1 h9 min。

图1 SF-HPMC-G三元溶液的粘度-剪切速率关系曲线
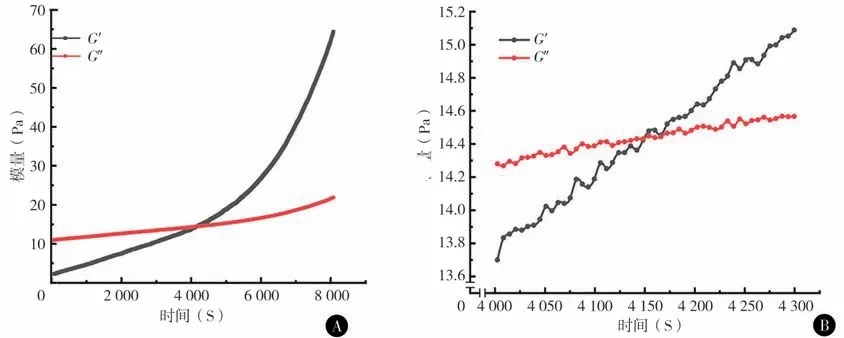
图2 A SF-HPMC-G三元溶液A-SF12的模量-时间曲线 B A-SF12的凝胶时间
2. 三元水凝胶的宏观及微观形貌:SF-HPMC-G三元水凝胶的宏/微观形貌(图3)。水凝胶中SF 含量的不同导致了多孔网络的孔隙尺寸差别。A组水凝胶的网络结构较B 组致密,孔尺寸更小。丝蛋白相对含量更高的B组水凝胶比A组水凝胶的β-折叠含量更高;丝蛋白浓度越高,β-折叠构象含量越高。

图3 SF-HPMC-G水凝胶SEM图 A A-SF12 B A-SF8 C B-SF12 D B-SF8 E B-SF4
3. 三元水凝胶的构象结构:傅立叶变换红外光谱通过识别不同基团的特征吸收峰给出化合物及材料的化学组成和构象结构等信息。5种水凝胶样品都具有β-折叠占主导的构象结构。小峰3、4对应β-折叠构象区间(1 620~1 640 cm-1),小峰5、6、7 对应α-螺旋和无规线团构象,小峰8、9、10 对应β-转角构象。各水凝胶样品构象的具体含量如图C 所示。采用红外光谱表征SF-HPMC-G 三元复合水凝胶的基团组成和丝蛋白构象的变化(图4)。
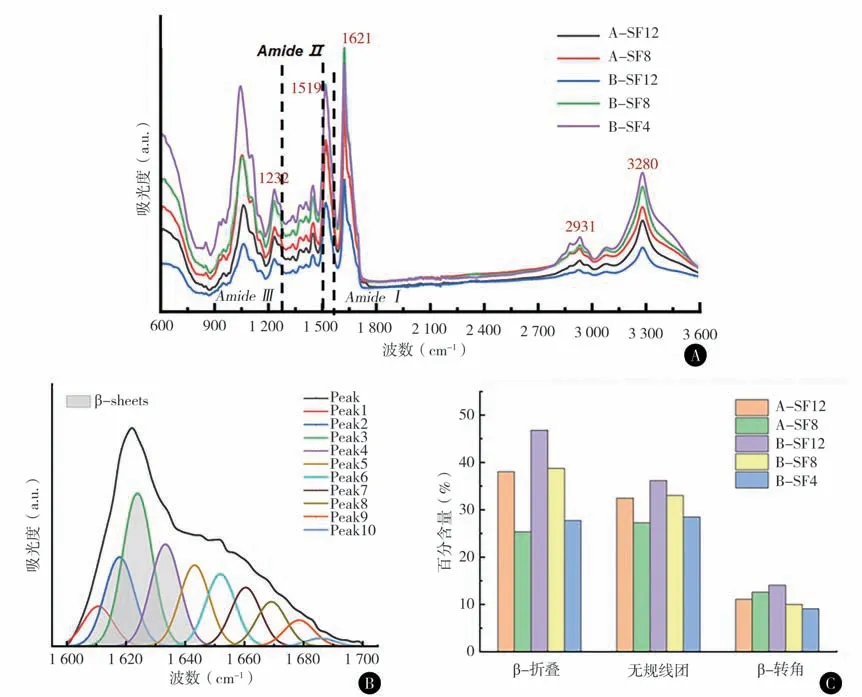
图4 A SF-HPMC-G 三元水凝胶的FTIR 谱图,酰胺键的特征吸收峰酰胺Ⅰ区、酰胺Ⅱ区和酰胺Ⅲ区中心位置在图中标注 B A-SF12 分峰结果 C 二级结构含量计算
4. 水凝胶的力学性能:三元水凝胶的压缩应力应变曲线及压缩模量,所有样品均能承受50%压缩应变而不失效(图5)。在5 种水凝胶体系中,A-SF-12的压缩模量最大,为~500 kPa。
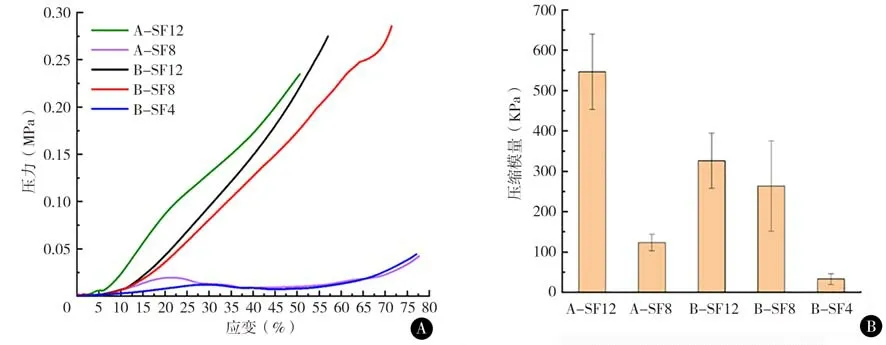
图5 SF-HPMC-G三元水凝胶的 A压缩应力应变曲线 B 压缩弹性模量
讨 论
1. 三元溶液/水凝胶的流变行为:流动模式下的剪切速率扫描测试结果为粘度随剪切速率变化的曲线,如图1所示。随着剪切速率的升高,溶液的粘度整体呈现降低趋势,即表现出“剪切变稀”行为[23]。剪切速率在10 s-1以上时,大部分三元溶液可以维持10 Pa·s 以下的较低粘度,体现较好的流动性,满足可注射的要求。由于其余样品凝胶时间过长,难以满足注射需要,不再展示。
2. 三元水凝胶的宏观及微观形貌:SF-HPMC-G水凝胶呈现典型的多孔网络结构,主要体现三元水凝胶的主体材料SF 的物理交联网络结构。随着SF含量增加,凝胶网络致密性提升,孔尺寸减小,其中A-SF12有最小的孔尺寸,形成了最为致密的多孔网络。值得注意的是,水凝胶的微观结构存在一定的不均匀性,这种三元复合水凝胶微观结构的不均匀性,可能由三相混合过程中局部凝胶化引起。
3. 三元水凝胶的构象结构:傅立叶变换红外光谱通过识别不同基团的特征吸收峰给出化合物及材料的化学组成和构象结构等信息。采用红外光谱表征SF-HPMC-G 三元复合水凝胶的基团组成和丝蛋白构象的变化。酰胺键的特征吸收峰酰胺Ⅰ区、酰胺Ⅱ区和酰胺Ⅲ区。对于SF-HPMC-G三元水凝胶体系,酰胺键仅存在于SF 分子中,酰胺Ⅰ区1 621 cm-1峰、酰胺Ⅲ区1 232 cm-1峰对应于SF 的β-折叠构象,而酰胺Ⅰ区1 650 cm-1峰、酰胺Ⅲ区1 260 cm-1峰对应于SF 的无规构象[24]。此外,FTIR图中3 280 cm-1峰是由于HPMC 中-OH 的拉伸振动和分子间H-键合引起的;2 929-2 931 cm-1峰则是由于-CH3 的拉伸振动,证明了水凝胶中HPMC 的存在。为了探究不同水凝胶中SF构象的相对含量,我们对酰胺I谱带的吸收峰进行了分峰处理。
4. 水凝胶的力学性能:在5 种水凝胶体系中,A-SF-12的压缩模量最大,为~500 kPa,这一结果与致密的微观网络结构和更高的β-折叠构象含量相对应。对于B 组,随着SF 浓度的提高,水凝胶的压缩弹性模量相应提升,表明SF浓度是丝蛋白水凝胶体系的模量和强度的主要决定因素。A-SF12 与B-SF8 三元水凝胶中,虽然SF 浓度相近,但HPMC 浓度分别是3.33 wt%、1.33 wt%,A-SF12 更高的压缩模量也来源于更高的HPMC 含量。因此,SF 作为连续网络和HPMC 作为增强相的含量共同决定了三元水凝胶的力学性能。
总之,SF-HPMC-G 三元水凝胶具有可注射和快速凝胶化的性质,在骨组织工程领域体现应用潜力,为可注射丝蛋白基水凝胶的设计提供了一种思路,有望拓展丝蛋白的应用。

