基于NOD2/NF-κB通路研究雷公藤多苷对糖尿病肾病大鼠的影响*
陈晨晨,宋丹,宋纯东,,郭婷,段风阳,王宁丽,张博,杨濛,王耀献
1.河南中医药大学,河南 郑州 450046; 2.河南中医药大学儿科医学院,河南 郑州 450000;3.河南中医药大学第一附属医院,河南 郑州 450000
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者中最常见的微血管并发症,也是导致终末期肾病(end-stage renal disease,ESRD)的主要原因[1]。DN病理变化复杂,主要包括肾小球肥大伴进行性系膜扩张和肾小管间质纤维化[2]。DN的发病机制尚未完全明确,目前认为是糖代谢异常、炎症反应、免疫反应、氧化应激、自噬、遗传易感等多种因素共同作用的结果[3-5]。研究发现,炎症信号通路核苷酸结合寡聚化结构域蛋白2(nucleotide-binding oligomerization domain 2,NOD2)/核转录因子-κB(nuclear transcription factor-κB,NF-κB)通路异常可导致肾组织受损,在DN的发生发展中发挥重要作用[6-7]。临床上对DN的治疗主要是控制饮食,降低血压、血糖、血脂及抗感染,抑制肾素-血管紧张素-醛固酮系统等[8]。雷公藤多苷(tripterygium wilfordii polyglycoside,TWP)是卫矛科植物雷公藤的主要活性成分,具有抗炎、免疫抑制等作用,临床上雷公藤多苷被广泛应用于DN的治疗[9]。本研究基于NOD2/NF-κB通路研究雷公藤多苷对糖尿病肾病大鼠的影响,以期进一步探讨其作用机制。
1 材料
1.1 动物42只SPF级雄性SD大鼠,体质量(190±10 g),购自郑州市惠济区华兴实验动物养殖场,许可证号:SCXK(豫)2019-0002,饲养于河南中医药大学第一附属医院中心实验室动物房,动物实验环境:SPF级屏障(IVC)环境,相对湿度(50±10)%,25 ℃恒温,12 h/12 h昼夜明暗交替。本实验由河南中医药大学第一附属医院伦理审查委员会批准,动物实验伦理审查批准编号:YFYDW2021013。
1.2 药物与试剂雷公藤多苷片(江苏美通制药有限公司,国药准字:Z32021007,规格:10 mg);缬沙坦(代文)胶囊(北京诺华制药公司,国药准字:H20040217,规格:80 mg);链脲佐菌素(streptozotocin,STZ,美国Sigma公司,货号:S1030)。柠檬酸钠缓冲液(北京索莱宝科技有限公司,货号:C1013);NOD2抗体、NF-κB抗体、HRP-山羊抗小鼠二抗、HRP-山羊抗兔二抗、β-actin抗体、RIPA裂解液、RNA提取液(武汉赛维尔生物科技有限公司,货号:GB31488、GB11997、GB25301、GB23303、GB15001、G2002、G3013);大鼠NOD2、NF-κB ELISA试剂盒(江苏酶免实业有限公司,货号:MM-0799R2、MM-0699R2);三氯甲烷、异丙醇、无水乙醇(国药集团化学试剂有限公司,货号:10006818、80109218、10009218);PCR引物由武汉赛维尔生物科技有限公司合成。
1.3 仪器AU5800型全自动生化分析仪(美国Beckman公司);DESK/MIDI/250/1000型全景切片扫描仪(匈牙利3DHISTECH公司);CFX型荧光定量PCR仪(美国Bio-rad公司);D3024R型台式高速冷冻型微量离心机[大龙兴创实验仪器(北京)有限公司,最大转速15 000 r·min-1,步长:10 r·min-1];NanoDrop2000型超微量分光光度计(美国Thermo Fisher Scientific公司);RT-6100型酶标检测仪(深圳雷杜生命科学股份有限公司);Neofuge 23R型冷冻离心机(力康生物医疗科技股份有限公司);ADW-1002-M型纯水仪(重庆艾科浦公司);DS-2S100型脱色摇床(武汉赛维尔生物科技有限公司);SVE-2型电泳仪(北京六一仪器厂)。
2 方法
2.1 动物分组、造模及给药42只大鼠适应性饲养1周后,随机选出8只作为空白组,给予标准饲料喂养;其余大鼠作为造模组,采用高脂高糖饲料喂养,并给予1% STZ(55 mg·kg-1)溶液一次性腹腔注射造模,造模3 d后连续监测血糖,当大鼠血糖≥16.7 mmol·L-1为糖尿病造模成功,继续高脂高糖饲料喂养,2周后测得大鼠尿蛋白呈阳性,为DN模型建立成功。24只造模成功大鼠采用随机数字表法分为模型组、缬沙坦组和雷公藤多苷组,每组8只。缬沙坦组和雷公藤多苷组大鼠分别给予缬沙坦(代文)胶囊(8.33 mg·kg-1·d-1)及雷公藤多苷片(5 mg·kg-1·d-1)溶液灌胃,空白组和模型组大鼠灌服等体积生理盐水,灌胃体积为10 mL·kg-1,每日1次,连续给药6周。
2.2 24 h尿蛋白定量检测灌胃结束后,禁食不禁水24 h,代谢笼收集大鼠24 h 尿液,离心后留取上清液检测24 h尿蛋白定量(24 hour urinary protein,24hUTP)。
2.3 全自动生化分析仪测定血糖(blood glucose,GLU)、血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)水平10%水合氯醛腹腔注射麻醉后腹主动脉取血,3 500 r·min-1(离心半径:10 cm)离心10 min,留取血清,全自动生化分析仪检测GLU、SCr、BUN水平。
2.4 HE染色观察大鼠肾脏组织病理变化取血后迅速剥离肾脏,右肾肾门冠状面切下1 cm×1 cm×1 cm大小样本置于4%多聚甲醛中。将固定后的肾脏组织进行梯度酒精脱水、二甲苯透明,石蜡包埋、冷却后切片、苏木精-伊红染色,光镜下观察肾脏组织病理形态改变。
2.5 ELISA法检测血清NOD2、NF-κB水平具体操作步骤严格按照ELISA试剂盒说明书进行。将血清样品加于酶标板孔底部,除空白孔外,每孔加入酶标试剂100 μL,封板膜封板后37 ℃孵育1 h,配液、洗涤,加入显色剂,37 ℃避光显色15 min,采用酶标仪于450 nm波长处测量各孔的吸光度值。
2.6 Western Blot法检测肾组织NOD2、NF-κB蛋白表达水平冻存管中的肾组织以PBS洗涤3次,剪碎后加裂解液匀浆,匀浆后12 000 r·min-1,4 ℃ 离心10 min,收集上清,即为总蛋白溶液,BCA蛋白浓度测定试剂盒检测蛋白浓度,沸水浴变性 15 min,-20 ℃保存备用,蛋白样品进行SDS-PAGE电泳,300 mA恒流转膜30 min,室温封闭 30 min,加入一抗(稀释比例为1:1 000)4 ℃摇床孵育过夜,加入二抗(稀释比例为1:5 000)室温孵育30 min;压胶片、显影、定影,胶片扫描存档,Photoshop整理去色,Alpha软件处理系统分析目标条带的光密度值,蛋白相对表达量为目的蛋白条带灰度值与内参蛋白条带灰度值的比值。
2.7 荧光定量PCR法检测肾组织NOD2、NF-κBmRNA表达水平总RNA抽提后逆转录合成 cDNA,PCR扩增条件:95 ℃预变性10 min;95 ℃变性15 s、60 ℃退火/延伸30 s(40个循环),65 ℃→95 ℃ 每升温0.5 ℃采集一次荧光信号。采用2-△△CT法进行计算分析。引物序列见表1。
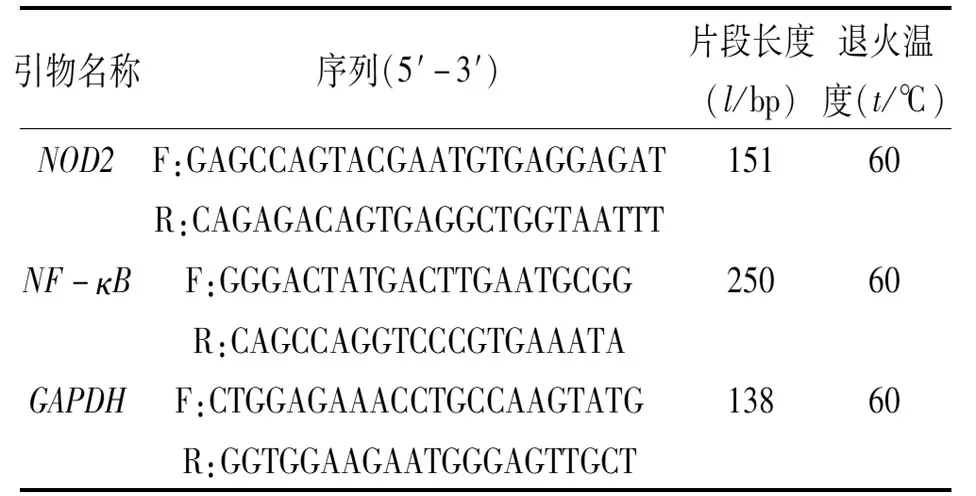
表1 PCR扩增引物序列

3 结果
3.1 各组大鼠GLU、SCr、BUN、24 hUTP结果比较与空白组比较,模型组大鼠GLU、SCr、BUN、24 hUTP 水平明显升高(P<0.05);与模型组比较,给药组大鼠GLU、SCr、BUN、24 hUTP水平明显降低(P<0.05)。见表2。

表2 各组大鼠GLU、SCr、BUN、24hUTP结果比较
3.2 各组大鼠肾脏病理结果比较光镜观察发现,与空白组比较,模型组大鼠肾小球肥大,肾小管上皮细胞气球样变性,胞质空泡化,肾血管淤血、扩张,基底膜增厚;与模型组比较,两个治疗组大鼠肾脏组织病理改变较轻,肾小球未见明显病理改变,表现为肾小管轻度增厚、扩张。见图1。

注:A:空白组;B:模型组;C:缬沙坦对照组;D:雷公藤多苷组。图1 各组大鼠肾脏病理变化(HE染色,×400)
3.3 各组大鼠血清NOD2和NF-κB 水平比较与空白组比较,模型组大鼠血清NOD2、NF-κB水平明显升高(P<0.05);与模型组比较,给药组大鼠血清NOD2、NF-κB水平均明显降低(P<0.05)。见表3。

表3 各组大鼠血清NOD2和NF-κB水平比较
3.4 各组大鼠肾组织NOD2和NF-κB蛋白表达水平比较与空白组比较,模型组大鼠肾组织NOD2、NF-κB 蛋白表达水平明显升高(P<0.05);与模型组比较,给药组大鼠肾组织NOD2、NF-κB蛋白表达水平均明显降低(P<0.05)。见图2、表4。
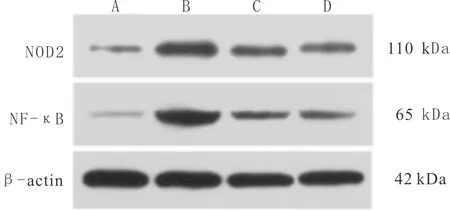
注:A:空白组 B:模型组 C:缬沙坦对照组 D:雷公藤多苷组。图2 各组大鼠肾组织NOD2、NF-κB蛋白电泳条带

表4 各组大鼠肾组织NOD2、NF-κB蛋白表达水平比较
3.5 各组大鼠肾组织NOD2和NF-κBmRNA表达水平比较与空白组比较,模型组大鼠肾组织NOD2、NF-κBmRNA表达水平明显升高(P<0.05);与模型组比较,两治疗组大鼠肾组织NOD2、NF-κBmRNA表达水平均明显降低(P<0.05)。见表5。

表5 各组大鼠肾组织NOD2、NF-κB mRNA表达水平比较
4 讨论
雷公藤始载于《神农本草经》,属卫矛科植物,其化学成分复杂,主要包括二萜类、三萜类、生物碱类、糖类、倍半萜类等[10]。雷公藤制剂作为免疫抑制剂类药物,广泛应用于多种原发及继发性肾脏疾病,可有效减少尿蛋白,延缓肾损伤[11-13]。雷公藤多苷是雷公藤的主要活性成分,可通过抗炎、降低氧化应激、降低胰岛素抵抗、保护足细胞、修复肾小管间质损伤等途径治疗DN,且具有多组分、多靶点、多系统的特点[14]。既往研究发现,雷公藤多苷治疗DN效果明显,其机制可能与下调DN大鼠肾组织Ras同源基因家族成员A(Ras homolog gene family,member A,RhoA)、Rho相关的卷曲螺旋激酶1(Rho associated coiled coil-forming kinase 1,ROCK1)有关[15]。此外多项研究结果也表明,雷公藤多苷在治疗DN上有很好的应用价值[16-18]。本研究结果同样表明,雷公藤多苷可抑制NOD2/NF-κB通路,改善肾脏功能,发挥治疗作用。
DN在糖尿病患者中的发病率超过40%,且在我国的发病率呈逐年上升趋势,已成为ESRD的主要病因,严重影响了患者的生活质量[19]。DN的发病机制尚未完全阐明,目前认为免疫反应及炎症反应在其发病过程中作用重大。天然免疫模式识别受体(pattemrecognition receptors,PRRs)是先天免疫系统中的重要成分,NOD样受体是其主要的亚家族之一,可影响自身免疫、炎症疾病的转归等[20-23]。NOD的亚型NOD2于炎症细胞和肾脏中高表达,是DN中连接肾损伤、炎症和足细胞胰岛素抵抗的信号转导通路的关键成分之一[24]。NF-κB蛋白是Rel蛋白家族的核转录因子,NF-κB通路激活能促进多种炎性细胞因子的表达[25-26],使肾脏炎症反应进一步增强,在DN的发病中发挥重要作用[27-28]。王露等[29]通过临床观察发现,DN患者血清NF-κB水平明显升高,且与患者肾功能指标均存在相关性,可能是NF-κB引起的炎症反应加重肾脏负担从而引起一系列肾功能指标发生变化。NOD2与 NF-κB 关系密切,NOD2能够诱导NF-κB的激活,并触发细胞信号级联,促使细胞因子和趋化因子表达,导致DN患者肾脏细胞损伤和进行性纤维化[30]。研究也证实,调节NOD2/NF-κB通路可以改善DN肾脏损伤,因此,抑制NOD2/NF-κB的表达可能是治疗DN的新靶标[31]。本研究发现,雷公藤多苷可通过抑制此通路改善DN大鼠肾功能,进一步明确了雷公藤多苷对DN的治疗作用及作用机制。
通过对比发现,模型组大鼠肾脏病理损伤严重,表现为肾小球肥大、基底膜增厚、肾小管上皮细胞及肾血管多处损伤,雷公藤多苷组肾脏病理损害程度较轻,肾小球未见明显病理改变,表现为肾小管轻度增厚、扩张。此外,两治疗组GLU、SCr、BUN及 24 hUTP 水平降低,且雷公藤多苷组降蛋白作用相对优于缬沙坦对照组,提示雷公藤多苷可有效降低大鼠血糖及蛋白尿水平,改善肾功能,延缓肾损伤。
综上所述,雷公藤多苷可通过抑制NOD2/NF-κB通路活性减轻肾损伤,从而发挥对DN大鼠的治疗作用。本研究对临床应用雷公藤多苷治疗DN提供了参考,考虑到临床应用雷公藤多苷时存在一定的毒副作用,其临床应用剂量需要通过进一步研究确定。

