6 个香菇L135 菌株主要性状的比较分析
刘 昆 蒋 俊 宋小亚 路新彦 曾凡清 应国华
(丽水市农林科学研究院 浙江 丽水 323000)
香菇(Lentinulaedodes)具有重要的食用和药用价值,在中国已经有800 余年的栽培历史[1-2]。据中国食用菌协会统计,2021 年我国香菇鲜品总产量近1 300 万吨,占所有食用菌总产量的31.34%,是我国第一大菇种[3]。随着栽培规模与菌种使用年数的增加,主栽品种在历经数次传代、分离、保藏、繁育和运输后,出现了菌种退化现象,给香菇产业健康发展带来不良影响。
香菇品种L135(国品认菌2007005)为福建省三明市真菌研究所于2007 年筛选育成。为低温晚熟型品种,菌龄160~200 天,子实体柄短肉厚,菇形圆正,鳞片少,易形成花菇。其菌丝抗逆性较差,抗杂菌能力较弱,不耐高温,不易越夏,适宜32 ℃以下区域或海拔较高、气温凉爽地区栽培。浙江省庆元县、景宁县等高海拔山区因夏季凉爽、冬季温差大,满足L135 品种特性要求,因而L135曾被菇农广泛栽培。近年来,L135 品种在生产中逐渐表现出烂棒率高,产量低,菇小、畸形等问题,给菇农带来了严重的经济损失[4]。
为研究香菇L135 品种退化的原因,探索香菇品种退化的内在机理,本文以6 个不同来源的生产用L135 菌株为实验材料,对其菌丝形态、漆酶活性、抗高温能力、栽培产量、子实体特征等进行比较分析,期望筛选出遗传稳定、性状较好与明显退化的菌株,为进一步研究香菇种性退化机理奠定基础,为香菇品种选育提供指导。
1 材料与方法
1.1 供试菌株
从丽水各地收集不同来源且栽培中使用的香菇L135 品种菌株,经初步筛选后获得6 株表型差异明显的菌株,编号分别为:L135-1、L135-18、L135-19、L135-21、L135-29、L135-30。为了确定菌株的真实性,以上海农业科学院食用菌研究所提供的L135 菌株为对照,按照国家农业标准NYT 1845—2010《食用菌菌种区别性鉴定拮抗反应》、NY/T 1743—2009《食用菌菌种真实性鉴定 RAPD法》、NY/T 1730—2009《食用菌菌种真实性鉴定ISSR 法》,对6 个菌株进行了真实性鉴定,鉴定结果显示所有菌株均真实可靠。
1.2 实验方法
1.2.1 培养基制作
马铃薯葡萄糖琼脂粉(PDA)培养基:购自荣研生物科技(中国)有限公司,按照说明书加热溶解,于121 ℃灭菌20 min,待温度降至60 ℃左右时,分装于直径90 mm 培养皿中,每皿20 mL。
木屑培养基:培养基配方为杂木屑78%、麦麸20%、红糖1%、石膏1%,料水比为1∶1.2,pH自然。取木屑培养基45 g 分装于20 mm×300 mm试管中,使用木棒压平至固定高度,硅胶塞封口,121 ℃灭菌60 min,冷却至常温后备用。
木屑琼脂培养基:培养基配方为杂木屑(粉碎机粉碎2 min,10 目过筛)78 g、麦麸20 g、石膏1 g、葡萄糖1 g、琼脂粉16 g,混合搅拌均匀后,称取2.90 g 分装到100 mL 三角瓶,加水25 mL,于121 ℃灭菌30 min,待温度降至60 ℃左右时,分装于直径90 mm 培养皿中,每皿20 mL。
愈创木酚(POD)培养基:PDA 培养基中加入0.04%愈创木酚,于121 ℃灭菌20 min 灭菌后分装于90 mm 培养皿中,每皿20 mL[5]。
漆酶活性定量试剂盒:购自北京索莱宝科技有限公司。
1.2.2 菌株活化
将试验菌株从试管斜面中接种于PDA 平板中心,于25 ℃下活化培养7 天,使用7 mm 打孔器,在菌落边缘同步生长菌丝处取菌丝块,用于后续试验。
1.2.3 菌株性状检测
菌丝形态观察。将活化菌丝块分别接种于PDA平板与木屑琼脂培养基中心,每个菌株3 个重复,于25 ℃培养30 天,观察菌丝形态生长变化情况。
菌丝生长速度测定。将3 块活化菌丝块接种于装有木屑培养基的试管中心,于25 ℃温度下直立培养,待菌丝生长1 cm 时,划起始生长线,最快菌株菌丝生长至距试管底部1 cm 时划终止生长线,测量生长距离,计算日均生长速度。
漆酶活性定性测定。将活化菌丝块接种于POD平板上,每个菌株3 个重复,25 ℃培养8~12 天,每天定时记录有无红棕色变色圈的产生及变色圈直径的大小,记录变色圈直径。根据变色圈的直径大小,检测漆酶产生能力。
漆酶活性定量测定。将活化菌丝块分别接种于铺有半透膜的木屑培养基平板上,每个菌株3 个重复,25 ℃培养15 天,收集菌丝体。于液氮中将菌丝体研磨成粉末状。按照漆酶活性检测试盒说明书进行漆酶定量测试。
高温协迫检测。将3 块活化菌丝块接种于装有木屑培养基的大试管中,25 ℃培养7~10 天后,划起始生长线。随后置于42 ℃高温处理4 h 后,继续25 ℃培养,菌丝距试管底部1 cm 时,划终止生长线,测量生长距离,计算高温胁迫处理后菌丝生长速度。
农艺性状检测。栽培地点位于浙江省丽水市景宁县包凤村,在高棚内采用常规层架式栽培出菇管理。栽培料配方为杂木屑79%,麦麸20%,石膏1%,含水量55%~60%,pH 自然。栽培袋规格为15 cm×55 cm,每袋填装栽培料1.8 kg,常压灭菌,开放式接种。每个菌株设3 个小区重复,每重复36 棒。子实体菌幕裂开但未完全消失时进行采摘,统计单棒产量。每个菌株随机挑取100 个子实体,测量子实体单菇重,菌盖直径、厚度,以及菌柄直径和长度。
1.2.4 数据分析
使用R 软件进行统计分析。
2 结果与分析
2.1 香菇L135 不同菌株菌丝形态
分别接种到PDA 培养基和木屑琼脂培养基的6 个L135 菌株菌丝形态差异明显(图1)。在PDA培养基中,菌株L135-1、L135-18、L135-19 菌丝较稀疏,无加厚隆起,无原基形成。在木屑琼脂培养基中,菌株L135-1 菌丝明显稀疏,L135-18、L135-19 菌丝相对较浓,但无褐色斑点、子实体原基发生。菌株L135-21、L135-29、L135-30 在两种培养基均出现菌丝局部加厚隆起、变色及出现子实体原基形态等现象,与大田栽培中正常菌棒转色前期菌丝隆起现象类似。

图1 香菇L135 不同菌株在PDA 培养基(上)和木屑琼脂培养基(下)的菌丝形态
2.2 香菇L135 不同菌株菌丝生长速度
如表1 所示,在木屑培养基中,6 个菌株菌丝生长速度差异明显,其中以L135-29、L135-30 较快,分别为7.31 mm/d和7.24 mm/d;L135-21次之;L135-1、L138-18、L135-19 均低于7.0 mm/d,L135-1最慢,仅5.17 mm/d,显著低于其他菌株。

表1 香菇L135 不同菌株菌丝生长速度
2.3 香菇L135 不同菌株菌丝漆酶活性定性分析
L135 菌株漆酶活性测定结果表明(表2、图2),不同菌株之间差异明显。L135-1 菌株在POD 平板上的菌丝呈絮状,氧化圈颜色较浅;L135-18、L135-19 菌株在POD 平板中的菌丝致密,氧化圈颜色最深;L135-21、L135-29、L135-30 菌株在POD平板中菌丝量居中,氧化圈颜色较浅。综合得出6个菌株漆酶活性从高到低依次为:L135-21、L135-30、L135-29、L135-1、L135-18、L135-19。

表2 香菇L135 不同菌株的漆酶活性
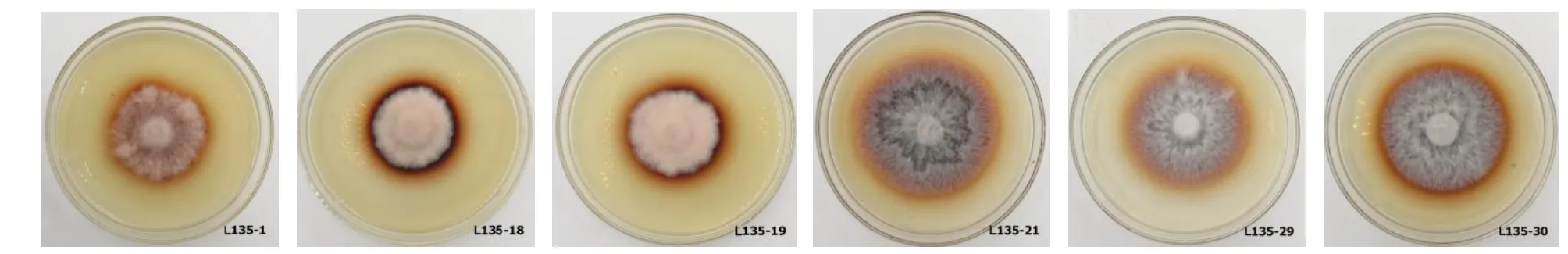
图2 香菇L135 不同菌株在POD 平板培养基上的生长表现
2.4 香菇L135 不同菌株菌丝漆酶活性定量分析
漆酶活性定量分析结果(表2)表明,6 个菌株之间差异明显,不同菌株之间的漆酶活性变化趋势与定性测试结果相近。菌株L135-30、L135-21、L135-29 漆酶活性仍较高,其余3 个菌株漆酶活性表现较差,其中L135-1 菌株漆酶活性仅为31.37 U/g,远低于其他菌株。
2.5 香菇L135 不同菌株抗高温能力
6 个L135 菌株经42 ℃处理4 个小时后,菌丝长势与生长速度出现明显的差异(表3、图3)。在菌丝长势方面,以菌株L135-21 菌丝表现浓密、洁白,其他5 个菌株呈现出不同程度的菌丝淡化现象。在生长速度方面,菌株L135-21、L135-29、L135-30 较快,3 个菌株间无显著差异,L135-18、L135-19 菌株次之,L135-1 最慢。表明抗高温能力菌株L135-21 较强,其余菌株偏弱。

表3 香菇L135 不同菌株高温胁迫后生长速度

图3 香菇L135 不同菌株高温胁迫后菌丝生长情况
2.6 香菇L135 不同菌株子实体形态
在子实体形态方面(表4),菌株L135-29 的单菇重、菌盖直径和厚度、菌柄长度和直径均显著优于其他菌株,但其有36%的子实体菌盖中心会向上明显伸长,呈典型的尖顶形状,商品性状反而较差;L135-21 单菇重等5 个指标居次,而子实体尖顶率较低,仅0.94%;L135-1、L135-30 子实体整体均偏小,表现较差。L135-18、L135-19 在越夏过程中菌棒烂棒严重,子实体数量较少,未能进行有效统计分析。

表4 香菇L135 不同菌株子实体形态特征数据
2.7 香菇L135 不同菌株栽培产量
如表5 所示,6 个菌株的子实体产量差异显著。L135-1、L135-21、L135-29 每棒平均产量均超过280 g,明显高于另外3 个菌株,3 菌株之间产量差异不显著。菌棒转色速度,L135-1 明显慢于其他菌株,且出菇集中于前两潮,子实体较小,商品价值不高。菌株L135-18、L135-19、L135-30 产量极低,不适合栽培生产。

表5 香菇L135 不同菌株栽培产量
3 结论与讨论
同一品种不同菌株间遗传背景相近,从中筛选出性状优良与疑退化菌株,更容易以彼此为参照,探索香菇品种退化的内在机理。本研究以丽水当地生产中曾广泛栽培的L135 品种为试验对象,共收集30 余份不同来源的菌株,经前期栽培筛选,初步获得6 株表型差异较显著的菌株。为了验证这些菌株的遗传稳定性与性状差异,为后续研究奠定材料基础,本文对L135 品种6 个不同表型菌株的菌丝形态、菌丝生长速度、产漆酶能力、抗高温能力、子实体形态、栽培产量等方面进行分析。
菌株L135-1 在菌丝形态、漆酶活性、抗高温能力等方面均表现较差,但栽培产量较高,与L135-21、L135-29 无显著差异,且出菇期集中在前2 潮,但子实体较小,栽培效益不高。L135-30 耐高温能力、产漆酶能力虽然较高,但产量与子实体形态均较差。L135-18 与L135-19 在各个方面均表现较差,且在越夏过程中菌棒烂棒严重,产量极低。综合以上结果,L135-1、L135-18、L135-19、L135-30共4 个菌株初步判定为退化明显株系,并且可能代表着3 个不同的退化类型,可作为后续退化机理研究的代表菌株。
菌株L135-21 的菌丝体形态正常、漆酶活性高,抗高温、产量高、子实形态较好,性状良好,可作为后续分析的正常对照菌株。相比 L135-21,L135-29 各性状也较好,但其尖顶子实体占比较高,商品价值低,菌株整体性状一般。
在前期预实验中发现,6 个L135 菌株在PDA培养基中的生长速度、耐高温能力与菌丝体形态、子实体形态、栽培产量等并没有较好的对应关系。为了获得各性状可相互对应的数据,本研究中菌丝体形态、菌丝生长速度、高温胁迫等实验均使用了与栽培相近的木屑培养基,结果发现木屑培养基优于PDA 培养基,更适合不同菌株之间的相互比较。但木屑琼脂培养基因颜色较深,对漆酶活性的定性测试有影响,未能在相应实验中使用。
香菇属于白色木腐菌,在栽培过程对木屑中的木质素、纤维素、半纤维素具有明显的降解作用[6]。漆酶是分解木质素的重要酶,对其进行检测可反映香菇菌丝对栽培基质的利用能力。除了降解木质素作用外,漆酶在色素合成、子实体形成、脱毒等方面都扮演了重要的角色[7]。漆酶对香菇生长有着重要作用,本研究中部分菌株的菌丝产漆酶能力与菌丝形态、栽培产量、子实体形态、抗高温能力等指标也有一定的相关性。但香菇菌丝中的其他氧化酶可能也会对愈创木酚进行氧化[7],造成定性测试与定量测试有一定的误差,后续还需要对漆酶定性试验进行改进,提升其准确性。

